
Карцев В.Г.Избранные методы с-за и модифик. гетероциклов т.1 , 2003
.pdf
Расчетные данные позволяют проследить следующие закономерности: введение атомов фтора в ароматическое кольцо хромона фактически не влияет на распределение зарядов в пироновом цикле; максимальный положительный заряд локализован на атоме углерода С(9); следующий по величине заряд расположен на атоме С(4) пиронового цикла; максимальный положительный заряд во фторароматическом цикле локализован на атоме С(5) [7]. В пироновом цикле эфира и кислоты максимальное значение индекса Фукуи для НСМО имеет центр С(2), а следующее в порядке убывания значение – на центре C(4). В анионе напротив, максимальное значение на центре C(4). Во фторароматическом кольце максимальное значение индекса Фукуи соответствует центру С(7) эфира и кислоты, а далее в порядке убывания – С(5) и С(8). В анионе максимальное значение соответствует центру С(7), а затем – С(8) и С(5) [7]. Таким образом, в условиях кинетического контроля реакции хромонов с нуклеофильными реагентами при прочих равных условиях в соответствии с зарядовым контролем должны проходить преимущественно по центру С(9) сложноэфирной, карбоксильной групп и аниона кислоты. В соответствии с орбитальным контролем в эфире и кислоте реакции должны проходить по центру С(2) и затем по С(4) пиронового цикла эфира и кислоты, а в анионе – по С(4).
Орбитально-контролируемое нуклеофильное замещение атома фтора должно преимущественно проходить по центру С(7) и далее в порядке убывания – по С(5).
Хромон-2-карбоновая кислота 3с и ее эфир 3а обладают различной реакционной способностью по отношению к аммиаку и первичным аминам [10].
Так, 2-этоксикарбонилхромон 3а не удается вовлечь в реакцию с аммиаком и анилином, а с метиламином он реагирует по сложноэфирной группе и атому С(7) фторированного кольца (схема 5), давая N-метиламид-7-метиламино-5,6,8-три- фторхромон-2-карбоновой кислоты 10 [10], что не типично для известных нефторированных хромоновых структур, претерпевающих в этих условиях расщепление гетерокольца вследствие присоединения нуклеофила по атому С(2) [11]. Под действием циклогексиламина в хромоне 3а происходит только замещение атома фтора при С(7) с образованием 7-циклогексиламино-5,6,8-трифтор-2-этоксикарбо- нилхромона 11 [7]. Следует отметить, что замещение при атоме углерода С(7) происходит в соответствии с орбитальным контролем реакции, а образование метиламида по центру С(9) в соответствии с зарядовым контролем.
Взаимодействие хромона 3а с вторичными аминами (морфолином, N-метил- пиперазином, пиперидином) происходит аналогично, не затрагивая гетероцикл (что характерно для реакций нефторированных хромонов с вторичными аминами), и приводит к образованию соответствующих 7-R-5,6,8-трифтор-2-этоксикарбонил- хромонов 12а–с. Хромон 12а при кипячении с HCl дает 7-морфолино-5,6,8-три- фторхромон-2-карбоновую кислоту 13 [10].
Таким образом, взаимодействие 2-этоксикарбонилхромона 3а с первичными и вторичными аминами является орбитально-контролируемым и приводит к продуктам замещения по центру С(7).
В противоположность 2-этоксикарбонилхромону 3а при реакции 2-карбокси- хромонов 3с, 13 с аммиаком легко происходит расщепление, в 2-амино-3-(2-гид- рокси-4-R-3,5,6-трифторбензоил)акриловые кислоты 14a, b, способные к рециклизации в исходные соединения 3с, 13 при кипячении в кислой среде [10] (схема 6).
Генеральный спонсор и организатор – InterBioScreen Ltd. |
147 |
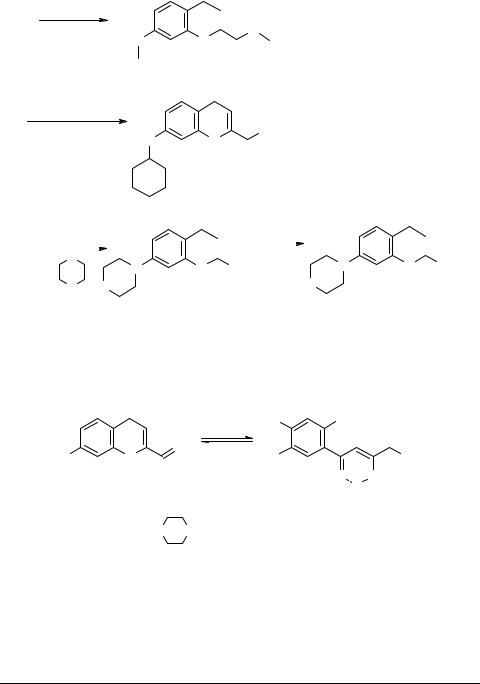
Схема 5
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
MeNH2 |
|
|
|
|
|
|
F |
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
MeCN, 20°C |
HN |
|
|
O |
|
|
|
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
10 (41%) |
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3a |
cyclo-C6H11NH2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
F |
|
|
|
|
|
OEt |
|
|
|
|
|
|
|
|
|
|||||||||||||
∆ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
HN |
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
11 (31%) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
||||||
|
Et3N, MeCN |
|
|
|
|
F |
|
|
|
|
|
|
|
|
|
HCl |
|
|
F |
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
X |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
X = O |
|
|
|
|
|
|
|||||||
|
|
|
|
|
N |
|
|
O |
CO Et |
N |
|
|
|
O CO2H |
||||||||||||||||
|
N |
X |
|
|
|
|
|
2 |
|
|
O |
|
|
|
|
|
|
|
|
|
||||||||||
|
12a−c (47−52%) |
|
|
|
13 (70%) |
|
|
|||||||||||||||||||||||
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
12: X = O (a), NMe (b), CH2 (c) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Схема 6 |
|
|
|
|
O |
|
|
|
NH ; |
|
|
F |
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
R |
|
|
F |
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
+ |
3 |
|
|
|
|
|
|
|
O |
|
|
|
|
|
|||||||
|
|
F |
|
|
|
|
|
|
H , 20°C |
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
R |
|
|
O |
|
|
|
H+, ∆ |
|
F |
|
|
O H NH |
OH |
||||||||||||||||
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|||||
|
|
|
|
3c, 13 |
|
|
|
|
|
|
|
|
|
|
|
|
14a, b (49−57%) |
|
|
|
|
|
||||||||
|
R = F (3c, 14a), O |
N (13, 14b) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
В отличие от 2-этоксикарбонилхромона 3а взаимодействие хромон-2-карбо- новой кислоты 3с с первичными аминами определяется как природой амина, так и условиями проведения реакции [7]. Так, хромон 3с при кипячении в диоксане с эквимольным количеством амина (циклогексиламина, гексиламина) дает 5,6,7,8- тетрафтор-2-хромонкарбоксилат циклогексиламмония (гексиламмония) 15a, b (схема 7). Соли 15a, b устойчивы при длительном кипячении в толуоле, а с избыт-
148 |
Пленарные доклады |
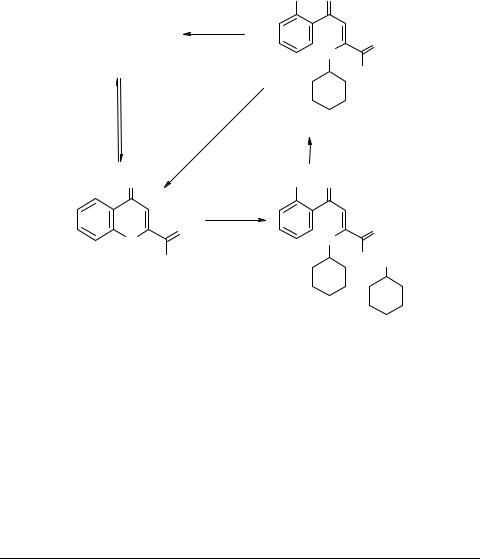
ком реагирующего амина ведут себя неоднозначно. Так, соединение 15a претерпевает раскрытие гетерокольца хромона с образованием 2-циклогексиламино- 3-(2-гидрокси-3,4,5,6-тетрафторбензоил) акрилата циклогексиламмония 16. При подкислении этой соли выделена 2-циклогексиламино-3-(2-гидрокси-3,4,5,6-тетра- фторбензоил)акриловая кислота 17. Гексиламмонийная соль 15b после обработки соляной кислотой дает исходный хромон 3с [7].
C6H11NH2
3c
RNH2 H+, H2O
∆
O
F
C6H11NH2
O
O
+ O− RNH3
15a, b (40−87%)
R = cyclo-C6H11 (a), C6H13 (b)
Схема 7
OH O
F
O
HN
OH
17 (45%)
HCl
OH O
F
O
HN
O− +
NH3
16 (46%)
При взаимодействии хромона 3с в смеси хлороформа с водой при 30–35°С с гексиламином и анилином может проходить нуклеофильное присоединение амина по активированной связи С=С и реакция по карбонильной группе (атом С(4)) хромона, в связи с чем 2-карбоксихромон 3с можно охарактеризовать как типичный карбонильный винилог [10]. Так, хромон 3с реагирует с гексиламином, давая 2,4-бис(гексиламино)-4-гидрокси-5,6,7,8-тетрафтор-2-хроманилкарбоксилат гексиламмония 18 (схема 8). Последний при подкислении превращается в 2-гексила- мино-2-карбокси-5,6,7,8-тетрафторхроман-4-он 19. С анилином хромон 3с образует 4-анилино-4-гидрокси-5,6,7,8-тетрафтор-2-хроманилкарбоксилат анилиния 20 [10].
Генеральный спонсор и организатор – InterBioScreen Ltd. |
149 |
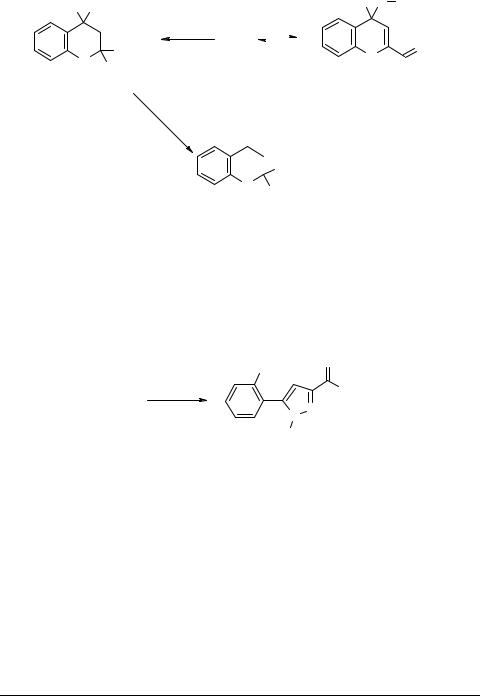
Схема 8
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HO N Ph |
|
|
|||
HO N C6H13 |
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
PhNH2 |
|
|
||||||||||||
|
|
|
|
|
C6H13NH2 |
|
|
|
|
|
|||||||
F |
|
|
CO−2 |
3c |
|
|
|
|
|
F |
O |
|
|||||
|
|
|
|
|
|
|
|||||||||||
|
|
+ |
|
|
|
||||||||||||
O |
|
|
|
|
|
|
|
O |
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
||||||||
N |
|
C6H13 |
|
|
|
|
H |
|
|
|
− |
|
|||||
+ |
|
|
|
|
|
|
|
|
|
|
O |
+ |
|||||
|
H |
|
|
|
|
|
|
|
|
|
|
|
|||||
C6H13NH3 |
|
|
|
H+, H2O |
|
|
|
|
|
|
|
|
|
|
PhNH3 |
||
18 (78%) |
|
|
|
O |
|
|
|
20 (36%) |
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
F |
|
|
|
|
CO2H |
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
O |
|
|
|
||||||||
|
|
|
|
|
|
|
N |
|
C6H13 |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
19 (81%) H |
|
|
|
|
|
|
||||||
2-Этоксикарбонилхромон 3a в реакции с гидразином дает трудно идентифицируемую смесь продуктов. 2-Карбоксихромон 3с более селективно реагирует с гидразином и фенилгидразином, образуя соответствующие 1-R-5-(2-гидрокситет- рафторфенил)-3-пиразолкарбоновые кислоты 21a, b подобно нефторированным аналогам [7] (схема 9).
Схема 9
|
OH |
O |
|
|
|
RNHNH2 |
F |
OH |
3c |
N |
|
MeOH |
N |
|
R |
R = H (a), Ph (b) |
21a, b (66−72%) |
|
В зависимости от растворителя из 2-этоксикарбонилхромона 3а и этилендиамина получают либо пиперазин-2-он 22 как результат реакции по центру С(2) и сложноэфирной группе, либо продукт нуклеофильного ароматического замещения атома фтора в положение 7 – N,N'-этилен-бис(7-амино-5,6,8-трифторфенил-2-эток- сикарбонилхромон) 23 [10] (схема 10). Объяснить образование этих соединений можно, исходя из того, что электроноакцепторный характер полифторарильного кольца (следовательно, способность к нуклеофильному замещению фтора) существенно увеличивается при переходе от протонных растворителей (спиртов) к биполярным апротонным (ДМСО) [12]. Однако пиперазин-2-он 22 является продуктом реакции хромона 3а с этилендиамином и в ацетонитриле [10]. По-видимому, ацетонитрил, в отличие от ДМСО, не препятствует образованию ионной пары этилендиамина и хромона по электрофильному атому углерода сложноэфирной группы или атому C(2).
150 |
Пленарные доклады |
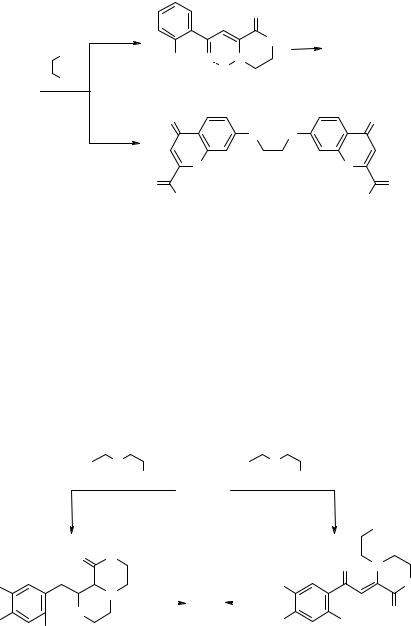
Схема 10
|
|
|
F |
|
O |
|
|
|
|
|
|
|
|
|
H+ |
|
|
|
NH |
CH2Cl2 |
|
|
NH |
|
3c (55%) |
|
|
OH |
O H N |
|
∆ |
||||
|
2 |
MeOH |
|
|
||||
|
|
|
|
|
|
|
|
|
3a |
NH2 |
Et3N |
|
22 (50−70%) |
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
O |
F |
H |
H |
|
O |
|
|
|
|
N |
N |
|
F |
|
|
|
ДМСО |
|
O |
|
|
|
O |
|
|
Et3N |
O |
|
|
|
||
|
|
|
|
|
|
|
O |
|
|
|
|
OEt |
23 (54%) |
|
|
EtO |
|
|
|
|
|
|
|
|
|
|
С диэтилентриамином 2-этоксикарбонилхромон 3а взаимодействует с участием всех трех нуклеофильных центров с образованием производного биядерного триазагетероцикла 9-гидрокси-1-(2-гидрокси-3,4,5,6-тетрафторфенил-гидроксиме- тилен)-1,3,4,6,7-пентагидро-2Н,8Н-пиразино[1,2-а]пиразина 24 [13] (схема 11). В отличие от этого, реакция хромона 3а с N-(2-гидроксиэтил)этилен диамином в аналогичных условиях завершается на стадии образования моноядерного гетероциклического соединения – 3-(2-гидрокси-3,4,5,6-тетрафтор бензоил-метилен)- 4-(гидроксиэтил)пиперазин-2-она 25 [13]. Попытки подвергнуть продукт 24 дальнейшей циклизации были безуспешными. Кислотный катализ этой реакции приводит к гидролизу соединения 24 в хромон 3с.
Схема 11
|
|
|
|
|
|
|
|
|
N |
|
|
|
|
|
|
|
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
H |
NH |
|
|
|
|
|
H |
OH |
|
|
||
|
|
|
|
|
|
|
NH |
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
NH |
|
|
|||||||||
|
|
|
|
|
|
|
|
|
2 |
2 |
|
3a |
|
|
2 |
|
|
|
|
||
|
|
|
|
|
|
|
CH2Cl2 (МеOH) |
|
CH2Cl2 (МеOH) |
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
O O |
H |
|
|
|
|
|
|
|
|
|
|
|
|
|||
F |
N |
|
|
|
|
|
|
|
|
OH |
O N |
||||||||||
F |
|
|
|
|
|
|
|
|
N |
|
H |
+ |
|
+ |
|
F |
|
|
|
NH |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
3c |
H |
|
|
|
|
|
|
|||
F |
|
|
|
|
|
HN |
|
|
|
|
|
|
|
F |
|
|
F |
O |
|||
|
|
|
|
|
|
|
|
|
(50−76%) |
|
|
|
|
|
|||||||
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|||||||||
F |
|
|
|
|
|
|
|
|
|
F |
|
|
|||||||||
|
|
|
|
|
24 (65%) |
|
|
|
|
|
|
|
|
|
|
|
|
25 (72%) |
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
Генеральный спонсор и организатор – InterBioScreen Ltd. |
|
151 |
|||||||||||||||||||
2-Этоксикарбонилхромон 3а реагирует с о-фенилендиамином с образованием производного хиноксалина 26 с выходом 70% (схема 12). Это же соединение с выходом 30% образуется в реакции 2-карбоксихромона 3с с о-фенилендиамином [7]. Бензоксазинон 27, включающий гидрокситетрафторфенильный фрагмент, образуется в реакции 2-этоксикарбонил- 3а и 2-карбоксихромонов 3с с о-аминофено-
лом [14, 15].
Схема 12
NH2 |
OH O |
|
|
|
|
XH |
F |
|
3a, c |
O |
|
|
X |
|
|
|
|
|
|
NH |
X = NH (26), O (27) |
26, 27 (25−87%) |
|
|
|
|
Взаимодействие 2-метоксикарбонилхромона 3b с о-аминотиофенолом приводит только к продукту нуклеофильного замещения атома фтора – 7-(2-амино- фенилмеркапто)-5,6,8-трифтор-2-метоксикарбонилхромону 28 [16] (схема 13).
Схема 13
NH2 |
|
O |
|
SH |
F |
|
|
3b |
|
O |
|
S |
|
O |
|
|
|
||
|
NH2 |
|
OMe |
28 (55−80%)
Обобщая данные по взаимодействию 2-алкоксикарбонил- 3а и 2-карбокси- 5,6,7,8-тетрафторхромонов 3с с бинуклеофилами, можно предположить, что механизм реакции различен на первом этапе процесса, хотя в результате могут быть получены тождественные продукты (например, с о-фенилендиамином и о-амино- фенолом).
Первоначальной стадией реакции эфира 3а с N-динуклеофилами является, по-видимому, атака одной из аминогрупп реагента по электрофильному центру С(9)
152 |
Пленарные доклады |
в соответствии с зарядовым контролем. В пользу этого предположения говорит образование N-метиламида 10 при взаимодействии эфира 3а с метиламином. Однако в избытке метиламина реализуется также атака нуклеофила по центру С(7) в соответствии с орбитальным контролем. В этой связи следует отметить, что орбитальный контроль реакции может стать доминирующим, как, например, при взаимодействии хромона 3а с первичными и вторичными аминами в диоксане, в результате которого образуется 7-замещенные продукты 11, 12, или реакция хромона с этилендиамином в ДМСО, приводящая к продукту 23. Такая регионаправленность обусловлена, вероятно, влиянием специфической сольватации растворителем исходных реагентов подобно тому, как это происходит в реакции 5-арил-2,3-дигид- рофуран-2,3-дионов с ароматическими аминами в диоксане [17].
Вторая аминогруппа N-динуклеофила (этилендиамина, о-фенилендиамина, о-аминофенола) атакует ближайший атом С(2) хромона 3а. При этом происходит расщепление пиранового цикла и образование новых гетероциклов – пиперазинонов 22, хиноксалонов 26, бензоксазинов 27. Очевидно, это обусловлено термодинамическими факторами.
В отличие от 2-алкоксикарбонилхромона 3а хромон-2-карбоновая кислота 3с реагирует с эквимольным количеством первичных аминов с образованием устойчивых солей 15. Эти соли ведут себя неоднозначно с избытком реагирующего амина: нагревание в диоксане приводит к смолообразованию реакционной массы, а в водной среде происходит обратимое взаимодействие аминогруппы первичного амина с электрофильными центрами С(4) и С(2). В последнем случае (реакция по атому С(2)) возможно либо получение продуктов присоединения по С(2)-С(3) двойной связи (продукты 18, 19), либо образование производных аминоакриловой кислоты из-за раскрытия гетерокольца хромона, как это происходит в реакции с аммиаком и циклогексиламином – соединения 14, 16. Однако при нагревании в диоксане продукты присоединения циклогексиламина претерпевают одинаковые превращения с образованием, очевидно, более устойчивых исходных солей.
Примечательно, что в условиях кинетически контролируемого процесса взаимодействие по центру С(4) возможно в соответствии с зарядовым контролем, так как после С(9) заряд на этом атоме наибольший. Однако воздействие амина по атому С(2) карбоксилат-аниона, как и 2-этоксикарбонилхромона, не является, очевидно, кинетически контролируемым. Действительно, расчеты модельных соединений показали, что атака нуклеофила по атому С(2) фторированного карбоксилат-аниона приводит к термодинамически более стабильному продукту реакции, чем воздействие на нуклеофильные центры С(4) и С(7). Это следует из сравнения величин энтальпии образования соединений (∆Н = кДж Моль–1) [7].
HO NH2 |
|
O |
|
|
|
|||
|
|
|
|
|
|
|
||
F |
O |
F |
|
NH2 |
||||
O |
|
O |
|
|
− |
|||
|
|
|
|
|||||
O− |
|
|
|
|
|
|
O |
|
|
|
|
|
O |
||||
∆ H = −1313.94 |
|
∆ H = −1388.47 |
||||||
|
|
|
|
|
|
|
||
Генеральный спонсор и организатор – InterBioScreen Ltd. |
153 |
|||||||

F |
O |
|
F |
O |
|
|||||||||
F |
|
|
|
|
|
|
|
O |
F |
|
|
|
|
NH2 |
|
|
|
|
|
|
|
|
|
|
|||||
H2N |
|
|
O |
|
|
|
|
|
|
|
||||
|
|
|
|
|
H2N |
|
O |
− |
||||||
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
− |
|
|
|
|
|
O |
F |
|
|
O |
F |
|
|
O |
|
||||||
∆ H = −1128 |
|
∆ H = −1217 |
|
|||||||||||
Для взаимодействия 2-карбоксихромона 3c с гидразинами, о-фенилендиами- ном и о-аминофенолом на наш взгляд, также характерно образование соответствующего карбоксилат-аниона и последующая атака нуклеофила (избыток амина в случае гидразинов и вторая аминогруппа в случае о-фениендиамина, о-амино- фенола) по атому С(2). Дальнейший ход реакции определяется термодинамической устойчивостью конечных продуктов, как это происходит в ряду нефторированных ароилпировиноградных кислот.
Литература
1.Салоутин В.И., Скрябина 3.Э., Базыль И.Т., Чупахин О.Н., Изв. АН, Сер. хим.
1993 362.
2.Saloutin V.I., Skryabina Z.E., Bazyl' I.T., Chupakhin O.N., J. Fluorine Chem. 1993 65 37.
3.Салоутин В.И., Скрябина 3.Э., Базыль И.Т. и др., ЖОрХ 1994 30 1225.
4.Салоутин В.И., Базыль И.Т., Скрябина З.Э. и др., Изв. АН, Сер. хим. 1994 299.
5.Saloutin V.I., Skryabina Z.E., Bazyl' I.T., et al., J. Fluorine Chem. 1994 69 126.
6.Салоутин В.И., Базыль И.Т., Скрябина 3.Э. и др., Изв. АН, Сер. хим.
1992 2186.
7.Салоутин В.И., Базыль И.Т., Скрябина 3.Э. и др., ЖОрХ 1995 31 718.
8.Близнюк А.А., Войтюк А.А., Журн. структ. хим. 1986 27 190.
9.Demar M.J.S., Zoebisch E.G., Healy E.F., Stewart J.P., J. Am. Chem. Soc. 1985 107 3902.
10.Салоутин В.И., Базыль И.Т., Скрябина З.Э., Чупахин О.Н., Изв. АН, Сер. хим.
1994 904.
11.Общая органическая химия, под ред. Бартона Д., Оллиса В.Д., М.: Химия, 1984, т. 9, с. 93.
12.Реакционная способность полифторароматических соединений, под ред. Якобсона Г.Г., Новосибирск: Наука, 1983, с. 220.
13.Салоутин В.И., Базыль И.Т., Скрябина З.Э. и др., ЖОрХ 1995 31 1432.
14.Кондратьев П.Н., Скрябина З.Э., Салоутин В.И. и др., Изв. АН, Сер. хим.
1990 640.
15.Салоутин В.И., Перевалов С.Г., Скрябина З.Э., ЖОрХ 1996 32 1386.
16.Перевалов С.Г., Салоутин В.И., в сб. Молодежная научная школа по органи-
ческой химии, Екатеринбург: УрО РАН, 1998, с. 20.
17.Козлов А.П., Сычев Д.И., Андрейчиков Ю.С., ЖОрХ 1986 22 1756.
154 |
Пленарные доклады |

УСТНЫЕ ДОКЛАДЫ
