
Карцев В.Г.Избранные методы с-за и модифик. гетероциклов т.1 , 2003
.pdf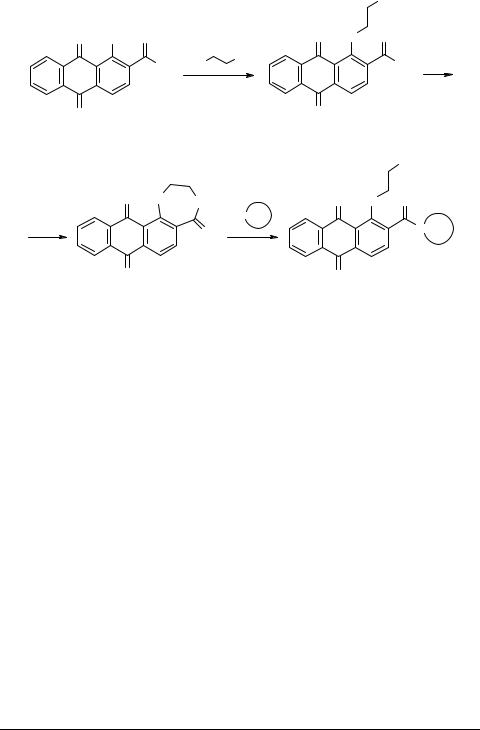
|
|
|
|
|
|
|
OH |
O |
NO2 |
O |
|
OH |
O |
HN |
O |
|
|
OH H2N |
|
|
OH ∆ |
||
|
|
|
|
|
|||
O |
|
|
|
|
O |
|
|
7 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
O |
HN |
O |
HN |
|
O HN |
O |
|
|
|
|
|
|
N |
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
O |
|
|
|
|
|
|
|
8 |
|
Доклад сделан |
по материалам |
обзора, полный |
текст |
которого опубликован: |
|||
в кн. "Избранные методы синтеза и модификации гетероциклов", под ред.
Карцева В.Г., М.: IBS PRESS, 2003, т. 2, с. 103.
Литература
1.Krapcho A.P., Maresch M.J., Hacker M.P., et al., Curr. Med. Chem. 1995 2 803.
2.Горностаев Л.М., Подвязный О.В., Химия и хим. технол. 2002 45 (6) 152.
3.Лаврикова Т.И., Подвязный О.В., Горностаев Л.М., ЖОрХ 2001 37 (9) 1321.
Генеральный спонсор и организатор – InterBioScreen Ltd. |
227 |
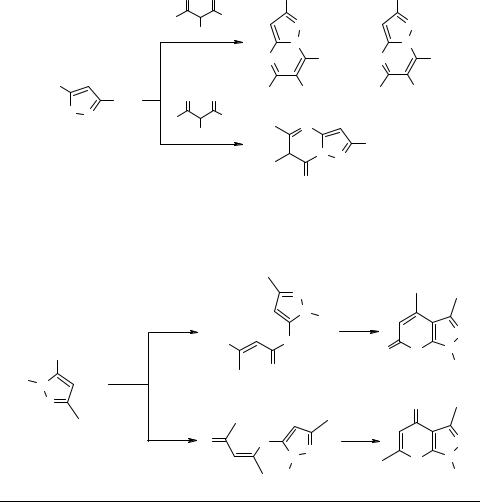
Конденсированные системы на базе амино- и оксипиразолов и β-дикарбонильных соединений
Грандберг И.И., Нам Н.Л.
Московская сельскохозяйственная академия им. К.А. Тимирязева 127550, Москва, ул. Тимирязева, 49
В докладе рассмотрены конденсированные системы, образующиеся из 3- или 5-ами- нопиразолов и 1,3-дикетонов или эфиров β-кетокислот.
Реакция идет по разному для N-замещенных 5-аминопиразолов и 5-амино- пиразолов со свободной NH-группой ядра.
|
|
O |
O |
|
|
R |
|
|
R |
|
|
R'' |
R' |
R''' |
|
N |
|
|
N |
|
|
|
|
|
+ |
|
|||
|
|
|
|
|
N |
|
N |
||
|
|
160°C |
|
|
|
||||
|
|
|
N |
|
R''' |
N |
R'' |
||
H2N |
R |
O |
O |
|
R'' |
R' |
|
R''' |
R' |
|
|
|
|||||||
HN N |
|
|
|
|
|
|
|
|
|
|
R'' |
R' |
OR''' |
R'' |
N |
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
R |
|
|
|
|
140°C |
|
|
|
N N |
|
||
|
|
|
R' |
|
|
|
|||
|
|
|
|
|
|
O |
|
|
|
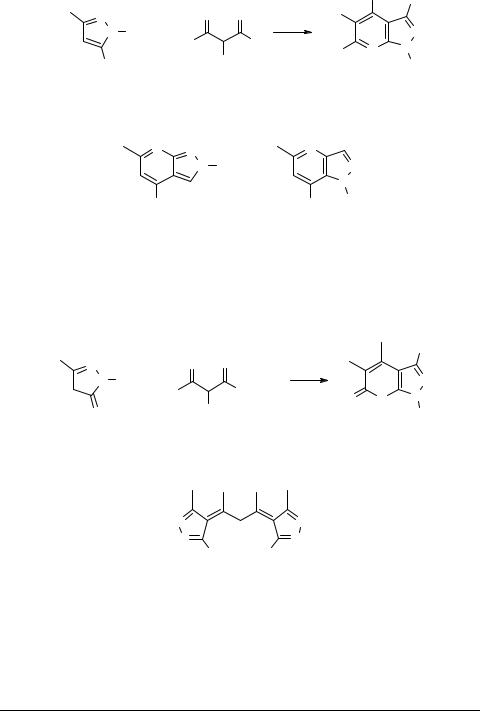
В случае 1-замещенных 5-аминопиразолов в зависимости от условий реакции, могут получиться 6- или 4-оксипиразоло[4,5-b]пиридины.
|
|
|
|
N |
|
|
|
|
ксилол |
|
N Ph |
AcOH |
N |
|
|
120°C |
HO |
NH |
120°C O N |
|
|
NH2 |
N |
||||
|
|
|
|
|
||
Ph |
АУЭ |
|
O |
H |
Ph |
|
N |
|
|
||||
|
|
|
|
|
||
|
N |
|
|
|
O |
|
|
|
H+ |
O |
H |
|
N |
|
|
|
N |
220°C |
||
|
|
20°C |
|
N N |
N |
|
|
|
|
N |
|||
|
|
|
|
Ph |
H |
Ph |
228 |
Устные доклады |
R' N |
|
|
|
|
R" |
R' |
|
O O |
|
R"' |
|
||
+ |
|
|
N |
|||
N R |
R" |
R" |
|
|
||
|
R" |
N N |
||||
|
|
R"' |
|
|||
NH2 |
|
|
|
|
R |
|
При взаимодействии 1-замещенных-3-аминопиразола или 1-фенил-4-амино- пиразола с ацетоуксусным эфиром были получены следующие соединения.
N N |
N |
N Ph |
N |
|
N |
OH |
OH Ph |
По похожей схеме реагируют и 5-оксипиразолы (пиразолоны-5). Но 3-окси- пиразолы и 4-замещенные 5-оксипиразолы в конденсацию с β-кетоэфирами не вступают. Так же не наблюдалось участия в конденсации NH-группы незамещенных 5-оксипиразолов.
Все пиразолоны-5 вступали в реакцию по нижеприведенной схеме с высокими выходами.
R' N |
|
O O |
|
|
|
R' |
|
|
|
|
|
||
N R + |
R'' |
|
OAlk 170°C |
|
|
N |
|
|
O |
O |
N |
||
|
|
R''' |
|
|||
O |
|
|
|
|
R |
β-Дикетоны реагируют по другой схеме. Так, ацетилацетон и 3-метилпиразо- лон-5 образует следующее соединение.
N |
N |
N |
N |
OH |
HO |
Доклад сделан по материалам обзора, |
полный текст которого опубликован: |
в кн. "Избранные методы синтеза и модификации гетероциклов", под ред.
Карцева В.Г., М.: IBS PRESS, 2003, т. 2, с. 113.
Генеральный спонсор и организатор – InterBioScreen Ltd. |
229 |
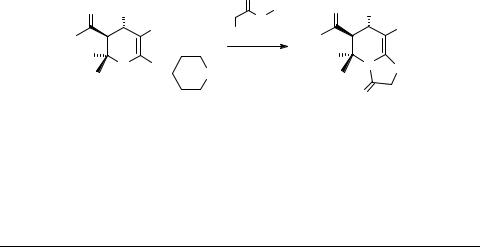
Cинтез конденсированных серусодержащих гетероциклов на основе частично гидрированных пиридинов и хинолинов
Доценко В.В.1, Кривоколыско С.Г.1, Литвинов В.П.2
1Восточноукраинский национальный университет 91034, Украина, Луганск, кв. Молодежный, 20а, корпус 7 2Институт органической химии им. Н.Д. Зелинского РАН 117913, Москва, Ленинский просп., 47
Конденсированные серусодержащие пиридины и, в частности, тиено- и тиазолопиридины, проявляют достаточно широкий спектр полезной биологической активности [1], что стимулирует проведение исследований, посвященных синтезу и превращениям таких соединений. Целью нашей работы явилось решение проблемы расширения спектра реакций, ведущих к конденсированным серусодержащим пиридинам. В качестве исходных реагентов нами были выбраны синтезированные ранее ди- и тетрагидропиридинтиолаты.
6-Гидроксипиридин-2-тиолаты пиперидиния 1 вступают в обычные для солей такого типа реакции с рядом галогеналканов с образованием соответствующих 2-алкилтиозамещенных пиридинов.
Мы показали, что обработка гидроксипиридинов 1 метилхлорацетатом при кратковременном кипячении в этаноле ведет к образованию ранее неизвестных устойчивых гексагидротиазоло[3,2-a]пиридинов 2 (выходы 74 и 68%) [2, 3] (схема 1).
Схема 1
O |
R |
|
|
O |
R |
|
|
O |
|||
|
|
CN |
Cl |
O |
CN |
R' |
|
R' |
|||
|
|
|
|||
HO |
N |
S− |
+ |
HO |
N S |
|
H |
|
NH2 |
|
|
|
|
|
|
|
O |
|
1 |
|
|
|
2 |
R= 2-ClC6H4, Ph; R' = Ph, 2-MeC6H4NH
Вслучае взаимодействия солей 1 с α-бромкетонами в этаноле или ДМФА наблюдается образование Е-изомеров тиазолилцианоэтиленов 3 с выходами 82–93% (схема 2).
230 |
Устные доклады |
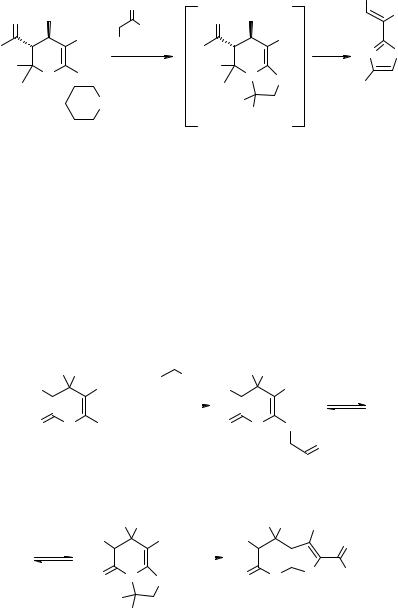
Схема 2
|
|
|
|
O |
|
|
|
|
R |
O |
R |
|
|
O |
|
R |
|
CN |
|
|
|
Ar |
|
|
|||||
|
|
CN |
Br |
|
|
|
CN |
|
|
R' |
|
|
R' |
|
|
N S |
|||
|
|
|
|
|
|
||||
HO |
|
|
|
|
HO |
|
|
|
|
N |
S− |
|
|
|
N |
S |
Ar |
||
|
H |
|
+ |
|
|
HO |
|
|
|
|
|
|
NH2 |
|
|
Ar |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
4 |
|
3 |
R = 2-IC6H4, 2-ClC6H4, Ph, C4H3S, C4H3O;
R' = PhNH, 2-MeC6H4NH, 2-MeOC6H4NH, 4-FC6H4NH;
Ar = Ph, 4-MeOC6H4, 4-MeC6H4, 4-ClC6H4, 4-BrC6H4
Последние, вероятно, являются продуктами каскадного распада гипотетических интермедиатов типа 4 [4–6]. Последнее предположение подтверждает тот факт, что 2-оксопиридин-6-тиолаты 5 в условиях этой реакции реагируют с образованием равновесной смеси линейного продукта алкилирования 6 (схема 3) и тиазолопиридона 7 в соотношении 1 : 1 (выходы 68–84%).
Схема 3
R' |
R" |
|
|
|
O |
|
|
|
R' |
R" |
|
|
|
||||||
|
|
|
|
|
Ar |
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
||||||||||||
R |
|
CN |
|
|
|
|
|
R |
|
CN |
|
||||||||
|
|
Br |
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
N |
S− BH+ |
|
|
|
|
|
N |
S |
|
|
|
||||||
O |
|
|
|
O |
|
|
|
||||||||||||
|
|
H |
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5 |
|
|
|
|
|
|
|
|
|
|
6 |
|
|
|
Ar |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
R' |
R" |
|
|
|
|
|
R' |
R" |
|
NH2 |
|
|||||
|
|
|
R |
|
CN |
|
KOH R |
|
|
|
|
|
|
O |
|||||
|
|
|
|
N S |
|
|
|
|
|
S |
Ar |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
O |
|
|
|
O |
|
N |
||||||||||
|
|
|
HO |
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ar |
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
7 |
|
|
|
|
|
|
|
|
|
8 |
|
|
|
||
R = H, CO2Et, CO2Me, CN; R' = H; R" = Ar; R'+R" = (CH2)n, n = 5, 6 |
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
Генеральный спонсор и организатор – InterBioScreen Ltd. |
|
|
231 |
||||||||||||||||
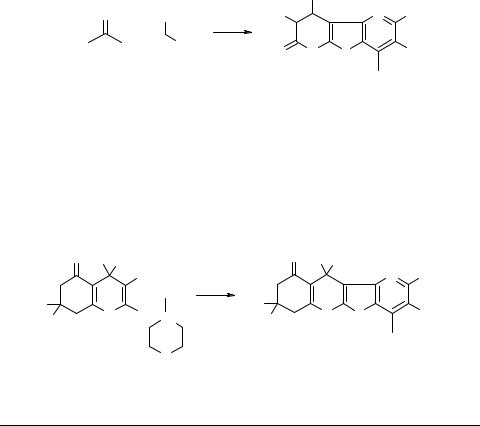
Данные рентгеноструктурного анализа свидетельствуют о полном смещении данного равновесия в кристаллическом состоянии в сторону соединений 7 [7], что отмечалось ранее для других их изоструктурных аналогов [8]. При добавлении к смеси соединений 6 и 7 в этаноле водного раствора КОН протекает конкурирующая циклизация по Торпу–Циглеру с участием активированной метиленовой группы 6-алкилтиозаместителя и цианогруппы пиридина 6, приводящая к изомерным частично гидрированным тиено[2,3-b]пиридинам 8 [7, 9].
"Однореакторное" взаимодействие тиолатов 5 (R = R' = H, R'' = Ar) с избытком ацетона 9 и малононитрилом 10 в кипящем этаноле приводит к образованию замещенных дипиридотиофенов 11 с умеренными (30–50%) выходами [10] (схема 4). В ряде случаев (R'' = 2-Cl-6-FC6H3, фурил) выходы целевых продуктов могут достигать 70–75%. Мы обнаружили, что в эту реакцию вступают и другие функционально замещенные пиридоны 5 (R = CO2Et, CO2Me), однако в таком случае выходы целевых продуктов не превышают 30%. Необходимо отметить, что данный метод не имеет прямых литературных аналогий, препаративно несложен и является пока наиболее оптимальным подходом к синтезу структур типа 11 [11].
Схема 4
|
|
|
|
Ar |
|
|
O |
CN |
EtOH |
R |
|
N |
NH2 |
5 + |
+ |
∆ |
|
|
|
|
|
CN |
O |
N |
S |
CN |
|
9 |
10 |
|
|
H |
11 |
|
|
|
|
|
R = H, CO2Me, CO2Et
Хинолины 12 в сходных условиях реакции с соединениями 9 и 10 (схема 5) образуют с низкими (7–19%) выходами производные новой гетероциклической системы – пиридо[2',3':4,5]тиено[2,3-b]хинолина 13. Примечательно, что фрагмент 1,4-дигидропиридинового кольца в этих реакциях сохраняется неизменным.
Схема 5
O |
R' |
R" |
|
|
O |
R' |
R'' |
NH2 |
|
|
|
CN |
|
9, 10 |
|
|
N |
||
R |
N |
S− |
+ |
EtOH |
R |
N |
S |
CN |
|
R |
R |
||||||||
H |
|
NH |
H |
|
|
||||
|
12 |
|
O |
|
|
13 |
|
||
R = H, Me; R' = Ar или Alk; R" = H; R'+R" = (CH2)n, n = 5, 6
232 |
Устные доклады |
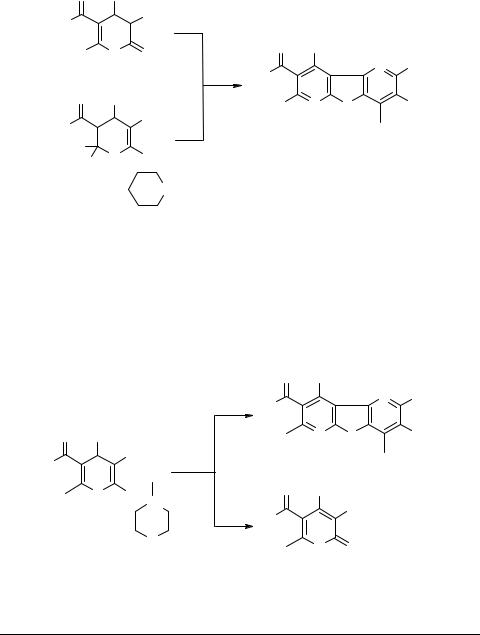
Тионы 14 и их синтоновые эквиваленты – тиолаты 15 в аналогичных условиях реагируют с ароматизацией исходного пиридинового ядра, образуя дипиридотиофены 16, выход которых при этом не превышает 20–35% (схема 6).
Схема 6
O |
Ar |
|
|
|
|
EtO |
|
CN |
|
|
|
|
|
|
|
|
|
Ph |
N |
S |
O |
Ar |
|
|
H |
9, 10 |
EtO |
N |
NH2 |
|
14 |
|
|
||
O |
Ar |
|
Ph |
N S |
CN |
|
|
CN |
|||
EtO |
|
|
16 |
|
|
|
|
|
|
||
HO |
|
S− |
|
|
|
N |
|
|
|
||
Ph |
H |
+ |
|
|
|
|
|
|
|
|
|
|
15 |
NH2 |
|
|
|
|
|
|
|
|
Неоднозначно протекает взаимодействие солей 17 с соединениями 9 и 10 (схема 7). Кроме конденсированных продуктов 18 неожиданно были получены пиридин-2-тионы 19, образование которых является следствием дегидрирования исходных реагентов. Причины подобного изменения направления реакции являются предметом дальнейшего изучения.
|
|
|
|
|
|
Схема 7 |
|
|
|
O |
Ar |
|
|
|
|
|
R |
|
N |
NH2 |
|
|
|
|
|
|
|
O Ar |
|
|
|
N |
S |
CN |
R |
CN |
9, 10 |
|
|
18 |
|
|
|
|
|
|
||
N |
− |
+ |
O |
Ar |
|
|
S |
|
|
||||
H |
|
NH |
R |
|
CN |
|
|
|
|
|
|
||
17 |
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
N |
S |
|
|
|
|
|
|
|
||
|
|
|
|
H |
|
|
R = Me, NH2, NHAr, NHAlk |
|
19 |
|
|
||
|
|
|
|
|||
Генеральный спонсор и организатор – InterBioScreen Ltd. |
|
233 |
||||
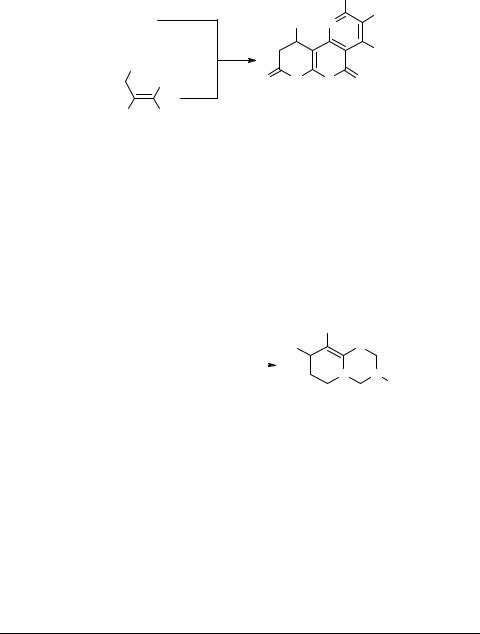
Взаимодействие тиолатов 5 (R = R' = H, R'' = Ar) с избытком малононитрила 10 в отсутствие ацетона или с димером малононитрила приводит к образованию, в основном, дипиридотиопиранов 20 (выход 44–69%) (схема 8).
Схема 8
|
|
|
|
|
NH2 |
5 |
+ 10 |
|
R |
N |
CN |
|
|
||||
|
|
EtOH |
|
|
NH2 |
|
CN |
|
|
|
|
|
O |
N |
S NH |
||
|
CN |
||||
5 |
+ |
|
H |
20 |
|
|
|
|
|||
H2N CN
R = фурил, Ph, 3,4-MeOC6H3, 4-MeOC6H4, 2-ClC6H4
Различные производные 1,3,5-тиадиазина зарекомендовали себя в качестве эффективных инсектицидов и акарицидов [12]. Тем не менее, это все еще немногочисленный класс соединений, их конденсированные производные в литературе представлены единичными примерами [13, 14]. Нами показано, что взаимодействие тетрагидропиридинтиолатов 5 (R = R' = H, R'' = Ar), первичных аминов и избытка формальдегида в виде 37% водного раствора приводит к ранее неизвестным пиридо[2,1-b][1,3,5]тиадиазинам 21 (схема 9).
Схема 9
|
|
|
|
CN |
|
||
5 + |
HCHO + |
|
EtOH |
Ar |
S |
||
RNH2 |
|
|
|
|
|||
|
|
|
N |
N R |
|||
|
|
|
|||||
|
|
|
|
|
|
||
|
|
|
|
O 21 |
|
||
Ar = Ph, 1-нафтил, 4-EtOC6H4, 4-MeOC6H4, 2-Cl-6-FC6H3; |
|||||||
R = Me, фурфурил, циклогексил, Bn, Ph, 4-FC6H4 |
|
||||||
Реакция чрезвычайно удобна в препаративном отношении, выходы продуктов приближаются к количественным и их последующая очистка, как правило, не требуется. Доступность и широкая вариабельность исходных реагентов создают предпосылки для использования данного подхода в комбинаторном синтезе.
На основе хинолинтиона 22 нами синтезирован ряд тиено[2,3-b]пиридинов 23
свыходами 65–85% (схема 10). Нитрил 24 под действием сильного основания одностадийно превращен в поликонденсированный тиофен 25. Механизм этой реакции включает анионотропную перегруппировку, близкую к перегруппировке Смайлса,
споследующим замыканием пиридинового кольца [15, 16].
234 |
Устные доклады |
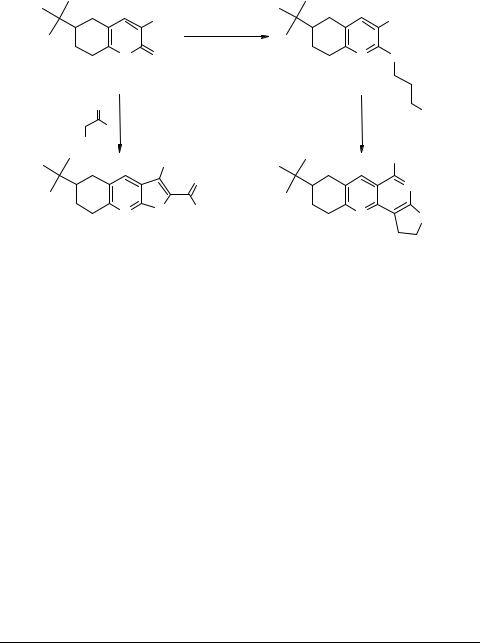
Структура синтезированных соединений подтверждена данными 1Н ЯМР спектроскопии, ИК и масс-спектрометрии, элементного анализа и РСА.
Схема 10
|
CN |
Br(CH2)3CN |
|
CN |
|
|
|
|
|
N |
S |
ДМФА, KOH |
N |
S |
|
||||
H |
|
|
|
|
22 |
|
|
24 |
|
O |
|
|
|
t-BuOK, CN |
ДМФА, |
|
|
||
R KOH |
|
|
|
диоксан |
Cl |
|
|
|
NH2 |
|
NH |
2 |
|
|
|
|
O |
|
N |
|
|
|
|
|
N |
S |
R |
N |
S |
23 |
|
|
25 |
|
R = NH2, PhNH, Ph2N, t-BuNH, Et2N, Ph, EtO, MeO
Литература
1.Литвинов В.П., Промоненков В.К., Шаранин Ю.А., Шестопалов А.М.,
в сб. Итоги науки и техники. Органическая химия, Москва: ВИНИТИ, 1989,
т. 17, с. 148.
2.Кривоколыско С.Г., Чернега А.Н., Русанов Э.Б., Литвинов В.П., Докл. АН
2001 377 638.
3.Кривоколыско С.Г., Литвинов В.П., Тез. конф. "Новые достижения в химии карбонильных и гетероциклических соединений", Саратов, 2000, с. 134.
4.Кривоколыско С.Г., Дяченко В.Д., Нестеров В.Н., Литвинов В.П., ХГС 2001
(7) 929.
5.Кривоколыско С.Г., Дяченко В.Д., Литвинов В.П., ХГС 1999 (10) 1370.
6.Кривоколыско С.Г., Дяченко В.Д., Литвинов В.П., ХГС 1998 (10) 1425.
7.Кривоколыско С.Г., Русанов Э.Б., Литвинов В.П., ХГС 2002 (11) 1591.
8.Shestopalov A.M., Bogomolova O.P., Rodinovskaja L.A., et al., Heteroatom Chem. 1993 4 (6) 593.
9.Кривоколыско С.Г., Многокомпонентные конденсации в синтезе серусодержащих гидрированных пиридинов, Дисс. д-ра хим. наук, Москва: МГУ, 2001.
Генеральный спонсор и организатор – InterBioScreen Ltd. |
235 |

10.Доценко В.В., Кривоколыско С.Г., Литвинов В.П., Чернега А.Н., Изв. АН,
Сер. хим. 2002 (2) 339.
11.Артемов В.А., Иванов В.Л., Родиновская Л.А. и др., ХГС 1996 (4) 553.
12.Накая Митихико, Фудзи Юкихару, Кодака Кэидзи и др., Заявка Японии
2 131 475; Кокай токкё кохо, Сер. 3 (2) 1990 (47) 891; РЖХим. 1991
16О384П.
13.Shi H., Wang Zh., Shi H., Chimia 1997 51 (7) 529; РЖХим 1998 13Ж272.
14.Hozein Z.A., J. Chem. Res. Synop. 2000 (3) 99.
15.Kenji S., Abu Shara S. Rouf, Setsuo K., et al., Heterocycles 1995 41 (6) 1307.
16.Takashi H., Tetsuo M., Kenji S., et al., Heterocycles 1995 41 (11) 2565.
236 |
Устные доклады |
