
Карцев В.Г.Избранные методы с-за и модифик. гетероциклов т.1 , 2003
.pdf
Схема 4
|
O |
O |
|
O |
|
|
O2 |
|
|
|
|
O |
O |
|
N |
|
N |
|
N |
O |
|
H |
|
N |
|
|
|
||
|
|
n |
|
|
|
|
|
O |
|
|
|
|
|
|
2b |
|
|
|
O |
|
|
|
3 |
Бензоилкетен 2с, генерируемый десульфодиоксидированием соединения 1с, стабилизируется путем электроциклического замыкания цикла в 2-фенил-4Н-3,1- бензооксазин-4-он 4 (схема 5).
Схема 5
O |
O |
|
|
O |
O |
N Ph |
N Ph |
2c |
4 |
Попытки десульфодиоксидирования соединения 1d привели лишь к образованию N-(п-тозил)антраниловой кислоты, по-видимому, вследствие гидролиза исходного 1d или образующегося из него кетенимина 2d.
При взаимодействии соединения 1а с основаниями Шиффа растворением реагентов в бензоле и выдерживании раствора при комнатной температуре в течение суток, с хорошим выходом образуются продукты [4+2]циклоприсоединения 2а по связи C=N оснований Шиффа – 2,3-диарил-1,2,3,4-тетрагидрохиназолин-4-оны 5 (схема 6).
|
|
|
Схема 6 |
O |
|
O |
O |
|
|
N Ar |
|
O |
|
ArN=CHAr |
|
N S |
O |
NH |
N Ar |
H |
|
|
H |
1a |
|
2a |
5 |
Генеральный спонсор и организатор – InterBioScreen Ltd. |
187 |
||
Однако при попытке проведения аналогичной реакции тозильного производного 1d с основанием Шиффа (Ar = Ph) в аналогичных условиях, вместо ожидаемого продукта [4+2]циклоприсоединения 5 был выделен лишь продукт его гидролиза – анилид N-тозилантраниловой кислоты (схема 7).
Схема 7
O |
|
|
|
O |
|
|
|
|
|
|
|
|
O |
|
|
|
|
N |
S |
O |
−SO2 |
NTs |
|
|
|
|
|||
Ts |
|
|
|
|
|
1d |
|
|
|
|
|
|
|
|
O |
|
O |
PhN=CHPh |
|
|
N Ph |
H2O |
N Ph |
|
|
|
N Ph |
−PhCHO |
H |
|
|
|
NHTs |
||
|
|
|
|
||
|
|
|
Ts |
|
|
Исследования возможности "перехвата'' имидоилкетенов другими диенофилами (альдегидами, азинами, изоцианатами, карбодиимидами), а также моно- и бифункциональными реагентами продолжаются.
Литература
1.Hurley L.H., Reck T., Thurston D.E., et al., Chem. Res. Toxicol. 1988 1 258.
2.Hermecz I., Vasvari-Debreczy L., Horvath A., et al., J. Med. Chem. 1987 30 1543.
3.Suzuki M., Taketsury H., Nakatani T., et al., Патент Японии 61 143 384;
Chem. Abstr. 1984 6 60941.
4.Rastogi S.N., Kansal V.K., Bhaduri A.P., Indian J. Chem., Sect. B 1983 22 234.
5.Kametani T., Higa T., Chu Van Loc., et al., J. Am. Chem. Soc. 1976 98 6186.
6.Zogvafos A.L., Mitsos C.A., Igglessi-Markopoulou O., J. Org. Chem. 2001 66 4413.
7.Сapuano L., Moersdorf P., Scheidt H., Chem. Ber. 1983 116 741.
8.Вейганд-Хильгетаг, Методы эксперимента в органической химии, М.: Химия, 1969, с. 350.
9.Smalley R.K., Suschitzky H., Tetrahedron Lett. 1966 3465.
188 |
Устные доклады |
Фуран в синтезе производных изохромона
Бутин А.В., Дмитриев А.С., Гутнов А.В., Абаев В.Т.
Кубанский государственный технологический университет 350072, Краснодар, ул. Московская, 2
Изохромоновый фрагмент является составной частью природных соединений и синтетических веществ, обладающих различными видами биологической активности [1–3]. Основным путем синтеза изохромонов до сих пор является внутримолекулярная циклизация 2-(2-оксоэтил)бензойных кислот (схема 1). При этом карбонильная группа может быть генерирована различными путями [4–8].
Схема 1
|
O |
|
O |
X |
OH |
X |
O |
|
|
 R
R
R O
O
Нами разработан общий подход к синтезу бензаннелированных гетероциклов на основе реакции рециклизации фуранового цикла в 2-замещенных бензилфуранах в кислых условиях. Эта реакция детальным образом была исследована на примере 2-гидроксибензилфуранов и 2-тозиламинобензилфуранов, рециклизация которых приводила, соответственно, к бензофуранам и индолам. В этих реакциях фурановый цикл выступал как источник карбонильной группы, участвующей в замыкании нового гетероцикла [9–10] (схема 2).
Cхема 2
X |
YH |
Y |
O |
R" |
X |
||
|
|
|
|
|
|
R" |
R' |
O
R'
Этот же метод был применен для синтеза производных изохинолона [11]. Развивая указанную методологию, мы предлагаем новый подход к синтезу
производных изохромона, о чем предварительно сообщалось [12]. Исходные 2-карбоксиарилбис(5-алкил-2-фурил)метаны 1а–f были получены путем конден-
Генеральный спонсор и организатор – InterBioScreen Ltd. |
189 |
сации 2-формилбензойных кислот и 2-алкилфуранов в диоксане в присутствии каталитических количеств хлорной кислоты с выходом 60–70% (схема 3).
Схема 3
R |
O |
|
|
|
R O |
|
R' |
OH |
+ |
O |
R" H+ R' |
OH |
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
O |
R" |
|
|
|
|
|
O |
|
|
|
|
|
|
R" |
|
|
|
|
|
|
1a−f |
|
a R = R' = H, R" = Me; b R = R' = H, R" = Et; c R = R' = H, R" = t-Bu;
d R = H, R' = NO2, R" = Me; e R = H, R' = NO2, R" = Et; f R = R' = OMe, R" = Me
Проведение этой реакции в более мягких условиях, а именно при кипячении реагентов в бензоле в присутствии каталитических количеств TsOH приводит к смеси необходимого продукта и 2-фурилфталида 2. На некоторых примерах фталиды были выделены и охарактеризованы.
R O
R'
O
O
R"
2c, d
2c R = R' = H, R" = t-Bu; 2d R = H, R' = NO2, R" = Me
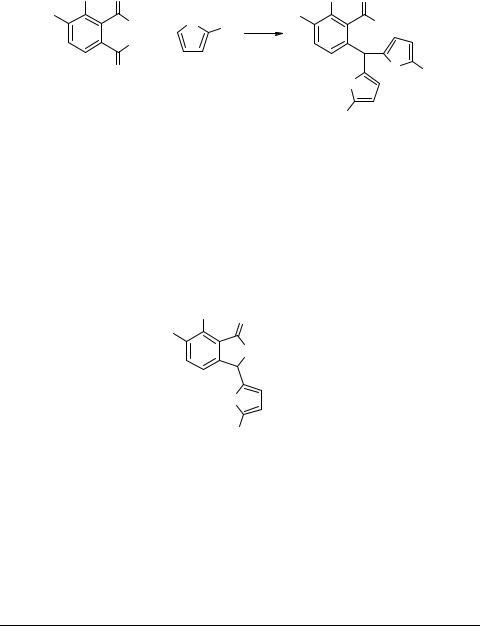
Восстановлением соединений 1d, e либо железом в присутствии уксусной кислоты, либо гидразином в присутствии скелетного никеля были получены соответствующие амины 1g, h с выходом до 80% (схема 4). Следует отметить, что восстановление гидразином в присутствии скелетного никеля облегчает выделение конечных продуктов.
190 |
Устные доклады |
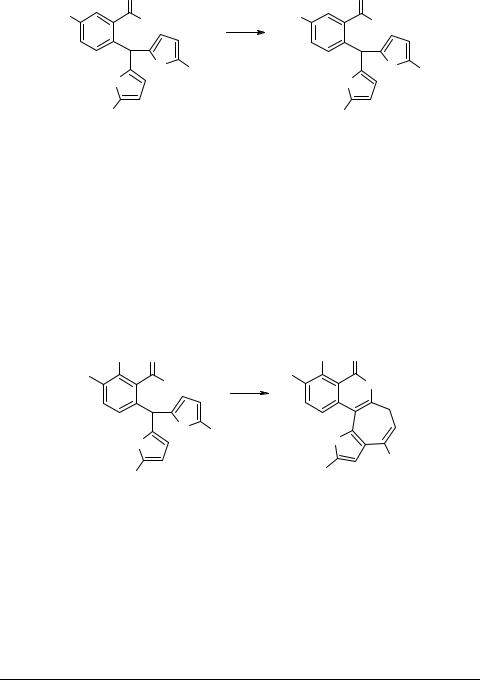
Схема 4
|
O |
|
|
O |
|
O2N |
OH |
[H] H2N |
|
OH |
|
|
O |
R" |
|
O |
R" |
|
O |
O |
|
||
|
|
|
|
||
|
R" |
|
R" |
|
|
|
1d, e |
|
|
1g, h |
|
|
|
R" = Me (g), Et (h) |
|
|
|
Нагреванием производных бензойной кислоты 1а, b, d–h в безводном метаноле, насыщенном хлористым водородом получены соответствующие тетрациклические производные изохромона 3а, b, d–h с выходом 60–70% (схема 5). Этого же результата можно достичь нагреванием исходных соединений в безводном растворе TsOH в бензоле.
Схема 5
|
R O |
|
R |
O |
R' |
OH |
+ |
R' |
O |
|
H |
|
||
|
O |
R" |
|
O |
|
O |
|
||
|
|
|
||
|
R" |
|
R" |
R" |
|
|
|
||
|
|
|
|
|
|
1a−e, g, h |
|
|
3a−e, g, h |
Превращение соединений 1а, b, d–h в тетрациклические производные изохромона 3а, b, d–h проходит через рециклизацию фурана и последующую внутримолекулярную циклизацию по второму фурановому циклу. Ни в одном из случаев не удалось выделить промежуточный кетон 4. Исключение составляет реакция рециклизации соединения 1c, единственным продуктом которой является кетон 4 (схема 6). Вероятно, в данном случае стерические препятствия, возникающие за счет наличия трет-бутильного заместителя у карбонильной группы, исключают возможность протекания внутримолекулярной циклизации.
Генеральный спонсор и организатор – InterBioScreen Ltd. |
191 |

Схема 6
O |
|
O |
OH |
H+ |
O |
O |
|
|
O |
|
O |
|
|
O |
1f |
|
4 |
В заключении отметим, что нами разработан простой метод синтеза производных изохромона, основанный на доступном сырье. Синтезированные соединения интересны как с точки зрения изучения дальнейших их превращений, так и в плане исследования их биологической активности.
Литература
1.Barry R.D., Chem. Rev. 1964 64 229.
2.Houser F.M., Baghdanov V.M., J. Org. Chem. 1988 53 4676.
3.Mali R.S., Babu K.N., J. Org. Chem. 1998 63 2488.
4.Ohta S., Kamata Y., Inagaki T., et al., Chem. Pharm. Bull. 1993 41 1188.
5.Larock R.C., Doty M.J., Han X., J. Org. Chem. 1999 64 8770.
6.Murakami N., Shimoda H., Chem. Pharm. Bull. 1996 44 1890.
7.Sakamato T., Kondo Y., Yasuhara A., Yamanaka H., Tetrahedron 1991 47 1877.
8.Wang L., Shen W., Tetrahedron Lett. 1998 39 7625.
9.Butin A.V., Gutnov A.V., Abaev V.T., Krapivin G.D., Molecules 1999 4 52.
10.Butin A.V., Stroganova T.A., Lodina I.V., Krapivin G.D., Tetrahedron Lett. 2001 42 2031.
11.Абаев В.Т., Осипова А.А., Бутин А.В., ХГС 2001 (6) 849.
12.Gutnov A.V., Abaev V.T., Butin A.V., Dmitriev A.S., J. Org. Chem. 2001 66 8685.
192 |
Устные доклады |
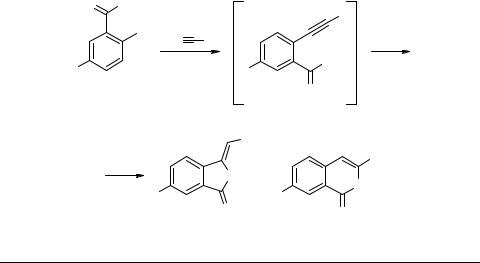
Сравнительное изучение гетероциклизации o-ацетилениларил- и виц-ацетиленилпиразолил- карбоновых и -гидроксамовых кислот
Василевский С.Ф.1, Мшвидобадзе Е.В.1, Найт Д.В.2
1Институт химической кинетики и горения Сибирского Отделения РАН 630090, Новосибирск, ул. Институтская, 3
2Уэльский университет, Департамент Химии, Кардифф CF1 3TB, Англия
Синтез и изучение реакционной способности вицинально замещенных функциональных ацетилениларенов и -гетаренов, в особенности, изучение реакций гетероциклизации – актуальная и быстро развивающаяся область органической химии, позволяющая, в частности, осуществлять синтезы ранее труднодоступных конденсированных полиядерных гетероциклов [1, 2]. С другой стороны, такие гетероциклы очень перспективны в поиске новых биологически активных соединений [3].
Для получения конденсированных гетероциклов могут быть использованы ацетилениларены и -гетарены с вицинальным расположением кратной связи и функциональной группы. Лучшим способом их получения является кросс-соче- тание по Соногашира соответствующих арил(гетарил)галогенидов с терминальными ацетиленами [4, 5]. Кастро с сотрудниками показали, что конденсация о-галоген- бензойных кислот 1a, b с замещенными ацетиленидами в ДМФА или пиридине приводит (cхема 1) к 5-, а не 6-членным лактонам и только в случае n-пропилаце- тиленида дает смесь 3-n-бутилиденфталида и 3-n-пропилизокумарина 4d (соотно-
шение 2 : 1) табл. 1 [6, 7].
Схема 1
|
O OH |
|
|
R' |
|
|
|
|
|
|
|
|
I |
CuC R' |
|
|
|
|
|
|
|
|
|
R |
|
∆, ДМФА |
R |
OH |
|
|
|
|
|
||
|
|
|
|
O |
|
|
1a, b |
|
|
2a−d |
|
|
|
|
R' |
|
|
|
|
|
|
+ |
R' |
|
|
O |
|
O |
|
|
|
R |
|
R |
|
|
|
|
|
||
|
|
O |
|
O |
|
|
|
3a−d |
|
4d |
|
Генеральный спонсор и организатор – InterBioScreen Ltd. |
193 |
||||
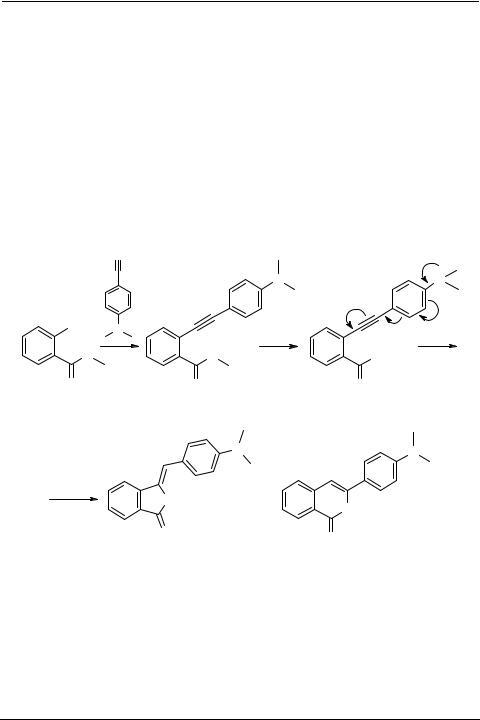
Таблица 1. Гетероциклизация ацетиленилбензойных кислот
Исходные |
R' |
Выход, % |
|
Литература |
|
соединения (R) |
|
|
|
|
|
|
3a–d |
4 |
|
||
|
|
|
|
||
|
|
|
|
|
|
1a |
(H) |
Ph |
a – 90 |
0 |
[6] |
1b |
(Cl) |
Ph |
b – 70 |
0 |
[6] |
1a |
(H) |
COOEt |
c – 40 |
0 |
[6] |
1a |
(H) |
n-Pr |
d – 40 |
22 |
[6, 7] |
|
|
|
|
|
|
Мы показали, что даже при гетероциклизации o-ацетиленилбензойной кислоты 7, у которой +M – эффект заместителя (NMe2) вызывает поляризацию тройной связи, благоприятствуя циклизации в 6-членный изокумарин [8, 9], все же образуется смесь изокумарина 9 и фталида 8 с преобладанием последнего (схема 2).
Схема 2
CuC
|
|
N |
. . |
|
|
N |
|
I |
N |
NaOH |
|
|
|
|
|
O |
O |
MeOH |
OH |
O |
O |
|
O |
5 |
6 |
|
7 |
|
|
N |
N |
Cu(I), ∆ |
O |
+ |
|
|
O |
||
|
|
|
|
|
O |
|
O |
|
|
|
|
|
8 (47%) |
|
9 (24%) |
Проведенное нами изучение процессов взаимодействия всех возможных изомеров виц-иодо(ацетиленил)пиразол карбоновых кислот 10 и 11 [10, 11] в присутствии ацетиленидов меди, показало, что вне зависимости от внутренних (природа субстрата и заместителя при тройной связи) и внешних (температура, тип катализатора и растворителей) параметров, процесс гетероциклизации этих соединений приводит исключительно к 6-членным лактонам (пиранопиразолам) 12 и 13 с
выходами 50–65% [10] (схема 3).
194 |
Устные доклады |
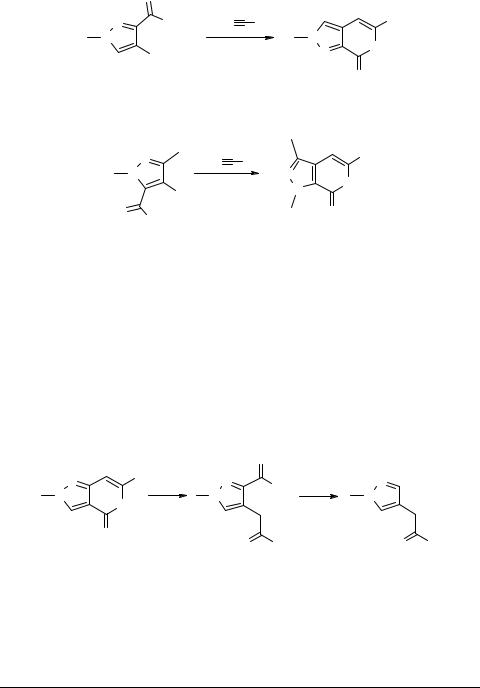
Схема 3
|
O |
|
|
|
|
|
|
N |
OH |
CuC |
R |
|
|
N |
R |
N |
|
|
|
|
|
O |
|
|
I |
|
|
|
|
N |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
O |
10 |
|
|
|
|
|
|
12a−c |
N |
N |
CuC |
R |
N |
|
|
R |
|
|
|
N |
|
O |
||
|
I |
|
|
|
|
||
|
|
|
|
|
|
||
O |
OH |
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
11 |
|
|
|
|
13a−c |
|
R= Ph (a), Bu (b), CH 2OMe (c)
Вспектрах ПМР соединений 12a и 13b наблюдается синглет протона пиранового цикла в области 5.97–6.77 м.д., что исключает структуру фталида.
Дополнительные подтверждения шестичленной структуры соединения получены при его гидролизе водной щелочью до кетокислоты 15, которая была декарбоксилирована в 4-фенацил-1-метилпиразол (схема 4) (выход 74%), неидентичный описанному в литературе [12] 1-метил-4-фенилацетилпиразолу 16.
Схема 4
|
Ph HO− |
|
|
O |
|
|
N |
N |
N |
OH |
∆ |
N |
|
N |
|
|
|
N |
||
O |
|
|
−CO2 |
|||
|
|
|
|
|
||
|
O |
|
|
O Ph |
|
O Ph |
|
|
|
|
|
||
|
12a |
|
|
14 |
|
15 (74%) |
Кросс-сочетание 5-иод-кислоты 17 с n-пропил- и фенилацетиленидами меди в пиридине при 115°C (схема 5) также протекает с замыканием 6-членного δ-лактон- ного цикла и образованием соединений 18a, b с выходами 66 и 79% соответственно [11].
Генеральный спонсор и организатор – InterBioScreen Ltd. |
195 |
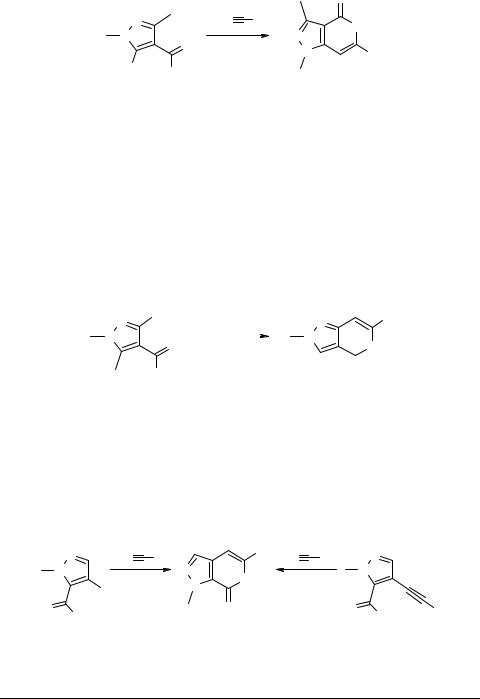
Схема 5
|
|
|
O |
N |
CuC R |
N |
O |
N |
|
||
O |
|
||
|
N |
R |
|
I |
|
||
OH |
|
|
|
17 |
|
18a, b |
|
|
|
||
|
R = n-Pr (a), Ph (b) |
|
|
Структура лактона 18а подтверждается спектром ПМР, в котором, наряду с сигналами пропильной группы (для α-CH2 – триплет при 2.45 м.д.) и синглетами N- и C-метильных групп пиразольного кольца, присутствует синглет незамещенного протона кислородсодержащего кольца при 6.25 м.д. В спектре ПМР лактона 18b имеется аналогичный синглет при 6.68 м.д. [10].
Наконец, изомерная 3-иод-1,5-диметилпиразол-4-карбоновая кислота 19 реагирует с фенил- и n-амилацетиленидом в пиридине при 115°C (схема 6) с образованием также δ-лактонов 20b и 20с (66 и 67%).
Схема 6
N |
N I |
|
CuC |
|
|
Ph |
N |
|
|
R |
|
|
|
|
|||||||||
|
|
|
|
||||||||
O |
|
|
|
|
|
|
N |
|
|
O |
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
||
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|||
|
19 |
|
|
|
|
|
|
|
20b, c |
||
|
|
R = Ph (b), C 6H11 (c) |
|
|
|
|
|||||
Строение пирано[4,3-c]пиразола 20с подтверждается присутствием в его спектре ПМР синглета при 5.96 м.д., отвечающего протону пиранового цикла, и триплета при 2.37 м.д. группы α-CH2 алкильного заместителя. В спектре ПМР соединения 20b протон пиранового цикла проявляется также в виде синглета при 6.95 м.д.
Схема 7
|
N |
CuC Ph |
|
R CuC |
Ph |
N |
|
|
N |
N |
N |
O |
|
N |
|
|
|
I |
|
|
|
||
|
|
|
|
|
|
||
O |
|
|
O |
O |
|
|
|
OH |
|
|
OH |
R |
|||
|
|
|
|
|
|
||
|
23 |
|
|
22a−d |
|
21a−d |
|
R = CH2OMe (a), CH2Mph (b), Ph (c), H (d)
196 |
Устные доклады |
