
Карцев В.Г.Избранные методы с-за и модифик. гетероциклов т.1 , 2003
.pdf
Новые фторсодержащие и функционально замещенные тетратиафульвалены
Абашев Г.Г., Шкляева Е.В., Лебедев К.Ю.
Естественнонаучный институт при Пермском университете 614990, Пермь, ул. Генкеля, 4
Со времени открытия тетратиафульваленов (ТТФ) [1] прошло более 30 лет, за этот период опубликовано огромное количество работ, посвященных исследованиям этой молекулы и ее разнообразных производных. Такой интерес к данным соединениям вызван исключительными для органических веществ свойствами, проявляемыми комплексами с переносом заряда (КПЗ) и ион-радикальными солями (ИРС), полученными на основе этих соединений, а именно характером их проводимости, в частности сверхпроводимостью [2]. Строение молекул самих по себе π-доноров этого класса, то есть непосредственно молекул ТТФ, представляет особый интерес для исследований в силу его необычности – способностью образовывать димеры, высоко ориентированные стопки и слои за счет межмолекулярных π,π-взаимодействий и невалентных S…S и других взаимодействий. Для изменения характера таких взаимодействий в ядро ТТФ вводят различные функциональные группы, такие как гидроксиметильные, гидрокси, алкил, алкокси, амидные, фосфонатные, галогены и т.д. В последнее время все чаще стали появляться работы, где в систему тетратиафульваленового ядра вводят различные фторсодержащие заместители, такие как полифторированные алкилы (например, C8F17 [3]), -COF [4], >CF2 [5], CF3 [6], C6F5 [7], CH(OH)CH2F [8] и т.д. Известно, что F–F-взаи-
модействия очень слабы, практически ничтожны, и ими можно пренебречь, тогда как взаимодействия F-элемент являются одними из наиболее сильных. Такие взаимодействия могут способствовать стабилизации образования стопок и пластин, кроме того, не следует забывать и о внутримолекулярном перераспределении электронной плотности, возникающем как следствие появления электроотрицательных атомов фтора в молекуле. Безусловно, на характер поведения фторсодержащего ТТФ-донора, на его способность образовывать ион-радикальные соли, на проводимость полученных солей и ее характер так или иначе будет влиять и количество атомов фтора в системе, и их взаимное расположение, и их удаленность от ТТФ-ядра. Введение фторсодержащих фрагментов в молекулу ТТФ может существенно изменить растворимость полученных доноров и его солей и комплексов [3].
Для исследования этих закономерностей нами был синтезирован ряд фторированных доноров 1–6 [9–10], исследована их проводимость и начато изучение их кристаллической структуры.
Ar |
S |
S |
S |
S |
Ar |
S |
S |
S |
S |
Ar |
Ar |
S |
S |
S |
S |
Ar |
S |
S |
S |
S |
|
|
|
1 Ar = 2,3,5,6-F4C6H |
|
|
6 Ar = 2,3,5,6-F4C6H |
|
||||
|
|
|
|
|||||||
Генеральный спонсор и организатор – InterBioScreen Ltd. |
|
|
157 |
|||||||
Ar |
S |
S |
S |
S |
Ar |
S S
2−5
Ar = C6F5, 2,3,5,6-F4C6H, 3,5-CF3C6H3, 2-F-4-BrC6H3
Тетратиафульвалены, включающие в свой состав замещенные бензилтиогруппы, представляют интерес с точки зрения образования пленок Лэнгмюра– Блоджетт. Найдено, что ЛБ-пленки, полученные на основе таких ТТФ, отличаются высокой стабильностью и обладают хорошей проводимостью, например, [11].
В продолжение развития этой темы нами были синтезированы новые фторсодержащие тетратиафульвалены, а также исходные для синтеза ТТФ 1,3-дитиол- 2-тионы, содержащие одновременно фторированные заместители и заместители другой природы. На cхеме 1 показан синтез симметричных тетратиафульваленов, содержащих четыре одинаковых заместителя.
|
|
|
|
|
|
|
|
|
Схема 1 |
NC |
S |
S |
S |
S |
CN |
SR |
S |
S |
SR |
|
|
|
|
i, ii |
|
|
|
||
NC |
S |
S |
S |
S |
CN |
SR |
S |
S |
SR |
|
|
||||||||
|
|
7 |
|
|
|
|
|
8−13 |
|
|
8 |
F |
H ; 9 |
|
F ; 10 |
O F |
H ; |
|
|
|
|
|
|
|
|
( )5 |
|
|
|
|
11 O |
F |
; 12 |
O |
OMe ; 13 |
|
|
|
|
|
( )4 |
|
|
( )4 |
|
|
O |
|
|
i- аргон, ДМФА, 4 экв. CsOH·H2O, т.комн., 1 час;
ii- аргон, 4 экв. RX, т.комн., 20−24 часа
Для получения этой группы соединений нами был применен очень удобный и ныне широко применяемый метод, разработанный Бечером и сотрудниками [12], заключающийся в использовании такой S-защитной группы как CH2CH2CN для введения новых заместителей у атома серы ТТФ-ядра. Этот метод позволил существенно расширить круг тетратиафульваленов, содержащих в одной молекуле как однотипные, так и весьма разные по своей химической природе заместители, например, [13]. В качестве исходного соединения был использован достаточно легко синтезируемый ТТФ 7. Для сравнения донорной способности полученных ТТФпроизводных и изучения их кристаллической структуры синтезированы тетратиафульвалены, включающие в свой состав разно удаленные от ТТФ-ядра, но одинаково фторированные фрагменты (-C6HF4-2,3,5,6 и -C6F5) (пары 8 и 10, 9 и 11), а также тетратиафульвалены, содержащие одинаково удаленные ароматические донорный фрагмент (-C6H4OCH3) и акцепторные фторированные фрагменты
158 |
Устные доклады |
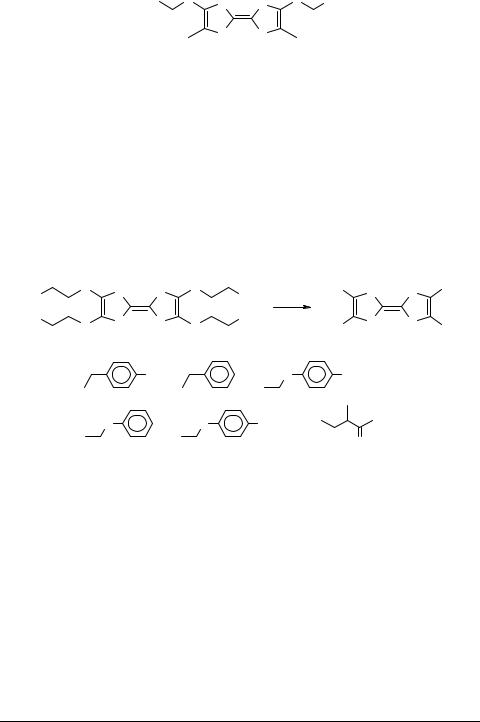
(-C6HF4-2,3,5,6 и -C6F5) (пара 11 и 12 или 10 и 12) (cхема 1). Нужно отметить, что соединение 8 было получено ранее [9], были описаны его свойства, исследованы его кристаллическая структура (методом РСА) [9] и вольтамперометрические характеристики, однако, использованный в предыдущей работе метод был многостадийным и трудоемким. Метод же, примененный в данной работе, позволил получить это же соединение с очень хорошим выходом (93%).
Все соединения, полученные методом Бечера, представляют собой хорошо кристаллизующиеся (кроме 9) вещества оранжевого и фиолетового цвета.
Используя схему 1, нами, кроме тетратиафульваленов 8–12, был синтезирован ТТФ 13, включающий в свой состав 4 разветвленных карбонилсодержащих фрагмента [SCH(CH3)COCH3]. Введение в структуру тетратиафульваленов заместителей, содержащих карбонильные группы, достаточно популярно, так как появление такой группы меняет подвижность и форму электронного окружения ТТФ-ядра, и, кроме того, ТТФ с карбонильной группой могут стать исходными соединения для синтеза дендримеров, например, [14].
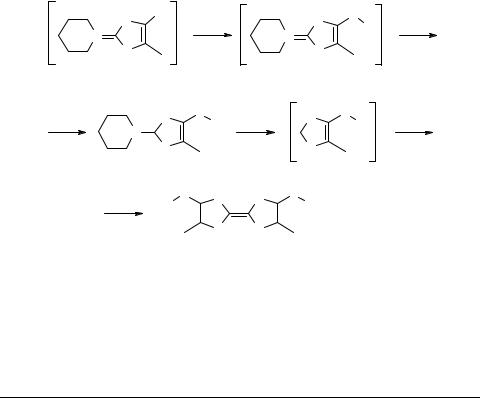
Совершенно другим методом, включающим использование мезоионной соли 14, нами были синтезированы тетратиафульвалены 18a, 18b, содержащие одновременно заместители разного рода -CH3 и -CH2(CH2)3CH2-O-C6HF4-2,3,5,6 18a, а
также пару -CH3 и -CH2(CH2)2CH2-O-C6H4-OCH3-p 18b (cхема 2).
Схема 2
|
+ |
S |
S− |
|
i |
|
+ |
S |
S |
Br− |
|
|
|
|
|
|
|
R |
|||
|
N |
S |
|
|
|
|
N |
S |
|
|
|
|
|
|
|
|
|
|
|
||
|
14 |
|
|
|
|
|
15a, b |
|
|
|
ii |
|
|
S S |
R |
iii |
|
S |
S |
ClO4− |
|
|
N |
|
|
|
+ |
|
R |
|||
|
|
|
|
|
|
|
|
|
||
|
|
|
S |
|
|
|
|
S |
|
|
|
|
16a, b |
|
|
|
|
|
17a, b |
|
|
|
|
iv |
R |
S |
S |
S |
S |
R |
|
|
|
|
|
|
|
|
|
|
|||
S S
18a, b (цис/транс)
R = (CH2)4CH2OC6HF4-2,3,5,6 (15a−18a), (CH2)3CH2OC6H4OMe-p (15b−18b)
i - ацетон, to, 1 экв. BrCH2R; ii - NaBH4, MeOH, т.комн.; iii - HClO4 (70%), Ac2O; iv - MeCN, Et3N, т.комн.
Соединения 18a и 18b получаются в виде смеси двух геометрических изомеров и представляют собой кристаллические соединения, окрашенные в оранжевый, красно-оранжевый цвет.
Генеральный спонсор и организатор – InterBioScreen Ltd. |
159 |

Для дальнейших исследований, то есть для получения ТТФ, включающих в свой состав разнородные по своему химическому составу фрагменты, методом Бечера были синтезированы следующие фторсодержащие 1,3-дитиол-2-тионы
20–22 (cхема 3).
Схема 3
S |
S |
CN |
i, ii |
S |
S |
R |
|
|
|||||
S |
|
CN |
|
S |
S R |
|
S S |
|
S |
||||
|
|
|||||
|
19 |
|
|
20−22 |
|
|
R = CH2-2,3,5,6-F4C6H (20), CH2CF5 (21), CH2-3,5-CF3C6H3 (22)
i- аргон, MeOH, 1 экв. CsOH·H2O, т.комн., 1 час;
ii- аргон, 1 экв. RX, т.комн.
Структура всех полученных соединений подтверждена данными ИК и ПМР спектроскопии.
Работа выполнена при финансовой поддержке РФФИ (грант № 02-03-32665).
Литература
1.Wudl F., Smith G.M., Hufnage T.G., J. Org. Soc., Chem. Commun. 1970 1453.
2.(a) Jerome D., Mazaud A., Ribault M., Bechgaard K., J. Phys. Let. 1988 41 L-95;
(b) Ягубский Э.Б. и др., Письма в ЖЭТФ 1984 1 12; (c) Williams J.M., Ferraro J.R., Thorn R.J., et al., Org. Superconductors (Including Fullerenes), Englwood Cliffs: Prentice Hall, 1992; (d) Bryce M.R., Devonport W., et al.,
Chem. Commun. 1998 945.
3.Nozdryan N., Favard J.-F., Cousseau J., et al., J. Fluorine Chem. 1997 86 177.
4.Cooke G., Rotello V.M., Radhi A., Tetrahedron Lett. 1999 40 8611.
5.Dautel O.J., Fourmigue M., J. Org. Chem. 2000 65 6479.
6.(a) Hartzler H.D., J. Am. Chem. Soc. 1970 92 1412; (b) Müller H., Lerf A., Fritz H.P., Liebigs Ann. Chem. 1991 395.
7.Knight B.W., Purrington S.T., Bereman R.D., et al., Synthesis 1994 460.
8.Saygili N., Brown R.J., Day P., et al., Tetrahedron 2001 57 5015.
9.Abashev G.G., Shklyaeva E.V., Dyachenko O.A., et al., Yamada Conference LVI, 4th ISCOM2001, Synt. Met., 2002.
10.Abashev G.G., Shklyaeva E.V., Korekov D.N., et al., Перспективы развития естественных наук в высшей школе: труды межд. научн. конф., Пермь, 2001,
т. 1, с. 25.
11.(a) Xiao Y., Yao Z., Din D., Thin Solid Films 1994 249 210; (b) Li H., Yao Z., Tan G., et al., Synth. Met. 1998 92 256.
12.Svenstrup N., Rasmunsen K.M., Hansen T.K., Becher J., Synthesis 1994 809.
13.Nielsen M.B., Lomholt C., Becher J., Chem. Soc. Rev. 2000 29 153.
14.Helberg I., Balodis K., Moge M., et al., J. Mater. Chem. 1997 7 (1) 31.
160 |
Устные доклады |

Лигнаны, пирано- и фуранохинолины
Haplophyllum perforatum и их биологическая активность
Ахмеджанова В.И.1, Олливиер Э.2, Ангенот Л.3, Балансард Г.2, Шахидоятов Х.М.1
1Институт химии растительных веществ им. акад. С.Ю. Юнусова АН Республики Узбекистан 700170, Ташкент, пр. Х. Абдуллаева, 77 2Средиземноморский университет 13385, Франция, Марсель, 5 3Институт Фармации Бельгия, Льеж, 1
Haplophyllum perforatum Kar. et Kir. (цельнолистник исколотый) − многолетнее травянистое растение семейства Rutaceae, являющееся широко распространенным эндемом центральноазиатского региона [1]. Встречается в предгорьях и среднем поясе гор, образуя заросли в ряде мест обитания. Издавна оно применялось в народной медицине как обезболивающее, противовоспалительное, снотворное и противоопухолевое средство [2].
Научными исследованиями показано присутствие в этом растении флавоноидов, кумаринов, лигнанов, алкалоидов, фенилкарбоновых и высших жирных кислот [1]. Качественный и количественный составы компонентов варьируют в зависимости от органа растения, периода вегетации и особенно от места произрастания.
В сообщении обобщаются литературные и полученные авторами данные, включая непубликованные, по выделению и изучению химических и биологических свойств пирано- и фуранохинолинов, а также лигнанов H. рerforatum, произрастающего в Джунгарском Алатау. Химический состав надземной части и корней растения исследовался отдельно.
Метанольный экстракт надземной части делили на основную, нейтральную и кислую части. Выделение чистых компонентов осуществляли методом колоночной хроматографии с использованием силикагеля и градиентной элюации. Из нейтральной фракции были выделены пирано-2-хинолоны флиндерсин 1, хапламин 2 и β,γ-дигидрохапламин, а также лигнан эудесмин 3, а из основной − фуранохинолины гликоперин 4, метилэвоксин 5, эвоксин 6, 7-изопентенилокси-γ-фагарин 7, эводин 8, эвоксоидин 9 и перфамин 10. В корнях был обнаружен лигнан дифиллин 11. Всего из растения нами было выделено 12 компонентов, которые относятся к 3 группам природных соединений: пирано-2-хинолоны (1; 2; β,γ-дигидро- хапламин), фуранохинолины 4–10, лигнаны 3, 11.
Соединения 2, β,γ-дигидрохапламин, 4 и 5 оказались новыми и для них доказано строение [3]. Соединение 4 – первый гликоалкалоид фуранохинолинового ряда. Представители группы пирано-2-хинолонов, а также вещества 7–9 и 11 в растениях рода Haplophyllum обнаружены впервые нами. Основными компонентами этого растения являются соединения 2, 11, 4, 3 и 6, выход которых от веса сухого
Генеральный спонсор и организатор – InterBioScreen Ltd. |
161 |
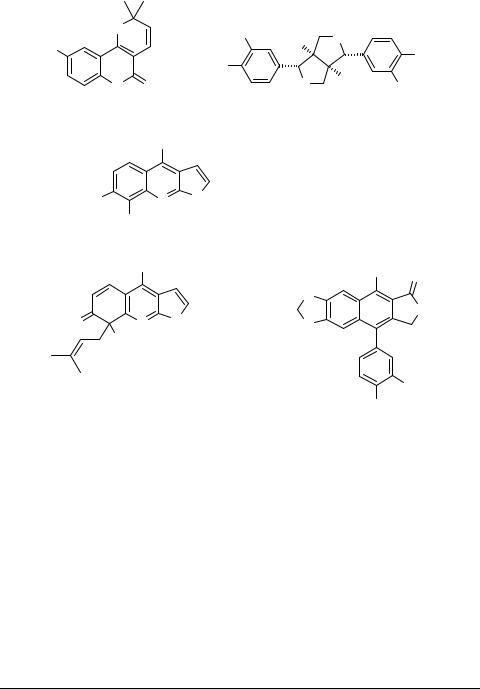
растения составляет 0.143, 0.1, 0.084, 0.072 и 0.064%, соответственно. Остальные компоненты – минорные (0.002–0.015%).
RO 5
8
O |
|
β |
MeO |
H |
O |
|
|
|
γ |
|
|||
|
|
|
|
OMe |
||
|
3 |
|
MeO |
|
|
|
|
|
|
|
H |
|
|
N |
|
O |
|
O |
OMe |
|
|
|
|
||||
H |
|
|
|
|
|
|
1 R = H; 2 R = Me |
|
|
3 |
|
||
|
OMe |
|
4 |
R = α-L-Rhap; |
||
|
|
|
5 |
R = CH2CH(OH)C(OMe)Me2; |
||
|
|
|
6 |
R = CH2CH(OH)C(OH)Me2; |
||
RO |
N |
O |
7 |
R = CH2CHCMe2; |
||
8 |
R = CH2CH(OH)C(CH2)Me; |
|||||
|
OMe |
|
||||
|
|
9 |
R = CH2COCHMe2 |
|||
|
4−9 |
|
|
|
|
|
|
OMe |
|
|
|
OH O |
|
O |
N O |
|
|
O |
||
|
|
|
||||
|
|
|
O |
|||
|
|
O |
||||
OMe
OMe
10 |
11 OMe |
1 и 2 вступают в реакции, характерные для пирано-2-хинолонов и обусловленные присутствием в их молекулах α,α-диметилпиранового кольца. Окисление с помощью KМnO4 в растворе Ме2СО протекает с разрывом пиранового кольца и образованием двухосновной кислоты, которая при нагревании с разбавленной HCl распадается до соответствующего производного 2,4-диоксихинолина. Эти производные образуются и при перегонке указанных соединений с 30% раствором щелочи. β,γ-Дигидрохапламин, у которого α,α-диметилпирановое кольцо гидрировано, в эти реакции не вступает.
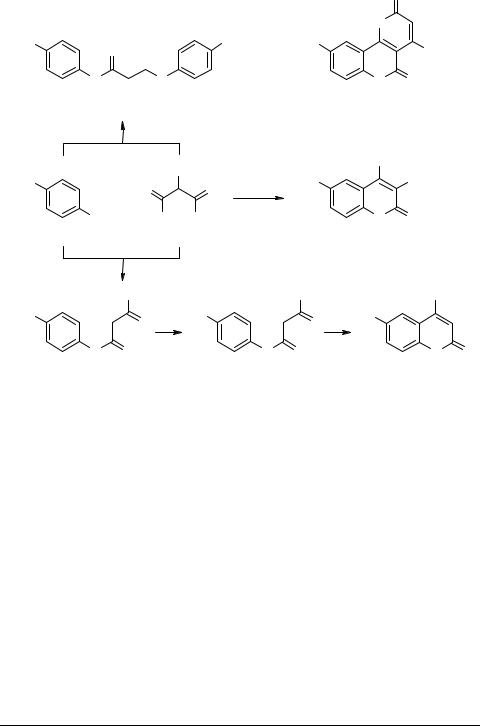
Для подтверждения положения ОСН3 группы в молекуле 2 мы попытались синтезировать 6-метокси-4-окси-2-хинолон 12 в одну стадию взаимодействием п-анизидина 13 и диэтилмалоната (14, R = H) в кипящем дифениловом эфире. Этот метод широко используется в химии фуранохинолинов для получения производных 4-окси-2-хинолона [4]. Однако вместо ожидаемого продукта получили ди- п-анизидид малоновой кислоты 15 и вещество 16 с Тпл 325–330°С, М 259 (массспектрометрия).
162 |
Устные доклады |
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
O |
|
MeO |
O |
|
|
OMe |
MeO |
|
OH |
|
|
|
|
+ |
|
|
|||
|
N |
|
|
N |
|
N |
O |
|
|
|
|
|
|
||||
|
H |
|
|
H |
|
|
H |
|
|
|
15 |
|
|
|
16 |
|
|
|
|
|
Ph2O |
|
|
|
|
|
|
|
R = H |
|
|
|
OH |
|
|
|
|
|
|
R |
|
|
|
|
MeO |
|
|
|
|
MeO |
|
R |
|
|
+ |
O |
O Ph2O |
|
||||
|
|
|
|
3 |
||||
|
|
|
OEt OEt |
R = Alk |
|
N |
O |
|
|
NH2 |
|
|
|||||
|
|
|
|
|||||
|
13 |
|
|
14 |
|
|
H |
|
|
|
|
|
|
|
|
||
|
1:10 |
|
R = H |
|
|
17 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OEt |
|
|
OH |
|
OH |
MeO |
|
|
O |
MeO |
|
O |
MeO |
3 |
|
|
|
|
|
|
|||
|
N |
|
O |
|
N |
O |
|
N O |
|
H |
|
|
|
H |
|
|
H |
|
18 |
|
|
|
19 |
|
|
12 |
Эти данные согласуются с опубликованными результатами аналогичной попытки синтеза 6,8-диметокси-4-окси-2-хинолона [5]. По-видимому, вышеописанным методом можно получить только те производные 4-окси-2-хинолона, которые содержат алкильный заместитель в положении 3 17. Необходимый хинолон был получен в результате нагревания п-анизидина с избытком диэтилмалоната (1 : 10), последующего омыления и циклизации продукта (18→19→12). При соотношении исходных реагентов (1 : 1) образуется преимущественно ди-п-анизидид малоновой кислоты.
Интересные данные получены нами при изучении способности 1 и 2 к лактамлактимной таутомерии, с которой обычно связывают и двойственную реакционную способность соединений с NHCO-группой, ведущую к образованию N- и О-замещенных производных. Как в твердом состоянии, так и в растворе хлороформа эти соединения имеют лактамное строение 1 и 2, о чем свидетельствует интенсивная полоса поглощения амидного карбонила в их ИК спектрах при 1665 см–1 1 и 1660 см–1 2. Однако при нагревании с иодистым метилом в Ме2СО в присутствии поташа из 1 образуется N-метильное производное, а 2 в этих условиях дает 2-О-ме- тильный продукт, строение которого было подтверждено встречным частичным синтезом из 2-хлорхапламина. При нагревании 2 с уксусным ангидридом в
Генеральный спонсор и организатор – InterBioScreen Ltd. |
163 |

присутствии п-толуолсульфокислоты было получено О-ацетильное производное (νСО 1765 см–1) тоже по положению 2. Таким образом, 2 в отличие от 1 вступает в указанные реакции в виде лактима 2а.
O
MeO
2
N  OH
OH
2a
Это обусловлено, по-видимому, присутствием в молекуле 2 электронодонорной метоксильной группы при С(6), п-положение которой к атому азота и диа- метрально-противоположное расположение к амидному карбонилу увеличивают эффект сопряжения электронов этого заместителя с неподеленными парами электронов азота и карбонильного кислорода, что способствует стабилизации лактимной формы 2а в условиях рассмотренных реакций.
Фармакологические исследования показали, что 2 малотоксичен и обладает седативным действием [6а]. Начиная с доз 100–200 мг/кг, вызывает ограничение двигательной активности мышей. Оказывает мышечнорасслабляющий эффект, выраженное угнетающее действие при возбуждении, вызванном кофеином. 6 проявляет общее успокаивающее действие, усиливает эффект снотворных средств у белых мышей, уменьшает судорожное действие и токсичность камфоры, коразола, кордиамина и никотина [6b]. Лигнан 3 обладает эстрогенной активностью кратковременного действия [7]. В дозах 1.5 и 10 мг/кг вызывает увеличение матки неполовозрелых крыс и фазу эструса у овариоэктомированных половозрелых животных. Оказывает общее успокаивающее действие в дозах 50 и 100 мг/кг. При взаимодействии со снотворными и наркотиками удлиняет снотворный эффект в 2–5 раз в зависимости от дозы. Сочетание седативной и эстрогенной активности выгодно отличает 3 от других существующих эстрогенных препаратов. Надземная часть H. рerforatum может служить источником для его получения.
Совсем недавно для некоторых компонентов этого растения нами обнаружено проявление антипаразитарной и противоопухолевой активности.
Авторы выражают глубокую благодарность организации INTAS за финансовую поддержку фармакологического изучения полученных соединений и дальнейшее изучение компонентов этого растения и их активности (грант № 01-2043).
164 |
Устные доклады |

Литература
1.Растительные ресурсы СССР: цветковые растения, их химический состав, использование; Семейства Rutaceae-Elaeagnaceae, Л.: Наука, 1988, с. 13.
2.Ибн Сина А.А., Канон врачебной науки. Избранные разделы, Ташкент: ФАН, 1985, с. 254.
3.Ахмеджанова В.И., Хим. прир. соед. 1999 (5) 634.
4.Murphy S.T., Ritchie E., Taylor W.C., Aust. J. Chem. 1974 27 187.
5.Venturella P., Bellino A., Piozzi F., Chim. Ital. 1974 104 297.
6.Садритдинов Ф.С., Курмуков А.Г., Фармакология растительных алкалоидов и их применение в медицине, Ташкент: Медицина Уз ССР, 1980, (а) с. 274,
(b) с. 276.
7.Ахмедходжаева Х.С., Курмуков А.Г., ДАН АН УзССР 1975 (1) 34.
Генеральный спонсор и организатор – InterBioScreen Ltd. |
165 |
Таутомерия и реакционная способность гетероциклических β,β'-трикарбонильных
соединений и их анионов
Ахрем А.А., Гулякевич О.В., Михальчук А.Л.
Институт биоорганической химии Национальной Академии наук Беларуси 220141, Минск, ул. акад. В.Ф. Купревича, 5, корп. 2
Гетероциклические β,β'-трикабонильные соединения (β,β'-ТКС) 1 (X = N, O, S и др.) представляют одну из наиболее разнообразных групп большого семейства β,β'-ТКС, включающего также триацилметаны 2, 2-ацилцикландионы 3 и их конденсированные производные, например, ацилпроизводные индандиона 4. Эти соединения широко распространены в природе (бактерии, растения, насекомые, нефть, угли, сланцы), что свидетельствует о глубокой вовлеченности их в процессы жизнедеятельности со времен зарождения жизни и о важности их биологических функций. β,β'-ТКС применяются в медицине, ветеринарии, растениеводстве [1–3], как исходные и промежуточные вещества в синтезе лекарственных средств, пестицидов, красителей и др. [4, 5]. Синтез, свойства и распространение этих соединений в природных источниках рассмотрены в ряде обзоров и монографий [6–10].
|
O |
O |
O |
O |
O |
|
|
O |
m( ) |
|
R |
R |
|
R' |
O |
|
O |
|
|
|
|
|
||||
X |
( )n |
O |
O |
R'' |
n( ) |
R |
|
R |
|
O |
|
||||||
|
|
|
|
|
|
|
O |
|
|
1 |
|
|
2 |
3 |
|
|
4 |
|
O |
O |
O |
O |
O |
O |
O |
O |
X |
|
O |
|
HN |
|
O |
|
|
|
|
|
|
|
||||
|
|
|
|
O |
O N |
O |
O |
O |
|
O |
|
|
|
H |
|
|
|
|
5 |
|
6 |
|
7 |
|
8 |
|
Родоначальными представителями отдельных рядов гетероциклических β,β'-ТКС являются 3-ацетилтетроновая 5 (X = O), -тетрамовая 5 (X = N), -тиоте- троновая 5 (X = S), дегидрацетовая 6, 5-ацетилбарбитуровая 7 кислоты и ацетилпроизводное кислоты Мельдрума 8.
Общим свойством β,β'-ТКС является их прототропия или кето-енол-енольная таутомерия [7, 8]. Существующие представления о таутомерии β,β'-ТКС могут быть обобщены на примере их карбо- 3 (R = Me, n = 1) и гетероциклических 5 (Х = O, N, S) представителей.
166 |
Устные доклады |
