
Карцев В.Г.Избранные методы с-за и модифик. гетероциклов т.1 , 2003
.pdf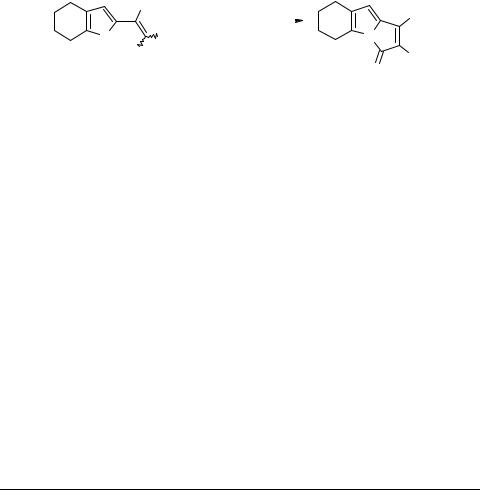
Пирролизины 21 в этом случае часто содержат примеси метокси- 22 и гидроксипирролизинов 23 – минорных продуктов нуклеофильного замещения алкилтиогруппы метоксид- и гидроксид-ионами.
Легкая циклизация функционализированных 2-винилпирролов в соответствующие пирролизины катализируется также следовыми количествами третичных аминов в метаноле при 50°C. Для производных тетрагидроиндола выходы составляют 61–98% и зависят от строения функциональных групп при двойной связи (нитрильной, амидной, кетонной или сложноэфирной) [40, 41] (схема 8). В стандартных условиях дициановинилтетрагидроиндол 24 (X = Y = CN) дает соответствующий пирролизин 25a за 15 мин, в то время как цианокарбамоильному производному 24 (X = CN, Y = CONH2) для этого требуется 5 ч [41].
Схема 8
|
SEt |
Et3N (0.1−0.3%)/MeOH |
SEt |
|
|
||
N |
Y |
50°C |
N |
H |
X |
|
Y |
|
|
||
24 |
|
|
X |
|
|
25a−e (61−98%) |
|
|
|
|
|
25 |
Y |
X |
Выход, % |
|
|
|
|
a |
CN |
NH |
98 |
b |
CONH2 |
NH |
93 |
c |
COMe |
O |
62 |
d |
CN |
O |
61 |
e |
CO2Et |
O |
75 |
Винилпирролы со сложноэфирной функцией, например 26, циклизуются гораздо легче, чем 2-винилпирролы, содержащие только нитрильную или амидную функции, причем это часто происходит уже на стадии их синтеза, когда такие CHкислоты, как этилцианоацетат, этилацетоацетат или диэтилмалонат конденсируются с 2-пирролкарбодитиоатами в системе KOH–ДМСО (схема 9). Выходы пирролизин-3-онов 27 составляют 61–75%. Уменьшение выходов в данном случае связано с известной нестабильностью сложных эфиров в системе KOH–ДМСО, а также геометрическими ограничениями [40].
Данная реакция является селективной. В случаях, когда у двойной связи вместе с этоксикарбонильной группой находятся другие функции, способные взаимодействовать с NH-группой пиррола, такие как нитрильная или ацетильная, в циклизации принимает участие только этоксикарбонильная функция. Других пирролизи-
Генеральный спонсор и организатор – InterBioScreen Ltd. |
127 |
новых структур (типа 28 или 29) с этоксикарбонильными заместителями среди продуктов реакции не обнаружено [40].
|
|
|
|
|
|
Схема 9 |
|
SEt |
a |
|
SEt |
|
SEt |
|
|
|
|
|
||
N |
S |
|
N |
X |
N |
|
H |
|
|
H O |
OEt |
O |
X |
|
|
|
26 |
|
||
|
|
|
|
27 |
|
|
|
|
|
|
|
X = CN (61%); |
|
|
|
X = CN |
|
X = COMe |
X = COMe (62%); |
|
|
|
|
|
|
X = CO2Et (75%) |
|
|
|
|
|
SEt |
|
SEt |
|
|
|
N |
OEt |
N |
OEt |
|
|
|
|
|
||
|
|
|
HN |
O |
|
OH O |
X = CN, COMe, CO2Et; |
28 |
|
29 |
|
||
a - XCH2CO2Et, KOH/ДМСО |
|
|
|
|
||
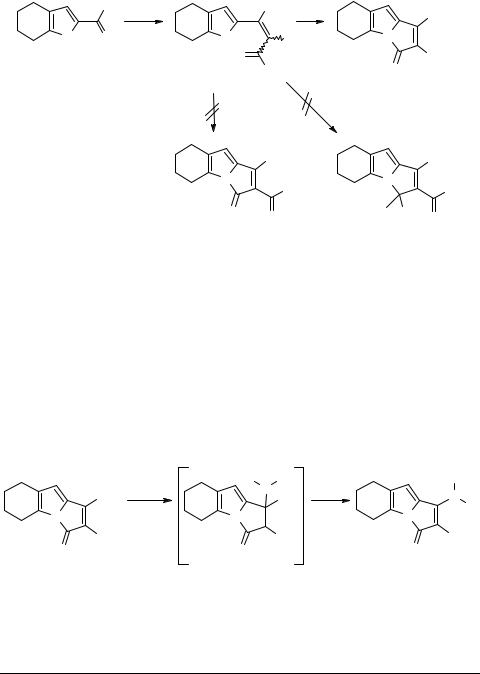
Синтезированные пирролизины, например 30, обладают интересным химическим свойством: при обработке вторичными аминами в метаноле при 40–50°C в течение 10 мин они количественно обменивают свою алкилтиогруппу на аминную функцию [40, 42, 43] (схема 10). Это формально нуклеофильное замещение, скорее всего, на самом деле является процессом присоединения–элиминирования, хотя промежуточных аддуктов 31 пока выделено не было. Вероятно, движущей силой этого обмена является более сильное пуш-пульное сопряжение в аминоцианоэтенильном фрагменте конечных продуктов 32 по сравнению с исходной системой, содержащей атом серы.
|
|
|
|
|
Схема 10 |
|
|
NHR2 |
R N |
R |
|
R |
|
SEt |
|
N |
|
|||
MeOH |
|
SEt |
|
R |
||
N |
N |
−EtSH |
N |
|
||
40−50°C |
|
|
|
|||
CN |
10 мин |
HN |
CN |
HN |
CN |
|
HN |
|
|
|
|
||
30 |
|
31 |
|
32 |
|
|
Этот необычно легкий обмен может быть использован как общий и очень эффективный путь синтеза различных 1-амино-2-циано-3-иминопирролизинов 32, так как в реакцию вступают самые разнообразные амины, в том числе гетероциклические.
128 |
Пленарные доклады |
Так как пирролизины могут образовываться in situ из соответствующих функционализированных 2-винилпирролов под действием аминов, то аминопирролизины, в свою очередь, могут быть синтезированы однореакторно непосредственно из 2-винилпирролов.
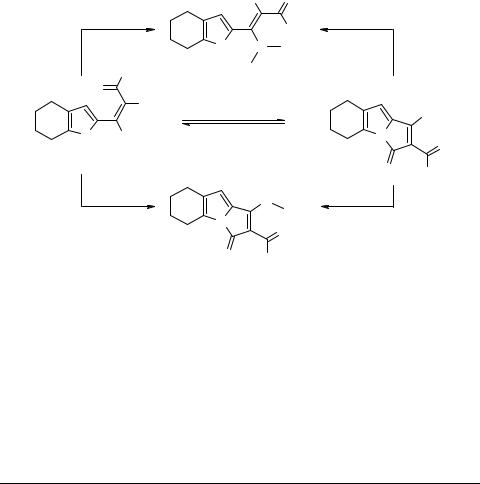
2-(2-Карбамоил-2-циано-1-алкилтиовинил)пирролы, например 33, легко обменивают алкилтиогруппу на аминный остаток уже при контакте с водным диметиламином, давая с хорошими выходами соответствующие диметиламиновинилпирролы, например 34 (схема 11). В этом случае ожидаемого пирролизина 35 с остаточной этилтиогруппой не обнаружено [42]. Последний образуется с выходом 46% из тех же винилпирролов типа 33 при кипячении в метаноле с каталитическим количеством Et3N. Умеренный выход продукта связан с обратной реакцией раскрытия цикла, которая была подтверждена независимо на индивидуальном пирролизине 35.
Схема 11
|
|
NC |
O |
|
|
Me2NH/H2O |
|
NH2 |
Me2NH/H2O |
|
|
|
кипячение, |
N |
30 мин |
|
|
|
15 мин |
N |
|
|
|
|
NH2 |
H |
|
|
|
|
34 (78%) |
|
|
|
|
|
O |
MeNH2/H2O; |
|
|
|
|
CN |
|
|
||
|
Et3N/MeOH (46%) |
|
SEt |
||
|
|
|
|||
|
|
|
|
|
|
N |
SEt |
|
|
N |
O |
H |
|
|
|
|
|
33 |
|
|
|
HN 35 NH2 |
|
|
|
|
H |
||
MeNH2 /H2O |
|
MeNH2 /H2O |
|
||
|
N |
|
|||
|
(71%) |
|
(82%) |
|
|
|
N |
O |
|
||
|
|
|
|
||
|
|
|
|
|
|
|
|
HN |
NH2 |
|
|
|
|
36 |
|
|
|
В водном диметиламине раскрытие цикла протекает до конца и сопровождается одновременным замещением этилтиогруппы на диметиламинный остаток с образованием винилпиррола 34.
Реакция того же винилпиррола 33 с водным метиламином протекает существенно иначе: сначала происходит замыкание цикла с образованием пирролизина 35, который обменивает свою этилтиогруппу на метиламинную функцию, образуя пирролизин 36.
Эти реакции обмена и рециклизации значительно расширяют потенциал винилпирролов 18 как строительных блоков для синтеза функционализированных пирролизинов.
Генеральный спонсор и организатор – InterBioScreen Ltd. |
129 |

Пирролиламинопиразолы 37 исключительно гладко и чисто получаются из 1-алкилтио-2-циановинилпирролов 18 и гидразингидрата при кипячении реагентов в метаноле в течение 15 мин (схема 12). Замыкание цикла сопровождается элиминированием алкантиолов. Выходы продуктов в большинстве случаев близки к количественным [44–47]. Реакция, по-видимому, начинается со стадии присое- динения-элиминирования, за которой следует внутримолекулярное нуклеофильное присоединение гидразинового фрагмента к нитрильной группе. Далее происходит прототропная перегруппировка иминодигидро-пиразольного интермедиата 38.
Схема 12
R' |
|
X |
|
R' |
|
X |
N |
|
|
CN |
|
|
|
|
|||
|
NH2NH2·H2O |
|
|
H |
|
|||
|
N |
|
MeOH |
|
N |
|
N |
−EtSH |
R |
SEt |
R |
|
SEt NH2 |
||||
кипячение, |
|
|
||||||
|
H |
|
15 мин |
|
H |
|
|
|
|
18 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R' |
|
X |
|
R' |
|
|
X |
|
|
|
|
N |
|
|
|
NH |
[1,3] |
||
|
|
|
|
|
|
|
|
|
|
R |
|
N |
NH |
|
R |
|
N |
N NH |
|
|
H H N |
|
|
H |
H |
|
|||
|
|
|
|
|
|
||||
|
|
2 |
|
|
|
|
38 |
|
|
|
R' |
|
X |
NH2 |
|
R' |
|
X |
NH2 |
|
|
|
|
|
|
||||
|
R |
N |
N N |
|
|
R |
N |
N NH |
|
|
H |
H |
|
|
|
H |
|
||
|
|
|
|
|
|
|
|||
|
|
|
37 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
X = CN, CONH2; R = n-Pr, n-Bu, Ph; R' = H, Et, n-Pr; R+R' = (CH2)4
Эта новая общая стратегия делает доступными множество функционализированных пирроло-пиразольных систем 37, в которых пиррольный фрагмент получается через кетоксимный синтез [27–29] (т.е. может широко варьироваться), а пиразольный цикл, кроме аминогруппы, может содержать также нитрильную, амидную или другие функции, в зависимости от того, какая CH-кислота была изначально использована в синтезе винилпиррола.
Пирролиламинопиразолы позволяют легко конструировать более крупные гетероциклические ансамбли. Например, их конденсация с гетероциклическими альдегидами (такими как N-винилбензимидазолкарбальдегид 39) (схема 13) приводит к сложным функционализированным системам 40, 41, состоящим из пиррольных (тетрагидроиндольных), пиразольных и бензимидазольных циклов, содержащих
130 |
Пленарные доклады |

реакционноспособные имино- и N-винильную группы, а также нитрильную или амидную функции, с выходом, близким к количественному [48]. Такие системы представляют собой перспективные мультидентные лиганды для хелатирования тяжелых металлов (Co, Cu, Fe, Ni, Pd и др.) и получения биологически и каталитически активных комплексов, подобных витамину B12.
Схема 13
|
R |
|
|
|
|
|
NH2 |
N |
O |
90−95°C, 3 ч |
|
|
|
+ |
|
||
N |
N NH |
H |
−H2O |
||
N |
|||||
H |
|
|
|
|
|
|
|
39 |
|
|
N
R  N
N
N
N |
N NH |
H |
|
40, 41 (85−95%)
R = CN (40), CONH2 (41)
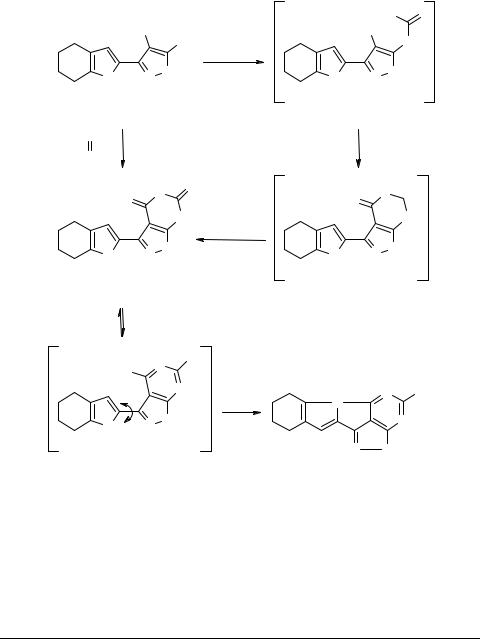
Пирролилпиразоло-дитионо-пиримидины типа 42 (представительный пример) (схема 14) – новое семейство аналогов пуринов – легко получаются с хорошим выходом из пирролил-амино-цианопиразолов (например, 43) и сероуглерода при кипячении реагентов в пиридине [47].
Промежуточная дитиокарбаминовая кислота 44 замыкается в тиазин 45, который далее рециклизуется по Димроту в дитионо-пиримидин 42. Последний, вероятно, существует в равновесии с ароматическим дитиольным таутомером 46, способным к дальнейшей внутримолекулярной циклизации с отщеплением сероводорода и образованием высококонденсированной пирроло-пиразоло-пиримиди- новой системы 47. Близкие результаты получены при использовании ксантогената калия вместо сероуглерода.
Подобные плоские поликонденсированные гетероциклы с пиррольными или индольными фрагментами, способными к переносу заряда, образованию водород-
Генеральный спонсор и организатор – InterBioScreen Ltd. |
131 |
ных связей и межплоскостной самосборке за счет π,π-взаимодействия колец привлекают в настоящее время большой интерес как потенциальные ДНК-интерактивные препараты (см., например, [49]).
Схема 14
NC
|
|
NH2 |
CS2 |
|
|
|
|
||
N |
N |
NH |
Py |
|
кипячение |
||||
H |
|
|
||
|
|
|
||
|
43 |
|
|
S
EtO SK
SK
|
|
H |
S |
|
S |
N |
|
|
|
|
|
|
|
NH по Димроту |
|
N |
|
N NH |
NaOH |
H |
|
|
|
|
42 (85%) |
|
|
|
HS |
N |
SH |
|
|
||
|
|
|
|
|
|
N |
|
N |
|
N NH |
−H2S |
H |
|
|
|
|
46 |
|
|
|
HS S |
|
NC |
|
NH |
N |
N NH |
H |
|
|
44 |
HN S 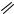 S NH
S NH
N N NH H
45
N SH
N
N
N NH
47
Когда вторая функция в пиразольном кольце является амидной, а не нитрильной, как в случае соединения 48 (схема 15), промежуточная дитиокарбаминовая кислота 49 может реагировать двумя альтернативными путями: либо элиминировать аммиак с образованием тиазинового цикла 50 (если тиольная функция ведет себя как нуклеофил по отношению к амиду), либо элиминировать сероводород, давая пиримидиновый цикл 51 (если взаимодействующие функции меняются
132 |
Пленарные доклады |
ролями). В действительности реализуется второй вариант и хемоселективно образуются пирролил- (в данном примере тетрагидроиндолил)-пиразолопиримидино- вые системы 51 с выходом 79% [47].
Схема 15
O |
NH2 |
NH2 |
|
O |
NH2 H |
S |
|
|
CS2 |
|
N |
||
|
|
|
|
|
|
|
N |
N NH |
Py |
N |
N NH |
SH |
|
H |
|
|
|
H |
|
|
48 |
|
|
|
49 |
|
|
|
|
|
−NH3 |
|
−H2S |
|
|
|
|
|
|
|
|
|
S |
S |
|
|
H |
S |
S |
|
|
O |
N |
|
|
|
NH |
|
|
|
||
|
|
|
|
NH |
||
N |
N NH |
|
N |
N NH |
|
|
H |
|
|
|
H |
|
|
50 |
|
|
|
51 (79%) |
|
|
Заключение
Систематически разработана новая общая методология конструирования различных функционализированных гетероциклических систем с пиррольными или индольными фрагментами через 2-пирролкарбодитиоаты (легко получаемые основнокатализируемой реакцией пирролов или тетрагидроиндола с сероуглеродом).
Данная методология может быть полезной в синтезе поликонденсированных гетероциклов, способных встраиваться в двойную спираль ДНК (благодаря возможности π,π-интерциклической самосборки, переноса заряда, образования водородных связей и электростатических взаимодействий) и, таким образом, играть роль антипролиферационных агентов.
Литература
1.Katritzky A.R., Marson C.M., Faid-Allah H., Heterocycles 1987 26 (6) 1657.
2.Oddo B., Alberti C., Gazz. Chim. Ital. 1938 68 204; Chem. Abstr. 1938 32 7450.
3.Bereman R.D., Nalewajek D., Inorg. Chem. 1977 16 2687.
4.El A'mma A.G., Grago R.S., Inorg. Chem. 1977 16 2975.
5.McCay C.M., Schmidt C.L.A., J. Am. Chem. Soc. 1926 48 1933.
Генеральный спонсор и организатор – InterBioScreen Ltd. |
133 |

6.Oddo B., Mingoia Q., Gazz. Chim. Ital. 1926 56 782.
7.Jensen K.A., Pedersen C., Acta Chem. Scand. 1961 15 1087.
8.Treibs A., Liebigs Ann. Chem. 1969 723 129.
9.Tominaga Y., Matsuoka Y., Oniyama Y., et al., J. Heterocycl. Chem. 1990 27 647.
10.Loader C.E., Anderson H.J., Can. J. Chem. 1971 49 45.
11.Treibs A., Friess R., Liebigs Ann. Chem. 1970 737 173.
12.Treibs A., Friess R., Liebigs Ann. Chem. 1970 737 179.
13.Трофимов Б.А., Собенина Л.Н., Михалева А.И., ХГС 1991 (7) 996.
14.Trofimov B.A., Sobenina L.N., Mikhaleva A.I., et al., Sulfur Lett. 1992 15 (5) 219.
15.Трофимов Б.А., Собенина Л.Н., Михалева А.И., ХГС 1992 (9) 1176.
16.Собенина Л.Н., Протасова Л.Е., Сергеева М.П. и др., ХГС 1995 (1) 47.
17.Trofimov B.A., Sobenina L.N., Mikhaleva A.I., et al., Tetrahedron 2000 56 7325.
18.Собенина Л.Н., Трофимов Б.А., Деменев А.П. и др., Тез. всеросс. конф. памяти А.Н. Коста по химии гетероциклов, Суздаль, 2000, с. 355.
19.Деменев А.П., Синтез и реакционная способность функциональнозамещенных C-винилпирролов, Дисс. канд. хим. наук, Иркутск: ИрИХ СО РАН, 2001.
20.Trofimov B.A., 1st Florida Heterocyclic Course & Conference, University of Gainesville (Florida, USA), 2000, p. F-1-18.
21.Trofimov B.A., Vitkovskaya N.M., Kobychev V.B., et al., Sulfur Lett. 2001 24
(4) 181.
22.Кобычев В.Б., Витковская Н.М., Зайцева И.Л. и др., Тез. междунар. конф. "Механизмы реакций и органические интермедиаты", Санкт-Петербург, 2001, с. 133.
23.Кобычев В.Б., Витковская Н.М., Зайцева И.Л. и др., Журн. структ. хим. 2001
42 (4) 645.
24.Кобычев В.Б., Витковская Н.М., Зайцева И.Л. и др., Тез. II междун. симп. "Компьютерное содействие в химических исследованиях", Москва, 2001, с. 74.
25.Kobychev V.B., Vitkovskaya N.M., Zaitseva I.L., et al., Int. J. Quant. Chem. 2002 88 542.
26.Собенина Л.Н., Михалева А.И., Петрова О.В., ЖОрХ 1999 35 (19) 1534.
27.Трофимов Б.А., Михалева А.И., N-Винилпирролы, Новосибирск: Наука, 1984.
28.Trofimov B.A., in Adv. Heterocycl. Chem., Katritzky A.R., Ed., San Diego: Academic Press, 1990, vol. 51, p. 177.
29.Пожарский А.Ф., Анисимова В.А., Цупак В., в сб. Практические работы по химии гетероциклов, Ростовский университет, 1988, с. 9.
30.Собенина Л.Н., Деменев А.П., Михалева А.И., ЖОрХ 2001 37 (4) 582.
31.Собенина Л.Н., Михалева А.И., Деменев А.П. и др., Тез. XX всеросс. конф.
по химии и технологии орг. соед. серы, Казань, 1999, с. 91.
32.Кузьмина Н.Я., Петров М.Л., Петров А.А., ЖОрХ 1984 20 (12) 2511.
33.Дрозд В.Н., Попова О.А., Вязгин А.С. и др., ЖОрХ 1983 19 (4) 847.
34.Sobenina L.N., Mikhaleva A.I., Trofimov B.A., et al., Tetrahedron 1995 51 4223.
35.Мурзина Н.М., Деменев А.П., Тез. молодежной школы по орг. химии,
Екатеринбург, 2000, с. 224.
36.Мурзина Н.М., Влияние внутримолекулярной и бифуркационной водородной связи на спектры и строение 2-циановинилпирролов в растворе, Дисс. канд. хим. наук, Иркутск: ИрИХ СО РАН, 2001.
37.Трофимов Б.А., Собенина Л.Н., Михалева А.И. и др., ХГС 1992 (7) 998.
134 |
Пленарные доклады |

38.Trofimov B.A., Phosphorus, Sulfur Silicon Relat. Elem. (Proc. of XVI Int. Symp. on Org. Chem. of Sulfur, Merseburg, Germany) 1994 95 (1–4) 159.
39.Trofimov B.A., Sobenina L.N., Mikhaleva A.I., Abstr. 207th ACS National Meeting, San Diego (USA), 1994, p. N89.
40.Собенина Л.Н., Михалева А.И., Сергеева М.П. и др., ХГС 1996 (7) 919.
41.Собенина Л.Н., Михалева А.И., Трофимов Б.А., ХГС 1995 (3) 418.
42.Sobenina L.N., Mikhaleva A.I., Toryashinova D.S.-D., et al., Sulfur Lett. 1997 20 (5) 205.
43.Sobenina L.N., Mikhaleva A.I., Toryashinova D.S.-D., et al., Sulfur Lett. 1996 20 (1) 9.
44.Собенина Л.Н., Михалева А.И., Петрова О.В. и др., Тез. междунар. конф.
по орг. химии памяти И. Постовского, Екатеринбург, 1998, с. 134.
45.Sobenina L.N., Mikhaleva A.I., Demenev A.P., et al., Abstr. 17th Int. Congr. Heterocycl. Chem., Vienna (Austria), 1999, p. PO-111.
46.Собенина Л.Н., Михалева А.И., Петрова О.В. и др., ЖОрХ 1999 35 (9) 1241.
47.Sobenina L.N., Demenev A.P., Mikhaleva A.I., et al., Sulfur Lett. 2000 24 (1) 1.
48.Байкалова Л.В., Собенина Л.Н., Михалева А.И. и др., ЖОрХ 2001 37 (9) 1817.
49.Lauria A., Diana P., Barraja P., et al., Tetrahedron 2002 58 9723.
Генеральный спонсор и организатор – InterBioScreen Ltd. |
135 |
Novel oxazoline-mediated syntheses of heterocycles
Florio S., Capriati V., Degennaro L., Luisi R., Perna F.
Dipartimento Farmaco-Chimico, Università di Bari, Via E. Orabona 4, Bari, I–70125 Italy
tel.: +39 (080) 544-2749, fax: +39 (080) 544-2231, e-mail: florio@farmchim.uniba.it
Introduction
Our current interest in metalated oxazolines [1–2] and their applications in synthetic organic chemistry has recently led us to prove that certain lithiated α-haloalkyl-2-oxa- zolines [3] and oxazolinyl oxiranes [4–5] are quite stable, at least at low temperature, and can be trapped with a variety of electrophiles furnishing more functionalized oxazolines and epoxides. In this paper, we will report on the lithiation of alkyl and α-chloro- alkyl-2-oxazolines and reaction with nitrones to produce stereoselectively novel alkenyl oxazolines, [1,2]-oxazetidines, and isoxazolidin-5-ones. The oxiranyl anion-based methodology [6], combined with the chemistry of the oxazoline system as a route to biologically active molecular targets will also be described. The synthesis of oxazolinyl allylic alcohols, useful masked Baylis–Hillman adducts, and of oxazolinylaryl alkanones will be highlighted as well.
1. Stereoselective synthesis of α,β-unsaturated oxazolines
α,β-Unsaturated oxazolines are quite interesting compounds either as such or as useful intermediates for preparation of other substances by the elaboration of both the heterocyclic moiety and the C–C double bond functionality [7]. Usually synthesized as E isomers by an aldol-type condensation reaction of lithiated 2-alkyl-2-oxazolines [8], via a Horner–Wadsworth–Emmons reaction from 2-alkyl-2-oxazolines and diethylchlorophosphate [9], or by other methodologies [10–11], a useful and convenient stereoselective synthesis of cis- and trans-α,β-unsaturated oxazolines based on the addition of lithiated 2-methyl- and 2-chloromethyl-2-oxazolines to a number of nitrones, respectively, has been recently developed by our research group [12–13].
|
|
|
|
R' |
|
|
O− R = Cl |
N |
H |
|
R' |
O |
H |
|
N |
Li |
N + |
||
Bu-t |
(38−70%) |
|||
O |
R |
|
N |
H |
|
|
|
R' |
|
|
|
R = H |
O |
H |
|
|
|
(52−95%) |
|
136 |
Пленарные доклады |
