
Карцев В.Г.Избранные методы с-за и модифик. гетероциклов т.1 , 2003
.pdf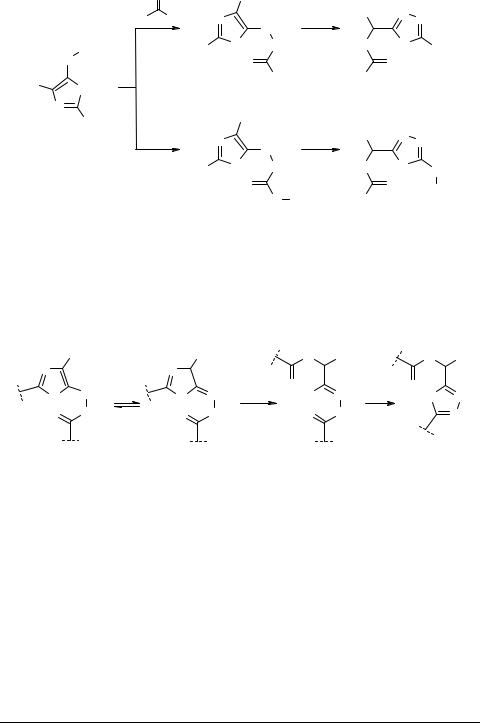
|
|
O |
|
X |
|
EtOH |
|
|
|
|
|
|
|
|
N |
H |
или |
X |
|
N N |
|
|
|
R' Y |
|
AcOH |
|
|
||||
|
|
|
|
O |
N |
∆ |
HN |
|
O |
|
|
HN |
NH2 |
R |
NH |
O |
R' |
||||
|
O |
|
|
|
|
|||||
|
|
|
R' |
|
R |
|
|
|||
X |
|
O |
|
89 |
|
|
91 |
|
||
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
N |
|
|
X |
|
|
|
|
|
|
|
41 R |
|
|
|
|
|
|
|
||
|
|
N |
H |
|
X |
|
N N |
|
||
|
|
R"NCS |
|
|
|
|
||||
|
|
|
R O |
N |
∆ |
|
|
S NH |
||
|
|
|
NH |
HN |
O |
|||||
|
|
|
|
S |
N R'' |
|
R |
|
R'' |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
90 |
|
92 |
|
|||
|
|
|
|
H |
|
|
|
|||
X = CN, CO2Alk, P(O)(OAlk)2
Следует отметить, что даже длительное нагревание субстратов 89 в апротонных растворителях не приводит к образованию соединений 91, которые легко получаются при проведении реакции в этаноле или уксусной кислоте. Это явление хорошо согласуется с такой вероятной последовательностью превращений.
|
X |
|
X |
H |
X |
H |
X |
N |
N |
N |
N |
||||
|
|
HZ O Y |
|
∆ O O N |
|||
O |
NH |
O |
N |
N |
|||
O |
NH |
O |
NH |
O |
NH |
−HZ |
N |
Z = OAlk, OAc и др.
Детальный механизм превращений: (81)→(83) [43, 71], (66)→(87) [43, 80], и (89)→(91) [70, 93] нельзя считать окончательно выясненным, но препаративная ценность указанных процессов не вызывает сомнения. Именно в таких рециклизациях проявляется своеобразие функциональнозамещенных оксазолов, которые существенно отличаются в химическом отношении от подобных производных тиазола и имидазола.
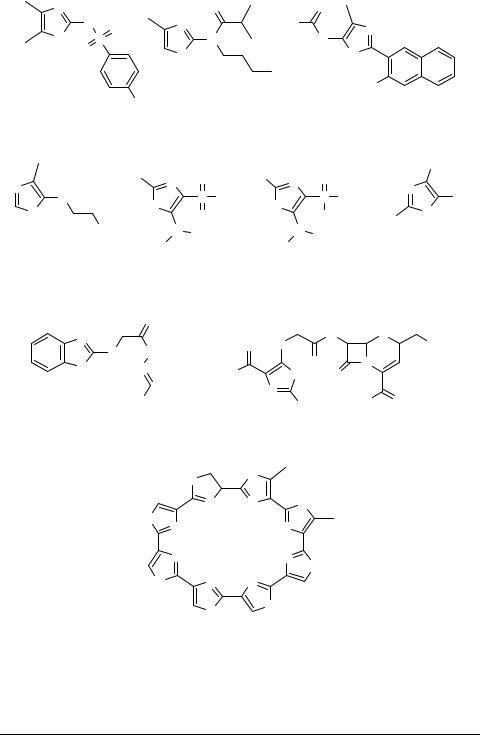
В заключение заметим, что интенсивные исследования новых типов замещенных оксазолов обусловлены не только способностью некоторых из них вступать в реакцию Дильса–Альдера или претерпевать своеобразные рециклизации, но и связаны с поисками эффективных биорегуляторов широкого спектра действия. В настоящее время известно уже более 500 биоактивных производных оксазола синтетического и природного происхождения. Ниже приведены только некоторые несложные по строению биорегуляторы – производные 2- и 5-амино-, а также 2- и 5-меркапто-1,3-оксазолов (см. препараты 93–101).
Генеральный спонсор и организатор – InterBioScreen Ltd. |
67 |
|
N |
H |
|
|
|
|
O |
|
|
O |
|
|
|
|
|
O |
N |
S |
O |
|
N |
N |
|
F3C |
N |
N |
|
|
|
|
O |
|
|
|
|
|
|
|
||||||
|
|
|
|
|
O |
|
|
|
H |
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
HO |
|
|
|
|
93 (антисептик) |
NH2 |
94 (антиастматик) |
|
95 (антиревматик) |
|
||||||||
|
|
|
|
|||||||||||
|
|
|
|
|
Ar N |
O |
R |
|
O |
|
|
CN |
|
|
N |
H |
|
|
|
N |
|
|
N |
|
|||||
|
|
|
|
|
S Ar' |
|
|
P |
OAlk |
|
SR |
|||
|
N |
|
|
|
O |
|
|
O |
Ar O |
|||||
|
O |
|
|
|
|
O |
|
OAlk |
|
|||||
|
|
NO2 |
|
N |
|
N |
|
|||||||
|
|
|
R' |
R |
|
R" |
|
|
|
|
||||
96 (антисептик) |
|
|
|
|
|
R' |
|
|
|
99 (кардио- |
||||
|
|
97 (нейролептики) |
|
98 (цитостатики, |
|
|||||||||
|
|
|
|
|
|
|
|
|
инсектициды) |
|
препараты) |
|||
|
|
N |
|
|
O |
|
|
|
|
H |
S |
|
|
|
|
|
|
S |
NH |
|
|
O |
S |
N |
OAc |
|
|||
|
|
|
|
|
|
O |
|
|
|
|||||
|
|
O |
|
|
|
|
|
N |
|
|
|
|||
|
|
|
|
N |
|
MeO |
|
O |
|
|
|
|||
|
|
|
|
|
|
|
O |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
Ar |
|
|
|
N |
|
HO |
|
O |
|
|
|
|
|
|
|
|
|
R |
|
|
|
|||
|
100 (фунгициды) |
|
|
|
|
|
|
|
|
|||||
|
|
|
|
101 (бактерициды) |
|
|
|
|||||||
|
|
|
|
|
|
|
S |
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
N |
N |
O |
|
|
|
|
|
|
|
|
|
|
N |
|
|
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
N |
|
|
N |
O |
|
|
|
|
|
|
|
|
|
O |
|
N |
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
O O
GM-95 (цитостатик)
Эти и многие другие производные оксазола чаще всего обладают вполне выраженной антимикробной, цитостатической, нейролептической, антивоспалительной, анальгетической или антидиабетической активностью [2, 8, 80, 95–102].
68 |
Пленарные доклады |

Особо укажем на разработанные впервые в нашей лаборатории препаративные синтезы двух интересных типов дифункциональнозамещенных оксазолов 97, 98, включающих уже более 100 отдельных представителей, среди которых удалось найти эффективные нейролептики [99], цитостатики [100] и инсектоакарициды [101]. К тому же, в последние годы из различных бактерий выделен ряд макроциклических антибиотиков оксазольной природы. К ним относится, в частности, хорошо исследованный вирджиниямицин-М [8], а также недавно найденный препарат GM-95 [102], который обладает ярко выраженным антибластическим действием.
Таким образом, в течение последнего двадцатилетия стало очевидным, что среди производных оксазола, которые еще не так давно считались неперспективными для поиска различных биорегуляторов, скрыто значительное количество эффективных фармпрепаратов и пестицидов. Поэтому разработка синтезов новых типов производных оксазола, а также исследование их биологического действия представляет несомненный интерес.
Литература
1.Wiley R.H., Chem. Rev. 1945 37 408.
2.Корнфорт Дж., в кн. Гетероциклические соединения, под ред. Эльдерфильда Р., М.: Издательство иностранной литературы, 1961, т. 5, с. 242.
3.Lakham R., Ternai B., in Advances in Heterocyclic Chemistry, Katritzky A.R., Boulton A.J., Eds., New York: Academic Press, 1974, vol. 17, p. 99.
4.Turchi I.J., Dewar M.J.S., Chem. Rev. 1975 75 385.
5.Пешакова Л.С., Калчева В.Б., Симов Д.А., ХГС 1981 (8) 1011.
6.Иванова С.Н., Мельников Н.Н., Климкина Л.П. и др., в сб. Реакции и методы исследования органических соединений, под ред. Кнунянца И.Л.,
Мельникова Н.Н., Симонова В.Д., М.: Химия, 1983, с. 72.
7.Boyd G.V., in Comprehensive Heterocyclic Chemistry, Potts K.T., Ed., Oxford: Pergamon Press, 1984, vol. 6, p. 177.
8.The Chemistry of Heterocyclic Compounds, Oxazoles, Turchi I.J., Ed., New York: Wiley, 1986, p. 1064.
9.Драч Б.С., ХГС 1989 (6) 723.
10.Драч Б.С., Свиридов Э.П., Кисиленко А.А. и др., ЖОрХ 1973 9 (9) 1818.
11.Драч Б.С., Свиридов Э.П., ЖОрХ 1973 43 (7) 1648.
12.Драч Б.С., Свиридов Э.П., Лавренюк Т.Я., ЖОрХ 1974 10 (6) 1271.
13.Драч Б.С., Долгушина И.Ю., Синица А.Д., ЖОрХ 1973 9 (11) 1973.
14.Драч Б.С., Долгушина И.Ю., Синица А.Д., ХГС 1974 (7) 928.
15.Драч Б.С., Свиридов Э.П., Шатурский Я.П., ЖОХ 1974 44 (8) 1272.
16.Драч Б.С., Свиридов Э.П., Кирсанов А.В., ЖОХ 1975 45 (1) 12.
17.Драч Б.С., Миськевич Г.Н., ЖОрХ 1974 10 (11) 2315.
18.Драч Б.С., Долгушина И.Ю., Синица А.Д., ЖОХ 1975 45 (6) 1251.
19.Драч Б.С., Лобанов О.П., ЖОХ 1974 44 (12) 2779.
20.Драч Б.С., Миськевич Г.Н., Лавренюк Т.Я., ЖОрХ 1976 12 (2) 421.
21.Драч Б.С., Мартынюк А.П., Миськевич Г.Н., ЖОрХ 1976 12 (10) 2238.
Генеральный спонсор и организатор – InterBioScreen Ltd. |
69 |

22.Драч Б.С., Лобанов О.П., ЖОХ 1976 46 (6) 1417.
23.Драч Б.С., Миськевич Г.Н., ЖОрХ 1977 13 (7) 1398.
24.Драч Б.С., Лобанов О.П., ЖОХ 1977 47 (9) 1994.
25.Драч Б.С., Миськевич Г.Н., ЖОрХ 1978 14 (3) 501.
26.Драч Б.С., Миськевич Г.Н., ЖОрХ 1978 14 (3) 508.
27.Драч Б.С., Миськевич Г.Н., ЖОрХ 1978 14 (5) 943.
28.Драч Б.С., Лобанов О.П., ЖОХ 1978 48 (9) 1994.
29.Драч Б.С., Седлов А.И., Миськевич Г.Н., ЖОрХ 1978 14 (9) 1827.
30.Драч Б.С., Лобанов О.П., Мартынюк А.П., ЖОХ 1979 49 (3) 717.
31.Драч Б.С., Лобанов О.П., Ковалев В.А., ДАН Укр. ССР, Сер. Б 1978 (12) 1102.
32.Лобанов О.П., Мартынюк А.П., Драч Б.С., ЖОХ 1980 50 (10) 2248.
33.Лобанов О.П., Драч Б.С., ЖОХ 1980 50 (9) 2142.
34.Лобанов О.П., Драч Б.С., ЖОХ 1982 52 (5) 1122.
35.Виноградова Т.К., Кисиленко А.А., Драч Б.С., ЖОрХ 1982 18 (9) 1864.
36.Броварец В.С., Лобанов О.П., Драч Б.С., ЖОХ 1982 52 (6) 1438.
37.Броварец В.С., Лобанов О.П., Драч Б.С., ЖОХ 1983 53 (3) 660.
38.Броварец В.С., Лобанов О.П., Драч Б.С., ЖОХ 1983 53 (9) 2015.
39.Броварец В.С., Лобанов О.П., Виноградова Т.К. и др., ЖОХ 1984 54 (2) 288.
40.Мартынюк А.П., Броварец В.С., Лобанов О.П. и др., ЖОХ 1984 54 (10) 2186.
41.Лобанов О.П., Броварец В.С., Драч Б.С., ЖОХ 1985 55 (4) 940.
42.Броварец В.С., Драч Б.С., ЖОХ 1986 56 (2) 321.
43.Броварец В.С., Лобанов О.П., Кисиленко А.А., ЖОХ 1986 56 (7) 1492.
44.Червоный В.А., Харченко А.В., Драч Б.С., ЖОpХ 1988 24 (2) 453.
45.Смолий О.Б., Броварец В.С., Драч Б.С., ЖОХ 1988 58 (7) 1670.
46.Виноградова Т.К., Драч Б.С., Кухарь В.П., ДАН Укр. ССР, Сер. Б 1987 (12) 37.
47.Червоный В.А., Зябрев В.С., Харченко А.В. и др., ЖОрХ 1989 (12) 2597.
48.Степко О.П., Броварец В.С., Кург В.В., ДАН Укр. ССР, Сер. Б 1989 (3) 60.
49.Виноградова Т.К., Туров В.В., Драч Б.С., ЖОрХ 1990 26 (6) 1302.
50.Сеферов С.О., Харченко О.В., Драч Б.С., ДАН Укр. CСР, Сер. Б 1990 (7) 59.
51.Броварец В.С., Выджак Р.Н., Драч Б.С., ЖОХ 1991 61 (5) 1264.
52.Руденко Е.А., Сеферов С.О., Червоный В.А., Укр. хим. журн. 1991 57 (5) 530.
53.Червоный В.А., Харченко А.В., Драч Б.С., Укр. хим. журн. 1991 57 (4) 415.
54.Харченко А.В., Сеферов С.О., Зябрев В.С., Укр. хим. журн. 1993 59 (6) 637.
55.Броварец В.С., Выджак Р.Н., Драч Б.С., ЖОХ 1993 63 (1) 80.
56.Броварец В.С., Выджак Р.Н., Виноградова Т.К. и др., ЖОХ 1993 63 (1) 87.
57.Броварец В.С., Выджак Р.Н., Виноградова Т.К. и др., ЖОХ 1994 64 (6) 1048.
58.Van Meervelt L., Schuerman G., Brovarets V.S., Tetrahedron 1995 51 (5) 1471.
59.Смолий О.Б., Панчишин С.Я., Будник П.В. и др., ЖОХ 1997 67 (3) 391.
60.Броварец В.С., ЖОХ 1998 68 (1) 167.
61.Броварец В.С., Пильо С.Г., Романенко Е.А. и др., ЖОХ 1998 68 (2) 347.
62.Харченко О.В., Доп. НАН України 1999 (1) 161.
63.Харченко О.В., Доп. НАН України 1998 (12) 152.
64.Броварец В.С., Пильо С.Г., Чернега А.Н. и др., ЖОХ 1999 69 (10) 1646.
65.Смолий О.Б., Панчишин С.Я., Романенко Е.А. и др., ЖОХ 1999 69 (10) 1652.
66.Выджак Р.Н., Броварец В.С., Пильо С.Г. и др., ЖОХ 2002 72 (2) 226.
67.Броварец В.С., Выджак Р.Н., Пильо С.Г. и др., ЖОХ 2001 71 (11) 1822.
68.Пильо С.Г., Броварец В.С., Романенко Е.А. и др., ЖОХ 2002 72 (11) 1828.
70 |
Пленарные доклады |

69.Бабий С.Б., Зябрев В.С., Драч Б.С. и др., ЖОрХ 2001 37 (8) 1208.
70.Броварец В.С., Пильо С.Г., Попович Т.П. и др., ЖОХ 2001 71 (11) 1930.
71.Пильо С.Г., Броварец В.С., Виноградова Т.К. и др., ЖОХ 2002 72 (11) 1818.
72.Драч Б.С., Броварец В.С., Смолий О.Б., ЖОХ 2002 72 (11) 1764.
73.Выджак Р.Н., Броварец В.С., Виноградова Т.К. и др., Тез. XVIII-ой Укр. конф.
по органической химии, Днепропетровск, 1998, с. 83.
74.Драч Б.С., Броварец В.С., Виноградова Т.К. и др., Тез. междунар. конф. "Химия азотсодержащих гетероциклов", Харьков, 2000, с. 10.
75.Броварец В.С., Смолий О.Б., Зябрев В.С. и др., Тез. 1-ой Всерос. конф. по химии гетероциклов, Суздаль, 2000, с. 113.
76.Пильо С.Г., Броварец В.С., Выджак Р.Н. и др., Тез. 1-ой Всерос. конф. по химии гетероциклов, Суздаль, 2000, с. 315.
77.Белюга А.Г., Выджак Р.Н., Харченко А.В. и др., в кн. Азотистые гетероциклы и алкалоиды, под ред. Карцева В.Г., Толстикова Г.А., М.: Иридиум-
Пресс, 2001, т. 2, с. 39.
78.Пильо С.Г., Броварец В.С., Виноградова Т.К., Тез. XIX-ой Укр. конф.
по органической химии, Львов, 2001, с. 457.
79.Головченко А.В., Броварец В.С., Пильо С.Г. и др., Тез. междунар. симпо-
зиума, посвященного 100-летию академика А.В. Кирсанова, Киев, 2002, с. 80.
80.Броварец В.С., Синтезы биорегуляторов гетероциклической природы на основе ациламинозамещенных винилфосфониевых солей и их аналогов,
Дисс. д-ра хим. наук, Киев: ИБОНХ, 1999.
81.Харченко А.В., Применение S-амидоалкилирования в синтезах функциональных производных азотистых гетероциклов, Дисс. д-ра хим. наук, Днепропетровск: ДХТУ, 1999.
82.Панчишин С.Я., Фосфониевые илиды с азотсодержащими группами – перспективные реагенты для гетероциклизаций, Дисс. канд. хим. наук, Киев: ИБОНХ, 2001.
83.Пильо С.Г., Синтезы новых производных азолов на основе 2-ациламино- 3,3-дихлоракрилонитрилов и их аналогов, Дисс. канд. хим. наук, Киев: ИБОНХ, 2002.
84.Бабий С.Б., Новые превращения α-арилсульфонилзамещенных енамидов и родственных реагентов в производные азотистых гетероциклов, Дисс. канд. хим. наук, Киев: ИБОНХ, 2003.
85.Драч Б.С., Броварец В.С., Смолий О.Б., Синтезы азотсодержащих гетероциклических соединений на основе амидоалкилирующих агентов,
Киев: Наукова думка, 1992.
86.Pfleger R., Strandtmann M., Chem. Ber. 1957 90 (8) 1455.
87.Кильдишева О.В., Линькова М.Г., Кнунянц И.Л., Изв. АН СССР, Сер. хим.
1958 (11) 1348.
88.Matsumura K., Saraie T., Hashimoto N., Chem. Pharm. Bull. 1976 24 (5) 924.
89.Matsumura K., Shimadzu H., Miyashita O., Chem. Pharm. Bull. 1976 24 (5) 941.
90.Scheidecker S., Köckritz A., Schnell M., J. Prakt. Chem. 1990 332 (6) 968.
91.Matsumura K., Miyashita O., Shimadzu H., Chem. Pharm. Bull. 1976 24 (5) 948.
92.Драч Б.С., Броварец В.С., Смолий О.Б., в кн. Азотистые гетероциклы и алкалоиды, под ред. Карцева В.Г., Толстикова Г.А., М.: Иридиум-Пресс, 2001,
т. 1, с. 69.
Генеральный спонсор и организатор – InterBioScreen Ltd. |
71 |

93.Пильо С.Г., Броварец В.С., Виноградова Т.К. и др., ЖОХ 2001 71 (2) 310.
94.Boulton A.J., Katritzky A.R., Hamid A.M., J. Chem. Soc. C 1967 (20) 2005.
95.Negwer M., Organic-Chemical Drugs and their Synonyms, Berlin: Acad. Verl., 1994, vol. 1–4.
96.Патратий В.К., Синченко В.Г., Проданчук Н.Г. и др., Микробиол. журн. 1989
51 (3) 48.
97.Derwent World Drug Index, 1996.
98.Derwent World Drug Index, 1998.
99.Greiner H., Bartoszyk G., Boettcher H., et al., Ger. Appl. DE-858 593, 1998.
100.Броварец В.С., Шарыкина Н.И., Кудрявцева И.Г. и др., Патент Украины 17 144,
Бюлл. Укр. 1997 (5).
101.Протопопова Г.В., Дзюбан А.Д., Нестеренко Н.И., А. c. СССР 488 527, 1975.
102.Seto H., Shin-Ya K., Заявка Японии JP-302 634, 1998.
72 |
Пленарные доклады |

Компьютерные подходы к конструированию лекарств
Зефиров Н.С., Палюлин В.А.
Московский государственный университет им. М.В. Ломоносова 119899, Москва, Ленинские горы
Создание новых лекарств – сложный, многостадийный процесс, занимающий 12–15 лет и требующий значительных вложений средств. Привлечение методов компьютерного молекулярного моделирования и QSAR (quantitative structure-acti- vity relationships) на первых этапах этого процесса может позволить сократить сроки разработки лекарств на 1–3 года.
Существуют различные подходы к компьютерному конструированию лекарств. В тех случаях, когда имеется информация о пространственном строении необходимой биомишени (как правило, белковой молекулы), применяются методы прямого конструирования (structure-based). Эти методы можно подразделить на две большие группы – виртуальный скрининг в молекулярных базах данных и виртуальное конструирование лигандов (de novo дизайн). При отсутствии информации о строении биомишени и наличии данных о необходимой биоактивности для серии соединений используются методы непрямого поиска, главным образом QSAR. Рассмотрим подробнее перечисленные подходы.
В настоящее время в общедоступных базах данных имеются координаты атомов, полученные методами рентгеноструктурного анализа или ЯМР, для тысяч белков, многие из которых могут служить в качестве биомишеней при разработке новых лекарств. Однако для большинства белков известна лишь аминокислотная последовательность и иногда данные точечного мутагенеза, указывающие на амиинокислоты, важные для связывания определенных лигандов. В последнем случае часто оказывается возможным построение пространственной модели белка–био- мишени, например, по гомологии с белками, для которых известна пространственная структура. Информация же о точечных мутациях, влияющих на связывание лигандов, помогает определить сайт связывания таких лигандов. При наличии гомологии выше 70% моделирование обычно не представляет больших трудностей; при гомологии менее 30–40% могут возникать существенные проблемы с точностью модели и рекомендуется применять более усовершенствованные методы, например "метод протягивания нити". Но и при невысокой гомологии часто возможно достаточно неплохое моделирование сайта связывания лигандов (который обычно является более консервативным и для которого "локальная" гомология может оказаться достаточно высокой), а наибольшие ошибки возникают при моделировании петельных областей, как правило, достаточно удаленных от сайта связывания лигандов.
Виртуальный скрининг в молекулярных базах данных включает следующие этапы: (1) подготовка модели биомишени – расстановка зарядов на атомах, расчет молекулярных поверхностей; (2) подготовка баз данных структур органических соединений – (а) удаление противоионов, протонирование и депротонирование в соответствии с физиологическим pH, расчет физико-химических свойств, (б) моделирование пространственной структуры в базах данных, расчет зарядов на атомах;
Генеральный спонсор и организатор – InterBioScreen Ltd. |
73 |

(3) препроцессинг баз данных – удаление структур по критериям, основанным на допустимых значениях оценок физико-химических свойств, в частности липофильности, допустимому интервалу молекулярной массы, по количеству доноров и акцепторов водородной связи, по предсказанной токсичности и т.д.; (4) молекулярный докинг структур из баз данных в модель биомишени с помощью программ, основанных на оценочных функциях (scoring functions) и отбор потенциальных лигандов; (5) постпроцессинг сформированных баз потенциальных лигандов с помощью моделей QSAR. В результате мы получаем сфокусированную библиотеку потенциальных лигандов для данной биомишени. Следует отметить, что проблема разработки достаточно универсальных и надежно работающих оценочных функций (позволяющих оценить взаимодействие молекулы–лиганда с биомишенью в процессе молекулярного докинга) до сих пор остается нерешенной, однако для каждой из биомишеней возможна дополнительная "адаптация" таких функций, позволяющая существенно повысить надежность результатов докинга.
Методы виртуального конструирования лигандов (de novo дизайн) можно подразделить на две группы – (1) методы наращивания темплата в модели сайта связывания биомишени для улучшения взаимодействия потенциального лиганда с биомишению и (2) методы, основанные на объединении фрагментов потенциального лиганда, важных для связывания с биомишенью и расположенных в "ключевых" точках биомишени.
Методы непрямого поиска, как правило, основаны на методологии QSAR, причем в последнее десятилетие большие успехи достигнуты при использовании трехмерных подходов, основанных на картировании биомишени путем определения формы места связывания лиганда на основе структур лигандов и количественных или качественных данных о связывании для известных лигандов. К таким методам в первую очередь относится CoMFA (метод сравнительного анализа молекулярного поля), важное значение приобретает метод CoMSIA (метод сравнительного анализа индексов молекулярного сходства).
Весьма эффективными оказались подходы, сочетающие применение методов 3D QSAR и молекулярного моделирования биомишени: построенные с помощью 3D QSAR карты электростатических и стерических полей могут быть совмещены с моделью биомишени и сопоставлены с ее строением. Такие подходы позволяют сделать более надежные выводы и строении биомишени и характере связывания с ней лигандов, поскольку основаны на сопоставлении результатов, полученных двумя независимыми методами.
Несмотря на широкое применение перечисленных выше методов не потеряли своего значения и топологические подходы к QSAR, в частности основанные на анализе фрагментного состава лигандов. Хорошие результаты дают методы, базирующиеся на топологическом совмещении структур лигандов с известной биоактивностью, построении молекулярного суперграфа и анализе связи биоактивности с локальными (атомными) параметрами (например, метод MFTA).
В докладе обсуждается применение перечисленных методов для дизайна новых кислород- и серусодержащих физиологически активных гетероциклических соединений.
74 |
Пленарные доклады |

"Неприродные" природные гетероциклы.
Химия и биологическая активность необычных кислород- и серусодержащих вторичных метаболитов
Карцев В.Г.
InterBioScreen
119019, Moсква, а/я 218 e-mail: screen@ibscreen.chg.ru
Известно, что природа в течение эволюции за много миллионов лет создала десятки тысяч билогически активных вторичных метаболитов, играющих роль эндогенных биопротекторов и биорегуляторов, многие из которых топологически высоко комплементарны по отношению к целевым рецепторам. Их биологическое действие проявляется, как правило, в малых и сверхмалых дозах. К таким биогенным средствам защиты и регуляции биоценоза относятся, например, фитоалексины (вещества, синтезирующиеся в растениях в ответ на воздействие патогенных микроорганизмов для борьбы с ними), аллелопатические агенты (минорные метаболиты высших растений, уничтожаюшие другие виды растений в окружающем пространстве), фитонциды, микотоксины, цитокинины, ауксины, репелленты и аттрактанты, детерренты, антифиданты, алломоны, кайромоны, ювенильные гормоны, половые феромоны и феромоны тревоги, хемостериллянты, енсибилизаторы и различные факторы устойчивости. Это позволяет рассматривать природные соединения как основу создания фармакологических препаратов и биорегуляторов нового поколения. Вместе с тем, современная наука расшифровала лишь ничтожный процент того, с какой целью те или иные природные соединения созданы природой, какова их роль в биоценозе и гомеостазе живых систем, а многие тысячи вторичных метаболитов, не игравших ключевых ролей в эволюционном развитии, исчезли миллионы лет тому назад и, видимо, структуры их так и останутся тайной природы.
Следуя основному принципу – целесообразности – природа, подчас, создавала и создает поразительные с точки зрения уникальности структур соединения, синтез которых часто кажется невозможным обычными методами органической химии.
С другой стороны, многие вторичные метаболиты имеют структуры, которые выглядят как типичные синтетические молекулы, содержащие "неприродные" функциональные группировки, как, например, трихлоралкильные, галоидфенольные, нитрогетероциклические, нитрильные и даже гидразиновые, оксимные, нитрильные и др. Среди природных соединений встречаются типичные мутагены, целесообразность которых в природе может быть связана с необходимостью поддержания разнообразия видов и эволюционного совершенствования.
Анализ структур известных к настоящему времени более 100000 структур природных соединений обнаруживает наличие среди них почти всех основных классов гетероциклических систем, в том числе, кислород- и серусодержащих: оксиранов, тииранов, оксетанов, оксаланов, дитиоланов, ди- и тритианов, оксазо-
Генеральный спонсор и организатор – InterBioScreen Ltd. |
75 |

лов, тиазолов, оксазинов, тиазинов, оксепинов, тиепинов и многих других, а также их многочисленных коньюгированных производных. Среди наиболее "изобретательных" продуцентов таких необычных "неприродных" природных соединений являются актиномицеты, стрептомицеты и другие микроорганизмы.
Известны природные соединения, содержащие атомы Cl, Br, F, I, B, As, Se, Mo, Fe, Al, V, в том числе входящие в гетероциклические системы.
В докладе подробно обсуждаются химия различных классов необычных кислород- и серусодержащих природных гетероциклов, их биосинтез, биологическая активность и механизмы действия на ключевые ферментные системы. Развивается ранее предложенная автором концепция влияния гетерофункциональных эндо- и экзобиотиков на металло-лигандный гомеостаз живых систем, приводятся наиболее интересные и необычные примеры полного синтеза "неприродных" природных соединений, анализируются подходы к синтезу перспективных миметиков природных соединений, которые могут быть полезны в изыскании новых лекарственных препаратов.
Литература
1.Mann J., Davidson R.S., Hobbs J.B., et al., Natural Products: Their Chemistry and Biological Significance, London: Longman, 1993.
2.Samuelson G., Drugs of Natural Origin, Uppsala: Swedish Pharmaceutical Press, 1999.
3.Ikan R., Natural Products, London: Academic Press, 1991.
4.Pettit G.R., Cragg G.M., Herald C.L., Biosynthetic Products for Cancer Chemotherapy, Amsterdam: Elsevier, 1985, vol. 5.
5.Bailey J.A., Mansfield J.M., Phytoalexins, Glasgow: Blackie, 1982.
6.Harborne J.B., Introduction to Biochemical Ecology, New York: Academic Press, 1977.
7.Bullock J.D., The Biosynthesis of Natural Products, London: McGraw-Hill, 1965.
8.Herout V., in Frontiers of Bioorganic Chemistry and Molecular Biology, Oxford, 1980.
9.Muller-Schwarze D., Silverstein R.M., Chemical Signals: Vertebrates and Aquatic Invertebrates, New York, 1980.
10.Лукнер М., Вторичный метаболизм у микроорганизмов, растений и животных, М.: Мир, 1979.
11.Семенов А.А., Очерк химии природных соединений, Новосибирск:
Наука, 2000.
12.Племенков В.В., Введение в химию природных соединений, Казань, 2001.
76 |
Пленарные доклады |
