
Карцев В.Г.Избранные методы с-за и модифик. гетероциклов т.1 , 2003
.pdf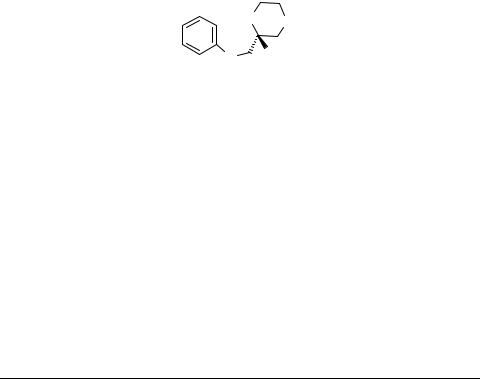
Synthesis, resolution, and absolute configuration of novel tricyclic benzodiazepines
Dyatkin A.B., Matthews J.M., Evangelisto M., Gauthier D., Hecker L.R., Hlasta D.J., Hoekstra W.J., Poulter B.L., Maryanoff B.E.
Johnson & Johnson Pharmaceutical Research & Development, Spring House, Pennsylvania, 19477-0776 USA
tel.: +(215) 628-5008, fax: +(215) 628-4985, e-mail: adyatkin@prdus.jnj.com
Introduction
Benzodiazepines are perceived as "privileged" heterocyclic scaffolds for the genesis of drug candidates because this subunit tends to confer interesting biological activity to molecules. Although the syntheses of a variety of benzodiazepines are well documented, preparations of chiral benzodiazapines 1 are unknown. These compounds are key intermediates for a series of drug candidates under evaluation in our laboratories at this time. From a synthetic standpoint, they represent the first examples of 4-heteroatom substituted benzodiazepines, and hence present several unique challenges.
( )n  N X
N X
( )m
N H H
1
X = O, S; m, n = 0, 1
In this work, we developed a synthetic approach to chiral O- and S-containing benzodiazepines 1 with different size of the side ring.
Preparation of 5,10,11,11a-tetrahydro-1H,3H-thiazolo[2,3-c]- (1a)
and 10,11,11a-tetrahydro-1H,3H-thiazolo[4,3-c]-[1,4]benzodiazepines (1b)
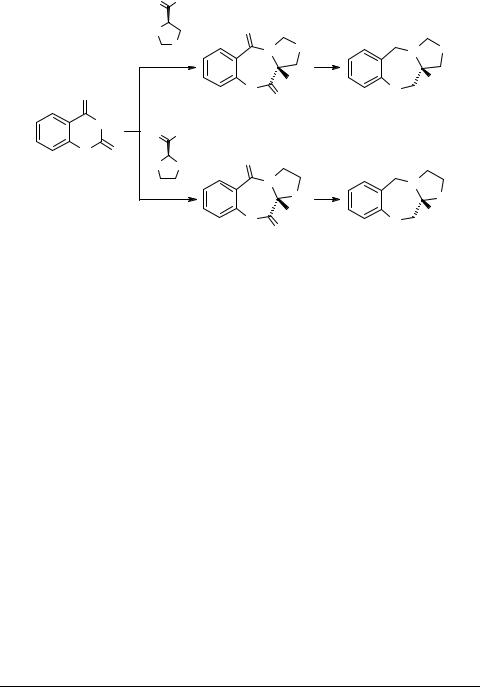
The main synthetic approaches to amino acid-derived tricyclic benzo-diazepinediones are based on acylation of a cyclic amino acid ester with o-nitrobenzoyl chloride followed by tandem reduction–cyclization reaction [1] or on condensation of proline with isatoic anhydride [2]. Previously, Carabateas [2] reported the preparation of 1a in 48% yield by using the former route. Since our attempt to prepare 6 by this method was unsuccessful, we used the latter synthetic approach.
Генеральный спонсор и организатор – InterBioScreen Ltd. |
237 |
Scheme 1
|
O |
OH |
|
|
|
|
|
HN |
S |
O |
S |
|
|
|
|
N |
N |
S |
||
|
|
3 |
||||
|
|
|
|
|
|
|
O |
|
|
N |
H |
N |
H |
|
|
O |
|
|||
|
|
H |
H |
|
||
|
O |
|
4 |
|
1a |
|
|
OH |
|
|
|
|
|
|
O |
|
|
|
|
|
N |
O |
|
O |
|
|
|
H |
HN |
S |
|
|
|
|
2 |
|
5 |
N |
S |
N |
S |
|
|
|
|
|||
|
|
|
|
|
||
|
|
|
N |
H |
N |
H |
|
|
|
H |
O |
H |
|
|
|
|
6 |
|
1b |
|
One challenge in the synthesis of benzodiazepinediones 4 and 6 is the acid sensitivity of the starting materials and final products. To overcome this difficulty, we performed the condensation in a 4 : 1 mixture of dimethylformamide (DMF) and triethylamine (TEA). We found that heating a 1 : 1 mixture of isatoic anhydride and thiazolidinecarboxylic acids 3 and 5 in DMF–TEA affords moderate yields (50–60%) of benzodiazepinone 4 or 6, respectively, in a simple reaction work-up (Scheme 1). Our attempts to perform this reaction in either DMF or pyridine resulted in a mixture of products. Benzodiazepinediones 4 and 6 were reduced to corresponding amines 1a and 1b in good yields with lithium aluminum hydride in THF at 0°C.
Starting with chiral 3 and 5, enantiomerically pure 4 and 6 were prepared. Substituted isatoic anhydrides (like 5-chloroisatoic anhydride) produced tricyclic benzodiazepinediones with approximately the same yield as that obtained with 1. Our attempts to prepare derivatives of 2,2-dimethylthiazolidine-4-carboxylic acid were unsuccessful.
Synthesis and resolution of thiazino- (1c) and oxazinobenzodiazepines (1d)
For preparation of benzodiazepinones 1c and 1d we used alternative approach. We decided to start from racemic amino acids and use classical resolution technique on the last step.
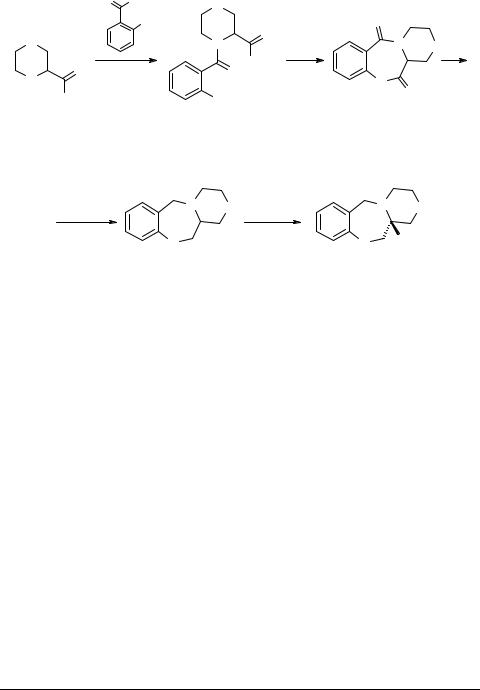
Racemic ethyl thiomorpholine carboxylate 7 and racemic morpholino amino ester 8 were prepared according to literature procedure [3, 4]. As shown in Scheme 2, acylation of amino esters with 2-nitrobenzoyl chloride provided amides 9 and 10 which were subsequently cyclized to lactams 11 and 12 using iron-mediated conditions. Hydride reducetion of lactams afforded racemic benzodiazepines 13 and 14.
238 |
Устные доклады |
Scheme 2
|
|
O Cl |
X |
|
|
|
|
|
|
|
O |
|
|
|
|
NO2 |
|
O |
|
|
X |
|
|
N |
Fe |
N X |
|
|
|
|
||||
N |
O |
CH2Cl2 |
O OMe |
AcOH |
|
|
|
Et3N |
|
|
N |
O |
|
H |
OMe |
|
NO2 |
|
H |
|
|
|
|
|
|
||
7, 8 |
|
|
9, 10 |
|
11 (53%), 12 (89%) |
|
|
|
|
(68−78%) |
|
|
|
LiAlH4 |
N X resolution |
N |
X |
THF, 65°C |
N |
N |
H |
|
|||
|
H |
H |
|
|
13 (75%), 14 (89%) |
1c, 1d |
|
|
7, 9, 11, 13, 1c X = S; |
|
|
|
8, 10, 12, 14, 1d X = O |
|
|
A 6 × 8 screening matrix was employed to identify the resolving agent/solvent candidates necessary to provide single enantiomers 1c and 1d. Individual crystals were filtered and treated with aqueous base to separate the single enantiomer from the resolving agent. For each benzodiazepine, only one chiral acid and solvent mixture resulted in crystals of single enantiomers with the desired enantiomeric excess (ee). In turn, the enantiopods of 13 and 14 were obtained by crystallization with the opposite chiral salt. Analysis of each benzodiazepine by 1H NMR, using (S)-(+)-2,2,2-trifluoro-1-(9-anthryl)- ethanol ("Pirkle solvent") [5] determined an initial enantiomeric excess. The resolution of 13 was accomplished using dibenzoyl-D-tartaric acid in ethanol to provide compound 1c in 48% yield with 100% ee. Compound 14 was resolved through co-crystallization with (R)-(–)binaphthyl-2-2’-diyl hydrogen phosphate salt; compound 1d was obtained in 35% yield and 98.3% ee through fractional crystallization of di-p-toluoyl-D-tartrate salt in a methanol–ether co-solvent. It should be noted that the high enantiopurities were obtained after a single crystallization, and when needed could be crystallized second times to obtain 100% ee. Chiral high performance liquid chromatography method complements the Pirkle-solvent 1H-NMR study, and compounds 1c and 1d were found to be 100% ee . Enantiopurities were determined using a Hewlett Packard 1100 system (Chiralcel AS column 0.46 × 25 cm), mobile phase 85 : 15 hexane–isopropanol containing 0.1% diethylamine, with detection at 254 nm. The signs and values of optical rotation confirms the results of chiral resolution.
Генеральный спонсор и организатор – InterBioScreen Ltd. |
239 |

Determination of the absolute configuration of thiazino- (1c) and oxazinobenzodiazepines (1d)
The absolute configuration of chiral 1c was achieved by X-ray method. We obtained the ORTEP plot of the molecular structure of compound 1c with R-binapthyl-2,2'-diyl hydrogen phosphate. Interestingly, two equivalents of the chiral salt coordinated with each basic nitrogen of 1c provide a slightly puckered crystal structure. The absolute configuration of compound 1c was determined to be of the S configuration.
We attempted to determine the absolute configuration of the resolved material 1d by X-ray methods, but were unsuccessful. Therefore, we decided to employ vibrational circular dichroism (VCD) spectroscopy [6, 7] in order to determine absolute configuration in chiral molecules of medium size. Two key developments have contributed to the practicality of VCD: (1) the widespread availability of instrumentation for the measurement of high-quality VCD spectra and (2) the availability of software for the calculation of VCD intensities by using ab initio quantum chemistry. From our VCD study of free based (+)-1d, we have assigned the configuration at the asymmetric carbon as S. Moreover, we have established the most abundant conformation of 1d in CDCl3 solution.
References
1.Carabateas P.M., US Patent 3 860 600, Chem. Abstr. 1975 83 58892.
2.Carabateas P.M., US Patent 3 732 212, Chem. Abstr. 1973 79 42570.
3.Larsson U., Carlson R., Acta Chem. Scand. 1994 48 517.
4.Kogami Y., Okawa K., Bull. Chem. Soc. Jpn. 1987 60 2963.
5.Rothchild R., Enantiomer 2000 5 457.
6.Nafie L.A., J. Mol. Struct. 1995 347 83.
7.Nafie L.A., Freedman T.B., in Infrared and Raman Spectroscopy of Biological Materials, Yan B., Gremlish H.-U., Eds., New York: Marcel Dekker, 2001, p. 15.
240 |
Устные доклады |

Активированные алкоксиэтилены в синтезе биологически активных производных пиридина и хинолина
Дяченко В.Д., Ткачев Р.П.
Луганский государственный педагогический университет им. Тараса Шевченко 91011, Украина, Луганск, ул. Оборонная, 2
Функциональнозамещенные алкоксиэтилены (АОЭ) являются исключительно активными органическими субстратами, на основе которых синтезировано значительное количество гетероциклов с широким спектром биологической активности. Благодаря наличию хорошего нуклеофуга – алкоксигруппы, большинство химических свойств рассматриваемых олифинов представлено реакциями нуклеофильного винильного замещения (SNVin). В настоящей работе проанализированы региоселективные пути и выявлены закономерности образования производных пиридина и хинолина (строение алкоксиалкена, тип нуклеофильного реагента, условия реакции). Общая формула рассматриваемых АОЭ AlkOC(R) = C(X)Y, где R = H, Alk; X, Y – электроноакцепторные группы.
При всем разнообразии синтетических подходов к построению пиридинового цикла с использованием АОЭ среди них можно выделить общие черты. Начальная стадия реакции – нуклеофильное винильное замещение алкоксигруппы аминогруппой либо метиленактивным фрагментом. В первом случае практически всегда образуются α-незамещенные пиридины, во втором, в зависимости от набора заместителей у метиленактивного фрагмента, β- или γ-незамещенные пиридины. При использовании в качестве АОЭ алкоксиалкилиден(арилметилен)СН-кислот β- и γ-положения пиридинового ядра будут нести соответствующий алкильный или арильный заместитель.
Синтез хинолинов с использованием АОЭ основан на реакции Гоулда–Дже- кобса, представляющей взаимодействие ароматических аминов по пути SNVin. Полученные этим способом этиловые эфиры хинолин-4-он-3-карбоновых кислот как сами проявляют биологическую активность, так и могут служить полупродуктами синтеза веществ с заданными свойствами. В частности, они показали противомалярийную, противоопухолевую и радиосенсибилизирующую активности. Их физиологически приемлемые производные применяют в лекарственных препаратах (таблетки, капсулы, растворы, суспензии, эмульсии, пасты, мази, гели, кремы) в медицине и ветеринарии.
Доклад сделан по материалам обзора, полный текст которого опубликован: в кн. "Избранные методы синтеза и модификации гетероциклов", под ред.
Карцева В.Г., М.: IBS PRESS, 2003, т. 2, с. 127.
Генеральный спонсор и организатор – InterBioScreen Ltd. |
241 |

Циклизация пропаргильных соединений
Ержанов К.Б., Курманкулов Н.Б., Батырбекова А.Б.
Институт химических наук им. А.Б. Бектурова Министерства образования и науки Республики Казахстан 480100, Алматы, ул. Ш. Уалиханова, 106
Разнообразные по строению функционально замещенные представители соединений с одной или несколькими тройными связями признаны перспективными синтонами в конструировании моно- и полициклических ароматических и гетероароматических систем, а также сложных по строению природных биологически активных веществ.
Одними из доступных групп ацетиленсодержащих промежуточных соединений являются O- и N-пропаргилированные производные моно-, полифенолов и ароматических аминов.
Вначале 60-х годов прошлого века было показано, что арилоксипропины при нагревании (200–230°С) подвергаются перегруппировке Клайзена и превращаются
вбензопираны, а фениламинопропины – в хинолины. Позже было показано, что применение кислот Льюиса значительно снижает температуру перегруппировки и сокращает продолжительность реакции. В эту реакцию были подвергнуты дипропинилбензолы и нафталины, пропинилоксикумарины, флавоны, пиразины, пиридины. В результате были синтезированы соответствующие пирановые и фурановые производные этих ароматических систем. Слудет отметить, что незамещенные в цикле 2(3)-пропинилоксипиридины, пиразины циклизуются с аннелированием атома азота по внутримолекулярной реакции Дильса–Альдера. В зависимости от строения цикла и ацетиленовой части молекулы образуются дигидрофуропиридины, фуропиримидин, пиридинопираны, бензодигидроизофураны.
Вначале 70-х годов 20-столетия была показана способность замещенных пропинилоксибензолов и 1,6-диарилоксибута-2,4-диина к циклизации в условиях реакции Кучерова с образованием бензопиранов и 4,4-бисбензопиранов соответственно. Разными авторами было установлено, что 1-фенокси-4-фенилтиобутин-2 при циклизации образует только бензопираны, а N-(феноксибутинил)анилины циклизуются с образованием индолов или хинолинов.
Внаших работах был синтезирован ряд арилокси- и ариламинопропиниловых спиртов, гликолей, аминобутиниловых производных, содержащих в ароматической части молекулы электродонорные или электроакцепторные заместители, а в пропинильной части – фрагменты алифатических, циклогексановых, аза-, окса-, тиа-, фосфациклических спиртов.
При исследовании способности их к циклизации в условиях реакции Кучерова установлены зависимости, связанные с температурой процесса, концентрацией кислоты и количеством Hg(II). Особо следует отметить, что на направленность превращения Х-арилоксипропиниловых спиртов влияет природа заместителей Х и их количество – электродонорные способствуют циклизации, электроакцепторные – образованию кетонов и (или) гидролизу феноксигруппы. Также отмечено влияние
242 |
Устные доклады |

заместителей пиперидинового кольца и других гетероатомов цикла на эту реакцию: 1-метил-4-феноксипропинилпиперидин-4-ол циклизуется, а в случае 1,2,5-триметил- пиперидола не происходит не только циклизации, но и гидратации тройной связи. На циклизацию Х-фениламинопропиниловых спиртов эти факторы не влияют.
В результате этих работ предложены методы синтеза большой группы бензопиранов, бензодипиранов, нафтопиранов, нафтодипиранов и других систем, содержащих в 4-положении заместители со спиртовыми фрагментами, пиперидиновыми основаниями.
Доклад сделан по материалам обзора, полный текст которого опубликован: в кн. "Избранные методы синтеза и модификации гетероциклов", под ред.
Карцева В.Г., М.: IBS PRESS, 2003, т. 2, с. 149.
Генеральный спонсор и организатор – InterBioScreen Ltd. |
243 |

Химия азакумаринов
Журавель И.А.1, Карасёв А.А.2, Коваленко С.Н.1, Черных В.П.1
1Национальная фармацевтическая академия Украины 61002, Харьков, ул. Пушкинская, 53
2НИИ химии Харьковского Национального университета им. В.Н. Каразина 61077, Харьков, пл. Свободы, 4
Настоящий доклад посвящен анализу работ по синтезу и реакционной способности азааналогов кумарина (азакумаринов), опубликованных за период с 1934 г. по 2000 г. Как следует из публикаций, на современном этапе азакумарины представлены структурами семи типов, в которых одна или две СН-группы замещены на атомы азота. Основная часть исследований посвящена синтезу азакумаринов.
Первый представитель азакумаринов – 7-гидрокси-5-метил-8-азакумарин был синтезирован в 1934 году по реакции Пехмана. При этом конденсация осложнялась множеством побочных реакций и выход конечного продукта составлял всего 8%. К синтезу соединений данного типа вернулись лишь в 70-х годах, когда многие авторы пытались проанализировать течение реакции и подобрать условия ее проведения. Использование в качестве катализатора хлорида цинка позволило значительно повысить выходы, что дало возможность использовать полученные соединения для последующих превращений. Модифицированные таким образом азакумарины предложено использовать как флуоресцентные красители, а азапсоралены – как биологически активные вещества. С этого момента интерес к химии азакумаринов неуклонно растет. Для их получения были использованы новые модификации классических методов построения кумаринового цикла (реакции Пехмана, Перкина, Кневенагеля, Виттига). В качестве исходных соединений предложено использовать гидрокипиридины, производные 4-гидрокихинолина, замещенные барбитуровые и тиобарбитуровые кислоты, азааналоги салицилового альдегида. Однако, вследствии малочисленности возможных исходных веществ и труднодоступность некоторых из них, общее число синтезированных на настоящее время азакумаринов невелико. Кроме того, основный характер исходных веществ во многом изменяет их поведение в реакции и требует внесения определенных корректив в методики: в реакции Пехмана предложено использовать межфазный катализ и микроволновое облучение, конденсацию по Кневенагелю рекомендуют проводить в избытке катализатора или в гетерогенной среде, для реакции гидроксипиридинов с формилпроизводными метиленактивных соединений в качестве растворителя используют уксусную кислоту. В ряде публикаций некоторые конденсации были проведены без растворителя. Позже появился ряд работ, посвященных дальнейшим превращениям азааналогов кумаринов, а изучение механизмов некоторых из них позволило разработать методы получения и препаративного разделения смесей изомерных продуктов. Это дало возможность несколько расширить данный класс соединений и провести систематизацию их свойств.
В последнее время предложен ряд оригинальных рециклизационных превращений, в результате которых получены новые конденсированные системы, кото-
244 |
Устные доклады |

рые можно отнести к азакумаринам. В некоторых случаях такие структуры являются лишь интермедиатами.
Значительное внимание в данном докладе уделено аспектам практического применения полученных веществ (активные среды для лазеров, биологические маркеры, биологически активные вещества), что во многом и объясняет возрастающий интерес к этим соединениям, а также указывает на перспективность данного научного направления.
Доклад сделан по материалам обзора, полный текст которого опубликован: в кн. "Избранные методы синтеза и модификации гетероциклов", под ред.
Карцева В.Г., М.: IBS PRESS, 2003, т. 2, с. 159.
Генеральный спонсор и организатор – InterBioScreen Ltd. |
245 |
Polarized ketene dithioacetals as versatile building blocks for S-containing heterocycles: A new quinoline synthesis
Ila H.
Department of Chemistry, Indian Institute of Technology, Kanpur, 208016 India
1. Introduction
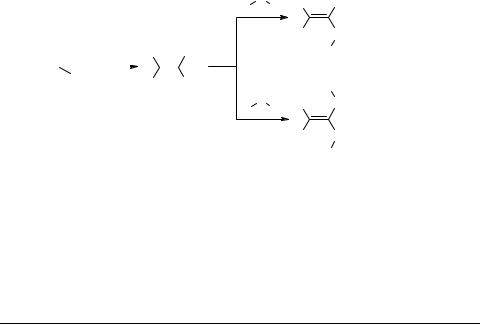
We have been involved for several years in exploring reactivity and synthetic application of polarized ketene dithioacetals of the general structure A (Scheme 1). The easy availability of these intermediates from wide variety of active methylene compounds and their indefinite stability at room temperature makes them attractive building blocks for construction of various fiveand six-membered heterocycles [1]. Besides one of the alkylthio (or both) groups of these compounds can be replaced by various primary and secondary amines to give the corresponding N,S- and N,N-aminals B, C which represent a new class of highly versatile functionalized enamines. We have demonstrated in our earlier work that a large variety of substituted and fused nitrogen, sulfur and oxygen heterocycles with diverse structural features and functionalities are accessible from these N,S- and N,N-acetals through tuning their reactivity pattern by a choice of various amines, active methylene compounds as well as other reactive partners [1].
Scheme 1
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R' |
N R'' |
X |
SR |
|
B |
|
|
|
|
|
|
|
|
|
|
1 equiv |
|
|
|
|
||
|
|
|
|
|
|
|
|
|
Y |
N |
|
R'' N,S-acetal |
|||
Y |
1. B:/CS2 |
|
|
|
|
|
|
|
|
||||||
X |
SR |
|
|
|
R' |
|
|
||||||||
|
|
2. RI |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
X |
|
|
|
|
|
|
SR |
|
|
|
|
|
|
|
|
|
|
Y |
|
H |
|
R' |
|
|
||||||
X = EWG, |
|
|
|
|
|||||||||||
|
|
A |
|
|
|
|
|
|
|
||||||
Y = H |
|
|
X = Y = EWG |
R' |
N R'' |
X |
N |
|
R" |
C |
|||||
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
2 equiv |
|
|
|
|
||
|
|
|
|
|
|
|
|
|
Y |
N |
|
R" |
N,N-acetal |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
R'
In the present lecture, a versatile synthesis of 2-methythio-3-aroylquinolines and their benzo and hetero fused analogs will be presented involving reaction of these α-oxo- ketene-N,S-acetals with Vilsmeier reagents [2]. Required α-oxoketene arylamino acetals 1 were prepared by modification of our previously reported procedure by displacement of one of the methythio groups of corresponding α-oxoketene dithioacetals by appropriate aniline in the presence of n-BuLi in THF [3]. The Vilsmeier cyclization of N,S-anilino- acetals 1a–d bearing a strongly activating group (i.e., methoxy group) was found to afford corresponding 2-methylthio-3-aroylquinolines 2 in overall high yields (Table 1).
246 |
Устные доклады |
