
Карцев В.Г.Избранные методы с-за и модифик. гетероциклов т.1 , 2003
.pdf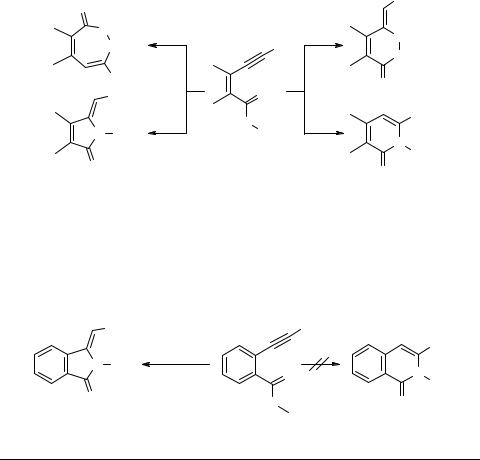
Предположение о том, что кросс-сочетание карбоксииод-бензолов или -пира- золов представляет собой двухстадийный процесс, ранее не высказывалось [9]. Мы нашли, что 4-ацетиленил-1-метилпиразол-5-карбоновые кислоты 21а–d (схема 7), независимо от строения ацетиленового заместителя, полностью реагируют в течение 20 мин в пиридине при 110–115°C в присутствии каталитических количеств PhC≡CCu, образуя пиранопиразолы 22a–d с выходом 62–84%. Циклоконденсация кислоты 23 с PhC≡CCu в аналогичных условиях заканчивается только через 1–5 часов (выход 65%). Это доказывает, что лимитирующей стадией процесса является реакция ацетиленирования.
Нас заинтересовала возможность проведения аналогичных реакций циклизации с заменой карбоксигруппы на остаток гидроксамовой кислоты, поскольку виц-этиниларилгидроксамовые кислоты содержат два различных нуклеофильных центра в гидроксиламиногруппе и C≡C связь, которая может быть центром атаки как N, так и O атомов. Можно было ожидать не менее 4-х направлений гетероциклизации (схема 8).
Схема 8
O |
|
|
R |
|
|
|
|
H |
|
|
|
N |
|
R |
O |
O |
|
||
|
NH |
||
|
|
|
|
R |
|
O |
O |
R |
|
||
|
|
||
|
HN |
|
R |
N OH |
OH |
N OH |
|
O |
|
|
|
|
|
O |
|
|
|
|
Изучение правил гетероциклизации виц-ацетилениларилгидроксамовых кислот и виц-ацетиленилпиразолилгидроксамовых кислот показало некоторые различия и особенности этого процесса [13, 14].
Нагревание метиловых эфиров этинилбензойных кислот 24а–с (R = Ph, CH2OH, CH(Me)OH) с гидроксиламином приводит (схема 9) к соответствующим изоиндолонам 25а–с (выход 60–65%).
|
|
|
|
Схема 9 |
|
R |
R |
|
|
|
NH2OH |
|
|
R |
|
|
|
|
|
|
N OH |
O |
N |
|
|
KOH, 65°C |
OH |
||
|
O |
|
|
|
25a−c |
O |
O |
|
|
24a−c |
|
|
||
R = Ph (a), CH 2OH (b), CH(Me)OH (c) |
|
|
|
|
Генеральный спонсор и организатор – InterBioScreen Ltd. |
|
197 |
||
R |
|
R |
|
|
|
|
NH2OH |
R |
|
N OH |
|
|
||
O |
KOH, 65°C |
N OH |
||
O |
||||
O |
|
O |
||
|
26a, b |
|
27a, b |
|
R = Bu (a), α-фурил (b) |
|
|
|
Их строения были доказаны методом РСА. С другой стороны, взаимодействие n-бутилэтинил- и фурилэтинилзамещенных эфиров 24d, e с гидроксиламином в тех же условиях привело к производным изохинолона 26d, e (выход 86 и 72%, соответственно) [14].
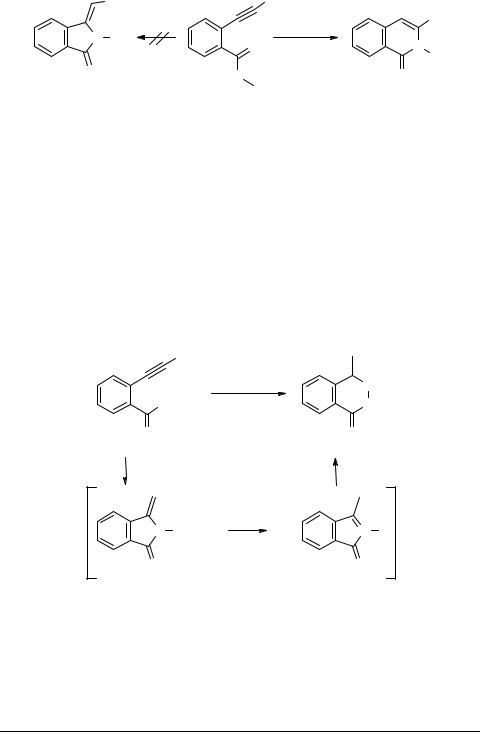
Неожиданно при аналогичной реакции силилированного алкина 28 (схема 10) в качестве единственного продукта был выделен бензоазинин 29 (64%), идентичный образцу, синтезированному по описанной методике из 2-ацетилбензойной кислоты [15, 16]. По всей вероятности первично образующийся десилилированный метиленгидроксиизоиндалон 30 через стадию N-оксида метилизоиндолона 31 перегруппировывается в более устойчивый азинин 29. Эти интересные результаты стимулировали нас изучить поведение виц-ацетиленилпиразолгидроксамовых кислот.
Схема 10
SiMe3
NH2OH |
NH |
OMe KOH, MeOH |
O |
65°C |
O |
O |
|
28 |
29 |
N OH |
+ |
− |
N O |
||
O |
O |
|
30 |
31 |
|
Гидроксамовая кислота 33 была получена кипячением метилового эфира 32 с избытком гидроксиламина в метаноле с выходом 90% (схема 11). Циклизация гидроксамовой кислоты 33 протекает при 4-х часовом нагревании в присутствии триэтиламина в бутаноле и приводит к N-гидроксипиразолоизохинолону 34 с выходом около 50% [14], что, вероятно, объясняется большей нуклеофильностью атома азота по сравнению с атомом кислорода.
198 |
Устные доклады |

Схема 11
|
Ph |
|
Ph |
|
|
|
|
NH2OH |
|
H |
Et3N |
Ph |
|
|
N N |
|
N |
|||
N N |
|
|
HO N |
|||
OMe MeOH |
N OH BuOH |
N |
||||
|
O |
|
O |
|
|
O |
32 |
|
|
33 |
|
|
34 |
Работа выполнена при поддержке РФФИ (гранты № 02-03-32265, № 02-03-32229), CRDF REC-008, грантом "Интеграция" СО РАН, АЦКП СО РАН № 00-03-40135.
Литература
1.Vasilevsky S.F., Tretyakov E.V., Liebigs Ann. Chem. 1995 775.
2.Sakamoto T., Kondo Y., Yamanaka M., Heterocycles 1988 27 2225.
3.Vasilevsky S.F., Tretyakov E.V., Elguero J., Adv. Heterocycl. Chem. 2002 82 1.
4.Sonogashiura K., Tohda Y., Hagihara N.A., Tetrahedron Lett. 1975 50 4457.
5.Brandsma L., Vasilevsky S.F., Verkruijsse H.D., Application of Transition Metal Catalysts in Organic Synthesis, Heidelberg: Springer-Verlag, 1998, p. 335.
6.Castro C.E., Gaughan E.G., Owsley D.C., J. Org. Chem. 1968 31 4071.
7.Castro C.E., Halvin R., Hanwad V.K., J. Chem. Soc. 1969 91 6464.
8.Василевский С.Ф., Синтез и свойства функционльнозамещенных ацетиленовых производных ароматических пятичленных азотистых гетероциклов, Дисс. д-ра хим. наук, Новосибирск: ИХКиГ, 1986.
9.Шварцберг М.С., Василевский С.Ф., Aнисимова T.В., Герасимов В.A.,
Изв. АН СССР, Сер. хим. 1981 1342.
10.Василевский С.Ф., Рубинштейн E.M., Шварцберг М.С., Изв. АН СССР,
Сер. хим. 1978 1175.
11.Василевский С.Ф., Герасимов В.A., Шварцберг М.С., Изв. АН СССР,
Сер. хим. 1981 902.
12.Градберг И.И., Taбак С.В., Боброва Н.Л. и др., ХГС 1965 407.
13.Knight D.W., Lewis P.B.M., Malik A.K.M., et al., Tetrahedron Lett. 2002 43 9187.
14.Vasilevsky S.F., Mshvidobadze E.V., Elguero J., Heterocycles 2002 57 (12) 2255.
15.Gabriel S., Ber. Bunsen-Ges. Phys. Chem. 1883 16 1995.
16.Sudoh Y., Jin Z.-T., Matsumura H., J. Heterocycl. Chem. 1982 19 525.
Генеральный спонсор и организатор – InterBioScreen Ltd. |
199 |
Синтез и биологическая активность β-лактамов – ингибиторов протеаз
Вейнберг Г., Ворона М., Шестакова И., Канепе И., Лукевиц Э.
Институт органического синтеза Латвия LV 1006, Рига, ул. Айзкрауклес, 21
Со времени открытия пенициллина в 1929 г. и до середины 80-х годов интенсивное исследование β-лактамных антибиотиков и родственных им соединений было ориентировано на решение проблем, связанных с улучшением их антибактериальных свойств, основанных на специфическом ингибировании бактериальных энзимов: транспептидазы или β-лактамазы. Их закономерным результатом явилось создание большого числа эффективных препаратов.
Открытие специалистами Merck в 1986 г. в ряду структурных аналогов цефалоспорина ингибиторов эластазы [1] cоздало фармакологические перспективы для соединений, содержащих β-лактамное ядро. Этот фермент является представителем сериновых протеаз, непосредственно функционирующих в организме млекопитающих. Поэтому подавление его активности может быть использовано для лечения воспалительных, иммунологических, респираторных, сердечно-сосудистых, раковых и других заболеваний.
1. Ингибирование Свиной Панкреатической Эластазы (СПЭ)
Проведенные в нашей лаборатории исследования выявили противовоспалительные свойства у структурных аналогов цефалоспорина 1 модифицированных в положениях C(3) и C(7), проявляющих способность ингибировать СПЭ (таблица 1) и интенсифицировать секрецию NO-радикалов макрофагами [2, 3].
Таблица 1. Ингибирующие свойства аналогов цефалоспорина 1 в отношении СПЭ
|
|
|
|
O |
O |
|
|
|
|
X |
S |
|
|
|
|||
|
|
|
|
|
O |
|
|
R |
|
|
|
N |
|
|
|||
|
|
|
||||||
|
O |
|
|
|
|
|||
|
|
|
|
|
||||
|
|
|
O |
OBu-t |
O |
|||
|
|
|
|
|
|
|||
|
|
|
|
|
1 |
|
|
|
X |
|
|
|
R |
|
|
|
IC50, M* |
Cl |
2-AcOC6H4 |
0.25 |
||||||
OMe |
2-AcOC6H4 |
0.11 |
||||||
Cl |
2-(2,6-Cl2C6H3NH)C6H4 |
0.18 |
||||||
200 |
Устные доклады |

Таблица 1. Продолжение
OMe |
2-(2,6-Cl2C6H3NH)C6H4 |
0.11 |
Cl |
BrCH2CH2O |
0.040 |
Cl |
4-O2NC6H4O |
0.047 |
Cl |
СН3 |
0.16** |
*Концентрации, снижающие активность СПЭ на 50%.
**Известное вещество [1] синтезировано для сравнительной оценки ингибирующих свойств новых соединений.
2. Цитотоксическая активность
Определяющая роль протеаз и особенно эластаз в метастазировании и пролиферации раковых клеток [4] свидетельствует о возможности использования ингибиторов этих энзимов в качестве противораковых веществ. Эта гипотеза нашла подтвердение в экспериментах in vitro и in vivo в случае производных сульфонов пенициллина и цефалоспорина 2–4 (таблица 2). Упомянутые соединения 2–4 стимулировали также интенсивную внутриклеточную генерацию NO-радикалов [5–7].
|
|
|
|
|
O O |
|
O |
O |
O |
O |
R |
|
|
|
|
S |
|
R |
S |
Cl |
S |
|
|
|
|
|
||||||
|
|
|
|
|
|
|
N |
OAc |
|
|
|
|
|
|
N |
|
N |
R |
|||
|
|
|
|
|
||||||
|
O |
OBu-t |
O |
|
O |
|
||||
|
|
|
|
|
O |
O |
OBu- t |
O |
OBu- t |
|
|
|
|
|
|
|
|||||
|
2 |
|
3 |
|
4 |
|
||||
|
|
R = t-BuOCO, Ph |
R = t-BuOCO, MeOCO, |
R = H, Br |
||||||
|
|
|
|
|
|
|
MeCO, Ph, 4-NO2C6H4, |
|
|
|
|
|
|
|
|
|
|
4-пиридил, 2-фурил |
|
|
|
Более выраженные противораковые и NO генерирующие свойства были обнаружены у азетидинонов 6–7, полученных (схема 1) расщеплением соответствующих сульфоксидов пенициллина 5 гетероциклическими тиолами [8].
Схема 1
|
|
|
|
|
|
Het |
|
|
|
|
Het |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
S S |
||||||||
R |
|
|
O |
|
|
S S |
|
|
|
|
||||||||
|
|
S |
HSHet |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R |
|
|
|
N |
|
|
|
+ R |
|
|
N |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
N |
|
|
|
|
|
|
|
|
|
|||||||
O |
|
|
|
|
|
|
|
|
|
OR' |
|
|
|
|
OR' |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
5 O |
OR' |
|
|
O |
O |
|
|
O O |
|||||||||
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
6 |
|
|
|
|
7 |
|
|
|||||||
|
R = Cl, 4-NO2C6H4CH, t-BuOCOCH; R' = Bn, t-Bu; |
|
|
|
|
|
||||||||||||
|
Het = 2-бензотиазолил, 1-метилимидазолил |
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Генеральный спонсор и организатор – InterBioScreen Ltd. |
201 |
|||||||||||||||||

Взаимодействие сульфоксидов пенициллина 5 с гетероциклическими тиолами протекает с образованием S-S-группы и отщеплением воды, в которую "уходят" кислород сульфоксида вместе с водородами гетероциклического тиола и одной из метильных групп пенициллина, превращаемой благодаря этому в =CH2-группу в структуре 6 или изомерную структуру в 7.
Таблица 2. Противораковые свойства β-лактамсодержащих веществ [5–8]
|
Соединение |
|
Концентрация (мкг/мл), приводящая к 50% |
|||
|
|
|
|
гибели клеток |
|
|
Nr |
R |
R' |
HT-1080 |
MG-22A |
||
|
|
|
TD50 |
TD50 |
TD50 |
TD50 |
|
|
|
(CV)d |
(MTT)e |
(CV) |
(MTT) |
2 |
(t-BuOCOCH=)a |
t-Bu |
0.5 |
< 0.5 |
5 |
5 |
2 |
(PhCH=)a |
t-Bu |
1.0 |
1.0 |
2.4 |
4.6 |
3 |
(t-BuOCOCH=)a |
t-Bu |
0.17 |
0.31 |
0.37 |
0.73 |
3 |
(4-O2N-C6H4CH=)a |
t-Bu |
< 1 |
< 1 |
0.3 |
0.3 |
4 |
H |
t-Bu |
6 |
2 |
6 |
6 |
4 |
Br |
t-Bu |
2.6 |
0.3 |
1.7 |
3.5 |
5 |
Hb |
Bh |
3.5 |
7 |
6 |
10 |
6 |
Hc |
Bh |
5 |
5 |
6 |
7 |
6 |
Clc |
Bh |
4.5 |
4.0 |
6 |
7 |
7 |
(t-BuOCOCH=)a |
Bh |
0.25 |
0.26 |
0.5 |
0.47 |
7 |
(4-O2N-C6H4CH=)a |
t-Bu |
2.3 |
1.8 |
1.9 |
2.5 |
a Z-изомер; b Het = 2-бензотиазолил, c Het = 1-метилимидазолил, d CV-окрашивание, e MTT-окрашивание.
3. Цефалоспорины двойного действия (ЦДД)
Концепция ЦДД базируется на свойстве цефалоспорина выделять карбоновую или N-замещенную карбаминовую кислоту из 3-ацилоксиметильного фрагмента после расщепления β-лактамного цикла. Прекурсоры такого типа были получены ковалентным связыванием цефалоспорина с антибактериальными (4-хинолон-3-карбо- новые кислоты) или противораковыми (доксорубицин и т.д.) веществами.
Предпринятое нами исследование включало синтез и биологическое изучение противовоспалительных ЦДД, на основе сульфонов трет-бутиловых эфиров 7α-хлор- и 7α-метоксицефалоспорановых кислот (ингибиторы лейкоцитарной эластазы человека), ковалентно связанных с аспирином или диклофенаком (ингибиторы циклооксигеназы). Предполагалось, что такие молекулы будут обладать более выраженным противовоспалительным эффектом по сравнению с образующими их компонентами. Соединения 14, 15 получены, исходя из доступной 7-АДЦК 8 (схема 2) и выделены в 7α-стереоизомерной форме. 7-Метоксицефало- споранат 15b получен в виде неразделимой смеси 7α- и 7β-изомеров в соотно-
шении 3 : 1 [5].
202 |
Устные доклады |
Корректность структурного дизайна ЦДД 14 и 15 подтверждена контролируемым с помощью ВЭЖХ гидролитическим расщеплением в них β-лактамного цикла при 37°C и pH 7.3, сопровождаемым образованием аспирина и диклофенака. Добавление 14, 15 в концентрациях 1–10 мкг/мл к активированным клеткам макрофагов привело к 2.5–3 кратной интенсификации генерирования последними NO-радикалов. В случае неактивированных макрофагов этот эффект не был столь выраженным. Полученные данные свидетельствуют о способности изученных веществ активировать противовоспалительные свойства макрофагов.
H2N
O
N2
O
X
O
S |
H2N |
S |
|
|
a |
|
|
N |
O |
N |
|
CO2H |
R |
||
|
|||
8 |
|
9 (90%) |
O |
O |
O |
O |
|
S |
d(e) |
X |
S |
|
|
|
|
||
N |
|
N |
|
|
R |
|
O |
R |
|
|
|
|||
11 |
|
12a (61%); |
||
|
|
12b (25%) |
||
|
|
g |
|
|
O |
O |
|
X |
|
S |
|
|
||
|
|
|
||
N |
O |
|
O |
|
R |
O |
OAc |
||
|
||||
|
14a (26%); |
|
|
|
|
14b (36%) |
|
|
|
R = CO2Bu-t; a X=Cl, b X=OMe
Схема 2
O |
|
O |
H2N |
S |
c |
b |
|
N
O
R
10 (74%)
O O f X
 S
S
 N
N
O 
 R Br
R Br
13a, b (85−90%)
h
O O  S
S
N O
R OHN
Cl Cl
15a (20%);
15b (16%)
a - AcOBu-t, BF3·Et2O; b - H2O2; c - i-PrONO; d - HCl; e - MeOH; f - NBS, hν ; g - аспирин (Na соль); h - диклофенак (Na соль)
Генеральный спонсор и организатор – InterBioScreen Ltd. |
203 |
Направленный синтез ЦДД 20, содержащих диклофенак, включал трансформацию исходного трет-бутилового эфира сульфона деацетоксицефалоспорина 16 в его 3-гидроксиметильный аналог 18, превращение его в промежуточный карбонат 19 и конденсацию последнего с основанием доксорубицина (схема 3).
Биологическое тестирование этих веществ выявило их более низкую кардиотоксичность по сравнению с доксорубицином на фоне сопоставимой с последним противораковой активности in vitro и in vivo. Полученные данные подтвердили предложенный механизм действия ЦДД, предусматривающий участие протеазы в расщеплении β-лактамного цикла 20 и освобождении доксорубицина.
Схема 3
R' |
O |
O |
O O |
O O |
|
|||
S |
|
R' |
S |
R' |
S |
c |
||
R |
a |
R |
b R |
|||||
|
|
|
||||||
O |
N |
|
N |
Br |
N |
OH |
|
|
|
|
O |
|
O |
|
|
||
|
O |
OBu-t |
O |
OBu-t |
O |
OBu-t |
|
|
|
16a−c |
|
|
|
|
|
|
|
|
|
|
|
|
O |
OH |
|
O |
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
OH |
|
|
|
NO2 |
O |
O |
OH |
O |
O |
|
|
|
|
|||||
R' |
O O |
|
|
R' |
O O |
OH |
||
S |
O |
O |
d |
|
S |
HN O |
||
R |
R |
|
||||||
|
|
|
|
|
|
|||
O |
N |
O |
|
|
O |
N |
|
O |
|
|
|
|
|
|
|
||
|
O |
OBu-t |
|
|
|
O |
OBu- t |
|
|
19a−c |
|
|
|
|
20a−c |
|
|
a R = H, R' = Cl; b R+R' = t-BuOCOCH; c R+R' = 4-NO2C6H4CH
a - NBS, hν; b - CF3CO2NH4, H2O; c - ClOCOC6H4NO2-p; d - доксорубицин
204 |
Устные доклады |

Литература
1.Doherty J.B., Ashe B.M., Argenbright L.W., et al., Nature 1986 322 192.
2.Veinberg G.A., Shestakova I., et al., Bioorg. Med. Chem. Lett. 1997 7 843.
3.Veinberg G., Vorona M., Grigan N., et al., Chem. Heterocycl. Comp. 2000 36 744.
4.Liotta L.A., Roo C.N., Tumor Invasation and Methastasis. New Concepts in Neoplasma as Applied to Diagnostic Pathology, Baltimore: Williams and Wilkins, 1986.
5.Veinberg G.A., Shestakova I., Grigan N., et al., Eur. J. Med. Chem. 1998 33 755.
6.Veinberg G., Bokaldere R., Dikovskaya K., et al., Latv. Patent 12 403, 1998.
7.Veinberg G., Vorona M., Shestakova I., et al., Bioorg. Med. Chem. 2000 8 1033.
8.Veinberg G., Bokaldere R., Dikovskaya K., et al., Chem. Heterocycl. Comp. 1998 34 1266.
Генеральный спонсор и организатор – InterBioScreen Ltd. |
205 |
Карбаматы и их производные в реакциях синтеза кислородсодержащих азагетероциклов
Великородов А.В.
Астраханский государственный университет 414000, Астрахань, пл. Шаумяна, 1
Карбаматы и их полифункциональные производные нашли широкое применение в синтезе разнообразных кислородсодержащих азагетероциклов, в том числе природных соединений. Основные методы синтеза азагетероциклов с использованием карбаматов основаны на реакциях циклоприсоединения и замыкания цикла.
R' |
|
R" |
|
|
|
R' |
R |
||||
|
Ph |
|
|
|
|
|
|
|
|||
|
Ph |
N R" |
|
|
|||||||
|
|
N |
|
|
|
|
|
X |
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|||
|
O |
|
|
|
|
|
|
|
|||
|
|
|
O |
|
|
|
|||||
|
|
|
|
|
7a, b |
|
|
|
|||
|
|
|
|
|
|
|
|
||||
|
X |
|
толуол, ∆ |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
Y |
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
1−3 |
|
|
|
|
Y |
|
|
|
|
|
|
|
|
|
|
|
8a, b |
|
|
|
|
толуол, |
|
|
|||
R' = R" = CHMe2 (a); |
|
|
|
|
|||||||
|
|
|
∆ |
|
|
||||||
R' = CH2CH=CH2, |
|
|
|
|
|
|
|
||||
R" = 4-MeOC6H4 (b) |
|
|
|
|
|
|
|
||||
H
|
|
|
|
Y |
|
|
|
|
X |
Ar |
|
|
|
|
|
|
|
|
|
||
ArCH=NOH |
|
|
4, 5 |
O N |
|
|||||
PhSO2NNaCl, |
|
|
|
|
|
|
|
|
|
|
EtOH, ∆ |
|
|
|
Y |
|
|
|
X |
Ar |
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
||||
|
|
|
|
6 |
O N |
|
||||
|
|
|
|
|
|
|||||
N |
O |
1, 4 |
X = NHCO2, Y = H, R = CH=CH2; |
|||||||
|
2, 5 |
X = O, Y = NHCO2, R = CH=CH2; |
||||||||
|
|
3, 6 |
X = NHCO2, Y = H, R = C≡CH |
|
||||||
9 |
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+
H |
N |
|
H |
N |
|
O O |
Ph |
O O |
Ph |
||
|
|
N |
|
|
N |
10a H |
O |
H |
10b H |
O |
H |
|
|
Хорошо известны реакции [2+3]-циклоприсоединения, приводящие к модификации карбаматной функции в гетерилкарбаматную. Так, взаимодействием О-аллил- и О-пропаргил-N-фенилкарбаматов 1–3 с оксимами аренкарбальдегидов c донорными и акцепторными заместителями в ядре в присутствии PhSO2NNaCl
206 |
Устные доклады |
