
Карцев В.Г.Избранные методы с-за и модифик. гетероциклов т.1 , 2003
.pdf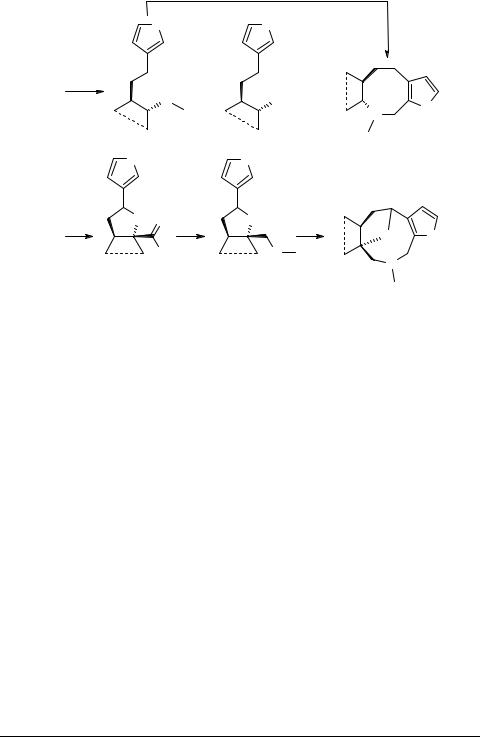
|
|
|
O |
|
|
O |
|
c |
|
68 |
|
|
H |
|
+ |
OH |
|
|
|
|
|
|
N |
|
|
|
N |
O |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
75 |
|
|
|
|
|
76 |
|
|
|
O |
|
|
|
O |
|
|
|
69 |
d |
O |
O |
b |
|
O |
c |
O |
O |
|
|
|
|
||||||
|
|
H |
|
|
N |
|
|||
|
|
|
|
|
|
N |
|
||
|
|
|
|
|
|
H |
|
|
|
|
|
78 |
|
|
|
79 |
|
77 |
|
а - КMnO4−MgSO4, бензол−вода, ТБАБ, 45−50°С;
b- MeNH2−MeOH, 20°С, 18 ч, затем NaBH4;
c- (СН2О)n, СF3CO2H, бензол, 80°С, 15 мин;
d- PСC, CH2Cl2, 20°С, 2 ч
Как видно из приводимой ниже схемы, первичным процессом окисления фуранотерпеноида 56а является гидроксилирование двойной связи, протекающее, с менее экранированной стороны и дающее в качестве интермедиата гликоль 71. Его расщепление приводит к норкетону 68. Параллельно идет С(12)-окисление с образованием триолов 72, 73, спонтанно циклизующихся в оксиды 69, 70. Восстановительное аминирование норкетона с участием CH3NH2 и NaBH4 идет стереоспецифично. Образующийся при этом аминоэфир 74 гладко реагирует с формальдегидом по схеме внутримолекулярной реакции Манниха с образованием азациклооктана 75. Превращение оксида 69 в алкалоид 76 осуществлено окислением в альдегид 77, восстановительным аминированием в амин 78 и последующей циклизацией по Манниху действием CH2O.
Работа выполнена при финансовой поддержке проекта РФФИ (грант № 03-03- 33093).
Литература
1.Семенов А.А., Очерк химии природных соединений, Новосибирск: Наука, 2000, c. 664.
2.Warindee P., Wolfender J.-L., Lackavanne J.-B., Chimia 2000 54 (7–8) 443.
3.Kittakoop P., Wanasith S., Watts P., et al., J. Nat. Prod. 2001 64 (3) 385.
4.Tаnaka J., Marriott G., Higa T., Higa T., J. Nat. Prod. 2001 64 (11) 1468.
Генеральный спонсор и организатор – InterBioScreen Ltd. |
117 |

5.Kagawa K., Tokura K., Uchida K., et al., Chem. Pharm. Bull. 1993 41 (9) 1604.
6.Tanabe M., Chen Y.-D., Saito K., Kano J., Chem. Pharm. Bull. 1993 41 (4) 710.
7.Патент Японии 63-102 644, 1987; РЖХ 1989 200 84П.
8.Muller M., Schroder J., Magg C., Tetrahedron Lett. 1998 39 (26) 4655.
9.Cheng W.C., Wong H.N.C., Tetrahedron Lett. 1998 39 (36) 6521.
10.Wang E.S., Luo B.Sh., Mak T.C.W., et al., Tetrahedron Lett. 1994 35 (40) 7401.
11.Zoretic P.A., Fang H., Ribeiro A.A., J. Org. Chem. 1998 63 (4) 1156.
12.Goldsmith D.J., Deshpande R., Synlett 1995 (5) 495.
13.Hungerford N.L., Saunds D., Kitching W., Aust. J. Chem. 1998 51 (12) 1103.
14.Chen T.-B., Galinis D.L., Wiemer D.F., J. Org. Chem. 1992 57 (3) 862.
15.Nieto M., Gallardo O.V., Rossomando, J. Nat. Prod. 1996 59 (9) 880.
16.Дембицкий В.М., Толстиков А.Г., Толстиков Г.А., Химия в интересах устойчивого развития 2002 10 (3) 269.
17.Imamura P.M., Costa M., J. Nat. Prod. 2000 63 (12) 1623.
18.Ata A., Kerr R., Heterocycles 2000 53 (3) 717.
19.Rodriguez A.D., Shi Y.-G., Huang S.D., J. Org. Chem. 1998 63 (13) 4425.
20.Cases M., Gonzalez-Lopez de Turiso, Pattenden G., Synlett 2001 (12) 1869.
21.Leoberg S., J.C. de Bisean, Daloze D., et al., Tetrahedron Lett. 2000 41 (5) 633.
22.Lindel T., Jensen P.R., Fenical W., J. Am. Chem. Soc. 1997 119 (37) 8744.
23.Nicolaou K.C., Winssinger N., Vourloumis D., J. Am. Chem. Soc. 1998 120
(44)10814.
24.Zoretic P.A., Wang M., Zhang Y., Shen L., J. Org. Chem. 1996 61 (5) 1806.
25.Yiang R.W., Ma S.-C., But P.P.-H., Mak T.C.W., J. Nat. Prod. 2001 64 (10) 1266.
26.Carroll J., Jonsson E.N., Ebel R., et al., J. Org. Chem. 2001 66 (21) 6847.
27.Inoue M., Frontier A.J., Danishefsky S.J., Angew Chem., Int. Ed. 2000 39 (4) 761.
28.Faulkner D.J., Nat. Prod. Rep. 2002 19 (1) 1.
29.Schmitz W.D., Messerschmidt N.B., Romo D., J. Org. Chem. 1998 63 (7) 2058.
30.Corey E.J., Roberts B.E., J. Am. Chem. Soc. 1997 119 (51) 12425.
31.He H., Kulanthaivel P., Baker B.J., Tetrahedron Lett. 1994 35 (39) 7189.
32.Rueda A., Zubia E., Ortega M.J., J. Org. Chem. 1997 62 (5) 1481.
33.Zeng Lu., Gu Z.M., Fang X.P., et al., Tetrahedron 1995 51 (9) 2477.
34.Fernandez-Mateos A., de la Nava M.E.M., Coca G.P., Gonzalez R.R., J. Org. Chem. 1998 63 (25) 9440.
35.Толстиков Г.А., Шульц Э.Э., Чернов С.В. и др., в кн. Азотистые гетероциклы и алкалоиды, под ред. Карцева В.Г., Толстикова Г.А., М.: Иридиум-Пресс, 2001, c. 139.
36.Толстиков Г.А., Балтина Л.А., Толстикова Т.Г., Шульц Э.Э., Химия и компьютерное моделирование. Бутлеровские сообщения 2002 (7) 9.
37.Чернов С.В., Шульц Э.Э., Шакиров М.М., Толстиков Г.А., ЖОХ 2000 36
(10)1493.
38.Харитонов Ю.В., Шульц Э.Э., Шакиров М.М., Толстиков Г.А., Докл. РАН
2001 381 (3) 356.
39.Чернов С.В., Шульц Э.Э., Шакиров М.М., Толстиков Г.А., Докл. РАН 2001
381 (5) 643.
40.Толстикова Т.Г., Долгих М.П., Толстиков Г.А., Докл РАН 2000 374 (2) 268.
41.Толстикова Т.Г., Сорокина И.В., Воевода Т.В. и др., Докл. РАН 2001 376 (2) 271.
42.Толстикова Т.Г., Воевода Т.В., Долгих М.П., Сорокина И.В., Экспер. клинич.
фармакол. 2002 65 (2) 9.
118 |
Пленарные доклады |

Пирролкарбодитиоаты: Синтез и применение в дизайне сложных гетероциклических систем
Трофимов Б.А.
Иркутский институт химии им. А.Е. Фаворского СО РАН 664033, Иркутск, ул. Фаворского, 1
Введение
C-Функционализация пирролов дитиоатной группировкой дает C-пирролкарбоди- тиоаты – пиррольные строительные блоки, имеющие большой синтетический потенциал. Однако до наших систематических исследований в этой области такая функционализация и ее синтетическое применение были мало изучены.
Известно, что присоединение пиррольных анионов к сероуглероду приводит главным образом к N-пирролдитиоатам [1]. Например, в присутствии сверхоснования (NaH/ДМСО) [4] пирролят калия и его 2,5-диметильное производное [2, 3] или сам пиррол образуют с CS2 в основном N-карбодитиоаты (дитиокарбаматы) с высокими выходами.
Лишь при использовании пиррольных реактивов Гриньяра в реакции с CS2 с выходами до 47% [9] были получены некоторые 2-пирролкарбодитиоатные кислоты и их сложные эфиры [2, 5–9].
С близким выходом (43%) из пиррольного реактива Гриньяра и диэтил тритиокарбоната был получен этил 2-пирролкарбодитиоат [10]. Кроме этого, в некоторых работах эпизодически описывались синтезы 2- и 3-пирролкарбодитиоатов (например, путем алкилирования пирролов сероуглеродом по Фриделю–Крафтсу [11, 12]), которые однако были неселективными и давали низкие выходы продуктов.
1. Синтез пирролкарбодитиоатов
Недавно мы разработали общий удобный синтез 2-пирролкарбодитиоатов с использованием CS2 в сверхосновной системе KOH–ДМСО [13–16]. Пиррольные анионы, генерируемые в этой системе, атакуют CS2 исключительно или в основном положением 2, давая 2-пирролкарбодитиоатные анионы, которые после алкилирования (например, этилирования этилиодидом) образуют соответствующие сложные эфиры 2-пирролкарбодитиоатных кислот 1 с выходом 44–71% (схема 1). Единственным исключением здесь является незамещенный пиррол, который дает только 1-пирролкарбодитиоат 2.
Заместители в пиррольном кольце значительно влияют на соотношение 1- и 2- пирролкарбодитиоатных изомеров. При введении всего лишь одной метильной группы в α-положение пиррола, 2-пирролкарбодитиоат становится единственным продуктом реакции (выход 46%), и N-изомер вообще не удается обнаружить в реакционной смеси.
Генеральный спонсор и организатор – InterBioScreen Ltd. |
119 |
Схема 1
R" |
|
|
R' |
R" |
S |
R" |
S |
|
a, b |
|
|||||
|
|
NH |
|
N |
SEt |
+ |
N |
R' |
|
|
R |
R' |
SEt |
||
|
R |
H |
|
R |
|||
|
|
1 |
(44−71%) |
|
|
||
|
|
|
|
|
2 |
||
|
a - KOH/ДМСО/CS2, 20−25°C, 3 ч; |
|
R, R', R" = H |
||||
|
b - EtI, 20−25°C, 2 ч |
|
|
|
|
|
|
Любые другие комбинации алкильных заместителей в пиррольном кольце приводят к селективному образованию 2-пирролкарбодитиоатов с выходом до 71%.
Региоселективность дитиокарбонизации нарушается при введении фенильного заместителя в α-положение пиррола: наряду с основными продуктами – 2-пирролкарбодитиоатами (выход 44–59%), с выходом 24–33% образуются также N-изомеры.
При наличии заместителей в обоих α-положениях пиррола наиболее вероятным казалось образование N-пирролкарбодитиоатов, поскольку, как упомянуто выше, примеров дитиокарбонизации пирролов по β-положению до наших работ было известно немного. Были известны лишь единичные примеры. Однако, вопреки ожиданиям, в этой реакции были выделены исключительно этил 3-пирролкарбоди- тиоаты 3 с выходами 36–61% [17, 18] (схема 2).
N-Пирролкарбодитиоаты 4 не были обнаружены (ЯМР) среди продуктов реакции.
Схема 2
R' |
|
R |
R' |
|
S |
||
|
|
a, b |
|
R |
N |
HN |
SEt |
|
|||
H |
|
|
|
|
|
|
3 |
a- KOH/ДМСО/CS2, 20−25°C, 3 ч;
b- EtI, 20−25°C, 2 ч
R
R' |
S |
|
|
|
N |
|
SEt |
4
не обнаружен (ЯМР)
В случае 2-арил(гетарил)-5-метилпирролов, например 5, возможно образование обоих изомеров: 3- и 4-пирролкарбодитиоатов. Однако реакция оказалась строго региоспецифичной: в реакционной смеси были обнаружены только 4-изомеры 6 (выходы 44–61%), т.е. изомеры, имеющие дитиоатную функцию рядом с метильной группой [17–19] (схема 3). 3-Изомеры 7 вообще не были зафиксированы (ЯМР). Вероятно, причиной такой региоспецифичности является стерическое экранирование положения 3 пиррольного кольца орто-водородным атомом ароматического или гетероароматического заместителя.
120 |
Пленарные доклады |

Схема 3
|
|
|
|
S |
SEt |
|
|
|
|
S |
|
|
|
|
|
|
|
|
a, b |
|
|
SEt |
|
S |
N |
S |
N |
S |
N |
|
H |
6 |
H |
|
H |
|
5 |
|
|
7 |
|
|
a - KOH/ДМСО/CS2, 20−25°C, 3 ч; |
|
не обнаружен (ЯМР) |
||
|
b - EtI, 20−25°C, 2 ч |
|
|
|
|
Регионаправленность присоединения мультидентатных пиррольных анионов к сероуглероду проанализирована теоретически [20–23].
Квантовохимические расчеты (MP2/6-31+G** с учетом поляризационных и диффузных функций) [20–25] показывают, что самый большой отрицательный заряд (~0.4) находится в пиррольных анионах на атоме азота и практически не зависит от замещения метильными группами в кольце [20–22, 25]. Следовательно, если имеет место зарядовый контроль, пиррольный анион во всех случаях должен атаковать CS2 своим атомом азота, давая преимущественно 1(N)-изомеры.
Вто же время, заряды на углеродных атомах в пиррольном кольце существенно изменяются при введении заместителей. Метильная группа в α-положении пиррола значительно увеличивает отрицательный заряд в положении 4, и он становится сравнимым с зарядом на атоме азота. Поэтому если реакция контролируется зарядами, атака сероуглерода β-положением 2-метилпиррольного аниона является достаточно вероятной.
В2,3-диметилпиррольном анионе заряды на всех углеродных атомах существенно изменяются, и положение 4 становится еще более отрицательным, чем атом азота. Однако в действительности никакой значительной разницы в экспериментальном поведении этих двух пирролов не наблюдается (выходы соответствующих 2-пирролкарбодитиоатов – 46 и 51% [15], т.е. в пределах ошибки эксперимента). Несмотря на высокие отрицательные заряды в β-положениях 2-метил- и 2,3-диме-
тилпиррольных анионах (которые гораздо выше, чем заряды в α-положениях), вместо ожидаемых 3-изомеров образуются исключительно соответствующие 2-пир- ролкарбодитиоаты.
Следовательно, имеет место либо орбитальный контроль реакции, либо перегруппировка первоначально образовавшихся 1- или 3-изомеров в 2-изомеры. Как следует из квантовохимических расчетов [21, 23, 25], энергии ВЗМО и их форма для изученных пиррольных анионов различаются незначительно. Поэтому перегруппировка остается наиболее вероятным объяснением наблюдаемой региохимии.
В анионе 2,5-диметилпиррола отрицательный заряд β-положения также не намного отличается от заряда на атоме азота. Это позволяет предположить, что β-положение будет участвовать в реакции с CS2, в особенности учитывая то, что атом азота стерически экранирован двумя метильными группами. В этом случае теоретическое предположение действительно согласуется с экспериментом.
Генеральный спонсор и организатор – InterBioScreen Ltd. |
121 |
Вычисленные значения разностей энергий (в том же базисе) показывают (рис. 1), что незамещенный 2-пирролкарбодитиоатный анион на 5.47 ккал/моль более стабилен, чем соответствующий N-изомер [21, 23, 25]. Это не согласуется с экспериментом, который дает только 1-пирролкарбодитиоат – следовательно, его можно считать кинетическим продуктом.
|
|
N |
S |
N |
S |
|
S |
− |
− |
||
|
|
S |
|
S |
|
|
− |
|
0.32 |
||
HN |
|
S |
1.57 |
||
S |
|
|
|||
|
5.76 |
HN |
− |
|
S |
|
S |
HN |
− |
||
|
|
||||
|
|
|
|
S |
|
|
|
|
|
|
|
N |
S |
|
|
|
|
− |
|
|
11.12 |
|
|
|
S |
|
|
|
11.95 |
|
|
|
|
|
|
|
5.47 |
|
|
|
|
|
S |
|
S |
|
S |
N |
− |
N |
− |
N |
− |
S |
S |
S |
|||
H |
|
H |
|
H |
|
Рис. 1. Разности энергий (ккал/моль) 1-, 2- и 3-пирролкарбодитиоатных анионов (MP2/6-31+G**): эффект метильного замещения [21, 23]
Метильная группа в α-положении увеличивает стабильность аниона 2-пиррол- карбодитиоата по сравнению с соответствующим N-изомером на 11.12 ккал/моль. Следующий метильный заместитель в β-положении лишь незначительно увеличивает эту разницу (до 11.95 ккал/моль).
Большая энергетическая предпочтительность метилзамещенных 2-пирролкар- бодитиоатных анионов объясняет их наблюдаемое региоселективное образование, которое, скорее всего, является термодинамическим результатом, в то время как N- или 3-изомеры могут быть кинетическими продуктами.
Очевидно, что в случае незамещенных пирролкарбодитиоатных анионов разница в энергиях (5.47 ккал/моль) недостаточно велика для легкой перегруппировки.
Незамещенный 3-пирролкарбодитиоатный анион по энергии находится на 5.76 ккал/моль выше, чем его 1-изомер, в то время как 3-карбодитиоат-анионы 2-метил- и 2,3-диметилпирролов различаются по энергиям от своих N-карбо- дитиоатных изомеров незначительно: на 0.32 ккал/моль предпочтительней 3-(2-ме- тилпиррол)карбодитиоат и на 1.57 ккал/моль – 1-(2,3-диметилпиррол)карбоди- тиоат [21, 23, 25] (рис. 1). На основании расчетных данных можно было ожидать,
122 |
Пленарные доклады |
что анион 2,5-диметилпиррола будет атаковать CS2 положением 3(4) (на термодинамической стадии реакции), приводя к соответствующему 3(4)-карбодитиоату, который на 6.93 ккал/моль более стабилен, чем N-изомер [21, 23, 25]. Это действительно согласуется с экспериментом (см. превращение 5→6).
2. Реакционная способность 2-пирролкарбодитиоатов
2.1 Анионы 2-пирролкарбодитиоатов как нуклеофилы
Благодаря нашим систематическим исследованиям реакции пирролов с сероуглеродом впервые стали легко доступными различные замещенные 2- и 3-пирролкар- бодитиоаты. Они оказались удобными строительными блоками для сборки новых гетероциклических ансамблей на основе пиррола. Будучи высоко нуклеофильными соединениями, анионы 2-пирролкарбодитиоатов 8, генерируемые in situ, мягко присоединяются к электрофильным алкенам, таким как акрилонитрил, акриламид или метилакрилат, давая соответствующие производные пропионовой кислоты 9 с выходом до 62% [26] (схема 4). Внутримолекулярная циклизация этих соединений открывает путь к функционализированным пирролотиаазепинам 10.
Схема 4
R' |
|
|
S + |
+ |
|
H2O/ДМСО |
|
|
|
N |
|
− K |
R" |
20−25°C, 2 ч |
|
||
R |
|
S |
|
|
||||
|
|
|
|
|
|
|||
H |
|
|
|
|
|
|
|
|
|
8 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
S |
|
R' |
|
S |
|
|
R' |
|
S |
|
|
N |
S |
|
|
N |
|
|
|
R |
|
|
|
|
|||
|
|
|
|
|
|
|||
|
H |
|
|
R" |
|
R |
|
|
|
|
|
|
|
X |
|||
|
|
|
|
|
|
|||
|
|
9 |
|
|
|
|
|
|
|
|
|
|
|
|
10 |
||
R = Ph, R' = H; R+R' = (CH2)4; R" = CN, CONH2, CO2Me;
X = O, NH
Электрофильные ацетилены также являются активными акцепторами анионов 2-пирролкарбодитиоатов. Пример таких реакций – присоединение 2-(4,5,6,7-тетра- гидроиндол)карбодитиоата 11 (легко генерируемого из ставшего доступным 4,5,6,7- тетрагидроиндола [27–29]) к фенил 2-фуроилацетилену 12 [30, 31] (схема 5). Ожидаемого (согласно [32, 33]) 1,3-анионного циклоприсоединения в этом случае не наблюдается. Происходит нормальное нуклеофильное присоединение дитиоатаниона к тройной связи со стереоспецифическим образованием Z-аддукта 13, т.е., несмотря на очевидные стерические затруднения, реализуется классическая схема транс-присоединения. Стерически затрудненная двойная связь аддукта 13 оста-
Генеральный спонсор и организатор – InterBioScreen Ltd. |
123 |
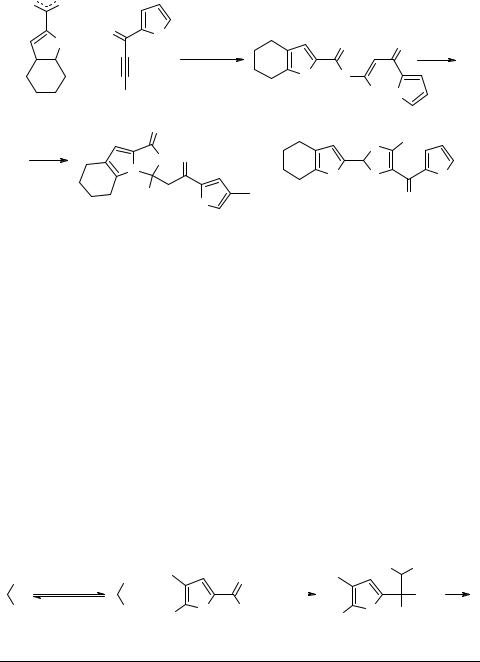
ется активной и участвует в дальнейшей внутримолекулярной циклизации с образованием (в одну стадию) тетрагидроиндолотиазола 14 [30].
Схема 5
S − |
S |
|
|
|
|
|
|
|
|
|
|
K+ |
O |
|
O |
|
|
|
|
|
|
|
NH |
|
|
|
S |
|
O |
|
||
|
|
|
H2O/ДМСО |
|
|
|
||||
|
+ |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
||
|
|
|
|
20−25°C, 3 ч |
N |
S |
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
||
|
|
|
Ph |
|
|
H |
|
Ph O |
|
|
11 |
|
|
|
|
|
13 |
|
|||
|
|
12 |
|
|
|
|
|
|
||
|
|
|
|
S |
|
|
|
|
Ph |
|
|
|
|
|
|
O |
|
|
S |
|
|
|
|
|
|
S |
|
|
|
|
||
|
|
|
N |
|
N |
S |
|
O |
||
|
|
|
|
|
|
|
||||
|
|
|
Ph |
|
O |
|
H |
|
O |
|
|
|
|
|
|
|
|
|
|||
|
|
|
14 (46%) |
1,3-анионное циклоприсоединение |
||||||
|
|
|
|
|||||||
2.2 2-Пирролкарбодитиоаты как электрофилы: синтез функционализированных
2-винилпирролов
2-Пирролкарбодитиоаты являются хорошими электрофилами. Карбанионы 15, генерируемые из различных CH-кислот, таких как малононитрил, малононитриламид и т.п., в системе KOH–ДМСО присоединяются к тиокарбонильной группе 2-пир- ролкарбодитиоатов при 100–110°С (схема 6). Аддукт 16 отщепляет тиол, давая винилтиолят 17, который после алкилирования образует функционализированные 2-винилпирролы 18a–d с выходом 51–90% в зависимости от замещения в пиррольном кольце, функций исходных CH-кислот и структуры алкилирующего агента [34]. Комбинирование этих заместителей и функций открывает широкие возможности для синтеза разнообразных функционализированных 2-винилпир- ролов. Последние являются очень реакционноспособными соединениями, склонными к внутримолекулярной циклизации в пирролизины (пирроло[1,2-a]пирролы) 19 – обычные побочные продукты этого синтеза, часто присутствующие в реакционных смесях в количестве 1–2%. Однако, в некоторых случаях, например, при Z = CO2Et, R'–R'' = (CH2)4, пирролизины 19 могут стать основными продуктами реакции (выход более 60%) [34].
|
|
|
|
|
|
|
|
|
|
|
Схема 6 |
X |
|
X |
R' |
|
S 100−110°C |
R' |
X |
|
|
CN |
|
KOH/ДМСО |
|
|
|
|
|
||||||
|
|
|
|
|
SR" |
||||||
|
20−25°C |
− + |
|
N |
SR" |
1.5 ч |
|
N |
|
− |
|
CN |
CN |
R |
R |
S |
|
||||||
|
|
|
|||||||||
|
|
15 |
H |
|
|
H |
|
|
|||
|
|
|
|
|
|
|
16 |
|
|
|
|
124 |
Пленарные доклады |
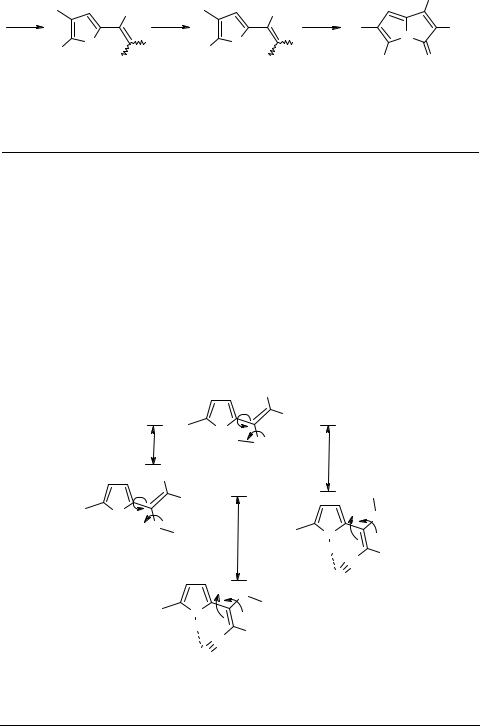
|
R' |
|
S− |
|
R' |
|
SR'" |
|
|
SR'" |
|
|
R"'I |
|
|
|
|
||||
|
|
|
|
|
|
R' |
|
|
CN |
|
−R''SH |
|
|
|
|
|
|
|
N |
||
R |
N |
X |
|
R |
N |
X |
|
|
||
|
|
|
|
|
||||||
|
H |
NC |
|
H |
NC |
R |
|
Y |
||
|
|
|
|
|
||||||
|
|
17 |
|
|
|
18a−d (50−90%) |
|
19 (1−2%) |
||
|
|
|
|
|
|
|
Y = O, NH; X = CO2Et; |
|||
R+R' = (CH2)4;
R'" = Et (до 61%)
18 |
R |
R' |
R''' |
X |
Выход 18, % |
a |
n-Pr |
Et |
Et |
CONH2 |
90 |
b |
n-Bu |
n-Pr |
Et |
CN |
51 |
c |
|
(CH2)4 |
Allyl |
CN |
63 |
d |
Ph |
H |
Et |
CONH2 |
82 |
Квантовохимические расчеты (6-31G*) достаточно хорошо воспроизводят экспериментально полученные дипольные моменты для дициановинилпирролов, подтверждая их сильную зависимость от конформации. Для 2-метил-5-(2,2-ди- циано-1-метилтио)винилпиррола две наиболее стабильные конформации 20a и 20b имеют цианогруппу в син-положении к пиррольному азоту, указывая таким образом на возможность внутримолекулярного H-связывания между группами NH и CN [35, 36] (рис. 2).
NC
|
|
|
35° |
CN |
|
|
|
|
N |
|
|
|
|
|
|
S 57° |
|
|
|
|
0.4 ккал/моль |
H |
|
|
|
||
|
|
20d |
9.03 D |
|
1.0 ккал/моль |
|
|
NC |
|
|
|
|
|
|
27° |
CN |
|
|
|
|
N |
|
|
|
|
S |
|
S 42° |
|
|
|
|||
H |
|
|
N |
|||
20c |
8.14 D |
|
|
|
68° |
|
|
1.4 ккал/моль |
H 17° |
CN |
|||
|
|
|
C |
|||
|
|
|
|
|
|
|
|
|
|
|
|
N |
7.52 D |
|
|
|
S |
|
20b |
|
|
|
N |
46° |
|
|
|
|
|
H 18° |
|
|
|
|
C CN
N
20a 5.94 D
Рис. 2. Конформации, разности энергий и дипольные моменты (6-31G*) 2-метил-5-(2,2-ди- циано-1-метилтио)винилпиррола
Генеральный спонсор и организатор – InterBioScreen Ltd. |
125 |

Обе эти конформации являются практически планарными по отношению к пиррольному кольцу и двойной связи (угол между этими двумя плоскостями составляет 17–18°), причем метилтиогруппа выведена из плоскости на 46° и направлена в сторону от пиррольного кольца в наиболее стабильной конформации 20а. Вторая по стабильности конформация 20b имеет единственное отличие от первой: метилтиогруппа выведена из плоскости на 68° и направлена к пиррольному кольцу. Вычисленные значения дипольных моментов (5.94 и 7.52 D) соответствуют экспериментальным значениям для близких аналогов (6.2–7.1 D).
В двух других менее стабильных конформациях 20c и 20d нитрильные функции повернуты в стороны от NH-группы и в значительной степени выведены из плоскости пиррольного кольца. Углы между пиррольным кольцом и плоскостью двойной связи составляют 27 и 35°, а метилтиогруппы находятся в гош-конфор- мации. Дипольные моменты этих конформаций (8.14 и 9.03 D) существенно выше, чем экспериментальные.
Разница в энергиях между наиболее и наименее стабильными конформациями равна 1.4 ккал/моль.
3. Синтез конденсированных и связанных пиррольных систем через функционализированные 2-винилпирролы
Как упоминалось выше, в отличие от своих аналогов со сложноэфирной функцией [37–40], дициановинилпирролы достаточно стабильны в системе KOH–ДМСО и не циклизуются в пирролизины даже при температуре 100–110°С. Однако в метаноле со следовыми количествами KOH (0.2%) при 50°C циклизация протекает практически мгновенно (за 1–2 мин) [38, 39, 41] (схема 7). Из этого следует, что для успешного внутримолекулярного присоединения NH-функции пиррола к нитрильной группе необходимо электрофильное содействие спиртового протона.
Схема 7
|
|
|
|
SR'' |
|
|
OMe |
|
|
CN |
R' |
N |
CN |
+ R' |
|
N |
CN |
R''S |
|
|
|
|
|
|||
CN |
|
R 21 |
NH |
|
R |
22 NH |
|
|
|
a |
|
|
|||||
|
NH |
основной |
|
минорный |
|
|||
|
|
|
OH |
|
|
O |
|
|
|
|
|
|
|
|
|
||
R' |
R |
R' |
|
CN |
R' |
|
|
CN |
|
|
N |
|
N |
||||
|
|
|
|
|
|
|
||
|
|
|
R |
NH |
23 |
R |
NH |
|
|
|
|
|
|
|
|
|
|
R, R' = alkyl, aryl; R'' = alkyl; |
минорный |
|
|
a - KOH (0.2%)/MeOH, 50°C, 1−2 мин |
|
126 |
Пленарные доклады |
