
- •05201051003 Мазепа
- •1Тцр — полимеразная цепная реакция
- •Внедрение в практику.
- •1.2.2 Диагностика хеликобактерной инфекции
- •2.3. Диагностика парентеральных вирусных гепатитов. Парентеральные вирусные гепатиты - группа инфекционных
- •1.3 Внедрение и использование пцр в практическом здравоохранении Российской Федерации.
- •2.Собственные исследования
- •2.1. Материалы и методы
- •2.1.2. Методы.
- •2,5 Мкл праймеров по 5-15 пмоль/мл каждого; 5 мкл 10-кратного реакционного буфера 2,5 мкл dNtp по 1мМ каждого; 1 мкл Tag-пoлимepaзы 0,5 е.А. 29 мкл деионизованной воды
- •1. Готовили реакционную смесь для амплификации из расчета на 1 пробу: буфер — Змкл, аЫтр - 3 мкл,
- •2.2.1.1. Выбор приборов для проведения пцр и фиксирования результатов.
- •2, 3, 4, 5, 6, 7, 8, 9 - Фрагменты гена шигоподобного токсина vt1.
- •2.2.2.4, Алгоритм использования метода пнр в диагностике бактериальных оки
- •Первичное обследование лиЦ—
- •2.2.3.2. Сравнительный анализ результатов детекции h.Pylori. Полученных традиционными и молекулярно-биологическими методами.
- •2.2.3.3. Изучение распространенности h.Pylori у больных с различными формами гастродуоденальной патологии
- •Тип патологии
- •2.2.4.4. Изучение вероятности вертикального пути передачи вгс и вгв.
- •Положительный результат
- •Продолжение лечения
- •Отрицательный результат
- •Назначение лечения
- •Назначение лечения
- •Отрицательный результат Продолжение лечения
- •2.2.5.1. Место пцр в общей системе методов диагностики нуги.
- •Выявлены u.Urealyticuym m hominis
- •IПри необходимости выявление возбудителей в отдельных субстратах
- •Список источников литературы.
- •307 307Приложение 1
- •310Частота выявления возбудителей нуги по сезонам 1998-2008 годов.
1. Готовили реакционную смесь для амплификации из расчета на 1 пробу: буфер — Змкл, аЫтр - 3 мкл,
праймеры (з1/з2, ш1, ш2) — 2 мкл, Тац-полимеразы - 0,2 мкл, дистилированной воды — 16,8 мкл.
После добавления Тац-полимеразы, которое производится в последнюю очередь тщательно перемешивали смесь пипетированием.
Добавляли по 25 мкл смеси во все пробирки, подготовленные для амплификации, наносили по 25-30 мкл минерального масла.
Вносили по 5 мкл анализируемых образцов и контролен в соответствующие пробирки под слой масла.
Центрифугировали в течение 3-5 сек при 1500-3000 об/мин и переносили пробирки в прогретый до температуры 94° С амплификатор.
Проводили амплификацию по следующей программе:
|
«горячий старт» |
94°С 3 мин. |
1 цикл |
|
денатурация ДНК |
94°С 1 мин. 52°С 1 мин. 72°С 2 мин. |
30 циклов |
|
отжиг праймера | ||
|
синтез фрагмента | ||
|
завершение синтеза |
72°С 5 мин. |
1 цикл |
Амплификация фрагментов геномов возбудителей вирусных гепатитов. Использование ПЦР тест систем производства ФГУН ЦНИИЭ Роспотребнадзора для выявления вирусов гепатитов В, С, D, G, TTV и определения генотипов la, lb, 2, За ВГС.
Для ПЦР-детекции вирусов гепатитов В, С, D, G, TTV и определения генотипов la, lb, 2, За ВГС применялись тест-системы серии «АмплиСенс». Исследование проводили согласно инструкций разработчика. Амплификация фрагментов геномов возбудителей НУГИ. Использование ПЦР тест систем производства ФГУН ЦНИИЭ Роспотребнадзора для выявления U.urealyticum, М.hominis, С.trachomatis, Cytomegalovirus, Herpes simplex I/II, папилломавирусов генотипов 16, 18,31,33,35,45
Применялись тест-системы серии «АмплиСенс». Исследование проводили согласно инструкций разработчиков.
Выявление продуктов амплификации методом электрофореза
Электрофоретическое разделение продуктов амплификации осуществлялось в соответствии с руководством. Маниатис с соавт [46]. Электрофорез проводили при напряжении 120В в течение 25 мин.2.2. Результаты собственных исследований 2.2.1 .Формирование материальной базы для проведения исследований
На момент начала наших исследований практическая ПЦР диагностика в Российской Федерации находилась на стадии становления, достаточного опыта работ не имелось, поэтому на исходном этапе значительное внимание было уделено решению ряда методических проблем - выбору приборной базы, методов подготовки клинического материала к исследованию, подбору и адаптации ПЦР тест-систем.
2.2.1.1. Выбор приборов для проведения пцр и фиксирования результатов.
Для проведении ПЦР-детекции использовались три модели отечественных ДНК-амплификаторов: 1-Института биофизики РАН, г. Пущино-на-Оке; 2-«Ампли-250» фирмы «Вюкот» г. Москва; «Терцик МС2» фирмы «ДНК-технология» г. Москва.
На наш взгляд наименее удачным был прибор института биофизики РАН. Его термоэлемент, вместимостью 24 пробирки на 0,5 мл или 12 пробирок на 1,5 мл, не поддерживал установленный температурный режим нагрева пробирок с реакционными смесями, что снижало эффективность амплификации. На этом амплификаторе удалось проверить работоспособность диагностикумов с помощью положительных и отрицательных контролей, входящих в его комплект.
Приборы «Ампли-250» и «Терцик МС2» могут быть рекомендованы для исследования клинического материала. По сравнению с прибором фирмы «Вюкот» «Терцик МС2» имеет ряд преимуществ: у него большая вместимость нагревательного элемента (40 пробирок вместо 36); нагревательный элемент представлен четырьмя независимо программируемыми блоками емкостью по 10 пробирок, что позволяет одновременно проводить амплификации при четырех разных режимах; наряду с автономным режимом работы имеется возможность подключения к компьютеру, что позволяет отслеживать процесс в графическом и в цифровом режимах; имеется возможность проведения ПЦР в условиях активного регулирования процесса, что уменьшает продолжительность исследования.
В нашей работе подавляющая часть экспериментов проведена с использованием амплификаторов «Терцик МС2». С середины 90-х годов по настоящее время этот прибор является базовым для большинства ПЦР- лабораторий Российской Федерации.
Для выявления продуктов амплификации использован метод электрофореза в агарозном геле. Изображения электрофореграмм фиксировали отечественной компьютерной системой «Биотест» (фирмы «Биоком», Москва). Такой вариант проще и информативней традиционной фотосъемки. Стоимость системы «Биотест» в 3 раза меньше зарубежных аналогов (систем «Bio-Rad», США и др.).
2.2.1.2. Сравнение вариантов выделения нуклеиновых кислот из клинического материала.
Одной из задач данного исследования являлся выбор варианта обработки проб биологического материала: слюны, мочи, крови, биоптатов, желудочного сока, фекалий и др. Простой и быстрый вариант обработки кипячением, описанный Roosendaal R. с соавторами [315] результатов не дал. Во всех пробах, подвергнутых нагреванию, амплификация ДНК не происходила. Очевидно, имело место ингибирование Taq-полимеразы не удаленными макромолекулами (белками, липидами, полисахаридами).
Экспресс-метод обработки клинического материала, предложенный фирмой «Литех» (г. Москва),, также оказался непригодным для подготовки проб крови, слюны, биоптатов к проведению ПЦР.
В дальнейшем использовались более сложные способы, позволяющие получить очищенный раствор нуклеиновых кислот из любого типа клинического материала. Традиционный метод выделения ДНК, состоящий из этапов разрушения клеток ферментами (протеиназой К, проназой), фенольно-хлороформной депротеинизации ДНК с последующим осаждением ее спиртами [47], позволил получить материал, пригодный для проведения ПЦР. Вместе с тем, этот метод имел недостатки, мешающие рекомендовать его для практического применения. Он сложен, состоит из большого количества этапов, продолжительность около 5 часов; требуется применение дорогостоящих ферментных препаратов с ограниченным сроком годности и высокотоксичных веществ (фенол, хлороформ).
Среди способов подготовки проб оптимальными оказались варианты, состоящие из стадий лизиса клеток детергентом (гуанидинизотиоцианатом), сорбции ДНК на носителе (макропористое стекло, силикагель), отмывки сорбированной ДНК от других макромолекул и элюирования ДНК с носителя ТЕ-буфером. Апробированы комплекты реактивов для сорбционного выделения ДНК фирмы «Литех» - «Набор для выделения ДНК из биопроб» и ФГУН ЦНИИЭ Роспотребнадзора - «ДНК-сорб А», «ДНК-сорб Б». Сорбционные технологии несколько уступают фенольному методу. Он позволяет получить более чистый препарат ДНК при меньших потерях основного вещества. Однако сорбционные методы более технологичны, менее затратны, не требуют использования токсичных веществ, выделение ДНК занимает в 2-2,5 раза меньше времени. Получаемый препарат нуклеиновых кислот пригоден для проведения ПЦР. В дальнейшем для практических исследований нами использовались наборы для подготовки проб производства ЦНИИЭ, которые обладали лучшими рабочими характеристиками.
2.2.1.3. Разработка ПНР тест-систем для выявления генов факторов патогенности ЕЩегоЬас1епасеае.
Поскольку на момент начала исследований ПЦР тест-систем для выявления генов факторов патогенности ЕЩегоЬа^епасеае в Российской Федерации не производилось были разработаны лабораторные варианты таких диагностикумов. Для этого проведено секвенирование имеющихся в инстиуте клонированных фрагментов ряда данных генов и компьютерный анализ нуклеотидных последовательностей генов факторов патогенности энтеробактерий из банков данных, что позволило подобрать праймеры, специфичные к генам четырех наиболее значимых по данным литературы факторов патогенности: к гену термостабильного токсина (ST-токсин), к гену термолабильного токсина (LT-токсин), к гену шигаподобного токсина первого типа (VT1) и к оперону инвазивности шигелл. Секвенирование фрагментов генов и синтез праймеров проводились на базе Института биоорганической химии им. Ю.А.Овчинникова и М.М. Шемякина РАН (Москва).
ТТ-1 5'- ATGACGGGAGGTAACATGAA - 3' (прямой) ТТ-2 5 - ТСССТС ГА AGCTTTTTAATA - 3 (обратный) Праймеры, специфичные к участку ДНК гена термостабильного токсина. LT-1 5'- TCTCTATATGCACACGGAGC- 3' (прямой) LT-2 5 - CCATACTGATTGCCGCAAT - 3 (обратный) Праймеры, специфичные к участку ДНК гена термолабильного токсина VT1-1 5-GTCCTGCAGGGCGTGGAGGA-3' (прямой) VT1-2 5 - CGTAAAGCTTCAGCTGTCAC - 3' (обратный) Праймеры, специфичные к участку ДНК гена шигоподобного токсина первого типа.
SF-1 5' - GGAAGCTTAATACTCCTGAACGGCG - 3' (прямой) SF 2 5' - GGAAGCTTAGGTGTCGGCTTTTCTG - 3'; (обратный) Праймеры, специфичные к участку ДНК оперона инвазивности шигелл.
Лабораторные ПЦР тест-системы, базирующиеся на этих праймерах, позволили проводить скрининг штаммов Enterobacteriaceae на наличие генов соответсвующих факторов патогенности.
2.2.1.4. Разработка ПЦР тест-системы для экспресс-детекции шигелл и энтероинвазивных эшерихий
Бактерии рода Shigella — абсолютные патогены, наиболее вирулентные из представителей семейства Enterobacteriaceae. В связи с этим совершенствование методов выявления этих микроорганизмов является практически важной задачей.
Исследования по созданию ПЦР тест-системы для экспресс-детекции бактерий рода Shigella и энтероинвазивных Е. coli явились логическим продолжением работ по изучению распространения генов факторов патогенности энтеробактерий.
В предыдущих исследованиях было показано, что все свежевыделенные штаммы шигелл в независимости от их видовой принадлежности содержали гены оперона инвазивности и взаимодействовали с праймерами SF1 и SF2, сконструироваными для выявления этотого фактора патогенности.
Для одного из фрагментов, полученных при амплификации тотальной ДНК клинического изолята S.flexneri 2а на базе НИИ биоорганической химии им. Ю.А. Овчинникова и М.М. Шемякина РАН (Москва)^ была определена полная первичная структура. Фрагмент имел следующую последовательность нуклеотидов:
GTTTTTAATACTCCTGAACGGCGTTTTTTTTAGATTGGCTCCATTAT
TTTTCTTTCTTCCATTTTTAAATAACGGTATAATTTCTCCATCTATTA
GAATACCTGTGATTTTTCTTGTTGCATCAGGATTAATTACTTCTGGT
AAGGTAGACATAGGTTCTTCTGTTTTTGAACATGTTTATTTCCTTAT
GTTCAAGGAAATAATTGTTGGCCTCCTTCTCTCTTTTTGCTTGTCTC
TTCCCTTTTGGATATTTCATGCTGTTGGTAGCATTATTGACAACCAG
CGTGGGGCAACGCTTAGTAGTTCAATTGATCCTGCCAATGGTGTTG
ATACGTCTGAGTTGGCAAAATTTTTCAATCTTTTTTCTGCAGTTGTA
TTTCTATACAGTGGTGGTATGGTCTTTATTTTAGAATCCATACAATT
GTCTTATAATATATGCCCGTTATTTTCTCAATGTTCTTTCCGTGTCT
CAAATATCTTAACATTTCTGACTTTATTGGCAAGTCAGGCTGTTATT
TTAGCCAGTCCTGTTATGATAGTATTGTTACTATCAGAAGTATTACT
TGGTGTATTATCGAGATTTGCTCCGCAGATGAATGCTTTTTCCGTA
TCATTAACTATTAAAAGTTTACTTGCAATATTTATTATTTTCATCTG
TTCTTCTACTATTTACTTTTCTAAAGTTCAATTTTTCCTCGGTGAAC
ATAAATTTTTCACAAATCTATTTGTTAGATAAAATATTATGGCAAAT AAAACAGAAAAGCCGACACCTAAAA
На основании компьютерного анализа нуклеотидных последовательностей базы данных «DNA-star» показана 100%-ная гомология данного фрагмента с участком оперона инвазивности размером 776 п.н., расположенного на плазмиде pMYSH6000 штамма S. flexneri 2а YSH6000 (База данных «DNA-star»), Полное совпадение нуклеотидной последовательности фрагмента, клонированного нами, и ранее описанного фрагмента, свидетельствовало о высокой консервативности этого участка оперона инвазивности и о его перспективности в качестве мишени при детекции бактерий рода Shigella.
Дополнительно специфичность праймеров была исследована на коллекции чистых культур энтеробактерий: S. dysenteriael (2 шт), S. flexneri (20 шт), S. sonnei (14 шт), S. boydii (15 шт), Е. coli серовариантов 08, 026, Ol44, 0124, 086 (всего 30 шт.), Salmonella ssp. (10 шт.), Klebsiella ssp. (12 шт.), Enterobacter ssp. (10 шт.) и др. Все свежевыделенные штаммы бактерий рода Shigella дали положительный результат при применении метода ПЦР, большинство музейных культур шигелл взаимодействовали с праймерами. Положительные результаты были получены также для 3-х штаммов E.coli сероварианта 0124. Часть штаммов шигелл, хранящихся в музее более года, дали отрицательный результат. При проведении плазмидного анализа этих штаммов была выявлена элиминация крупных плазмид (140мД и 120 мД), содержащих по данным литературы оперон инвазивности [321].
При выявлении шигелл и энтероинвазивных эшерихий в клиническом материале с помощью первого варианта ПЦР тест-системы эффективность амплификации была достаточно низкой, что сказывалось на чувствительности и качестве электрофореграммы (слабое свечение специфических фрагментов, шлейфы продуктов неспецифического синтеза).
Качественный результат ПЦР был получен после обогащения исследуемых проб инкубацией в селенитовом бульоне в течение 18 часов.
Введение стадии культивирования увеличивало продолжительность исследования. Для повышения качества теста необходимо было увеличить чувствительность и повысить технологичность метода. Традиционные варианты ПЦР с высокой чувствительностью (ПЦР с гибридизационной детекцией продукта амплификации и «гнездовая» ПЦР) не могли быть нами использованы иза их сложности и продолжительности.
Дальнейшее совершенствование тест-системы для детекции бактерий рода Shigella проводилось совместно с лабораторией молекулярно- биологической диагностики ФГУН ЦНИИЭ Роспотребнадзора.
Для увеличения чувствительности и специфичности был применен вариант «буст»-ПЦР. В этом варианте, как и в «гнездовой» ПЦР, используется две пары праймеров, но амплификация проводится в одной реакционной смеси.
Это достигается благодаря особому температурному режиму процесса. Первые 10 циклов амплификации проводят при высокой температуре отжига праймеров, за счет этого синтез идет с пары более длинных высокоспецифичных «внешних» праймеров. После 10-ти циклов температура отжига снижается, и амплификация в завершающих 30 циклах продолжается со второй пары более коротких по размеру «внутренних» праймеров. При этом в качестве матрицы для синтеза выступают в основном фрагменты ДНК, синтезировавшиеся на первом этапе с «внешних» праймеров, а не исходная ДНК-мишень.
«Буст» ПЦР позволяет отказаться от детекции продукта амплификации зондом, поскольку за счет длинных праймеров достигается высокая специфичность на стадии инициации синтеза. Второй этап (синтез с коротких праймеров при относительно мягких условиях отжига) позволяет повысить эффективность амплификации и получить большое количество ДНК, которое возможно выявить электрофорезом в агарозном геле. Этот вариант проще в исполнении, дешевле и занимает меньше времени, чем «гнездовая» ПЦР или ПЦР, сопряженная с гибридизацией. Проведение реакции в один этап, в одной реакционной смеси, уменьшает вероятность контаминации.
Компьютерный подбор и синтез праймеров выполнялся в лаборатории молекулярной диагностики ФГУН ЦНИИЭ Роспотребнадзора, проверка специфичности праймеров на чистых культурах энтеробактерий, апробация тест-системы на клиническом материале проводилась на базе ННИИЭМ. В результате совместной работы для системы были отобраны следующие 2 пары праймеров:
«внешние». вЫ 5'- ССТАСТТСТТТСТССАТССТАТСОТСАСС-З';
8112 5' - СТААССАТТОССССАСССТССТТСТС-З'; «внутренние»: вЪЗ 5' - ССАСАТТТТСААССТСЖТТС-З';
ЭЬ4 5' - СвССААСААТТАТТТССТТС-З'.
При работе с новым вариантом тест-системы для подготовки проб к ПЦР использовали набор реактивов «ДНК-сорб Б» (производства ФГУН ЦНИИЭ Роспотребнадзора), основанный на лизисе материала детергентом, с последующей сорбцией ДНК на селикагеле.
Тест-система комплектовалась стандартным реакционным буфером, Taq-пoлимepaзoй, праймерами произведенными и проконтролированными во ФГУН ЦНИИЭ Роспотребнадзора. Амплификацию проводили на наиболее совершенной модели отечественного термоциклера «Терцик МС-2» фирмы «ДНК-технология» (г. Москва).
Повышение качества выделения ДНК, использование более совершенной модели термоциклера и стандартизованных, качественных реактивов увеличило эффективность амплификации. Это позволило и при одноэтапной ПЦР синтезировать достаточное количество фрагмента ДНК, детектируемое методом электрофореза. Поскольку данный вариант ПЦР менее затратен и занимает меньше времени, чем «буст» ПЦР в дальнейших исследованиях использовали одностадийную ПЦР с внешних праймеров.
Новая тест-система, получившая наименование «Amply-Inv», позволила оптимизировать, упростить детекцию шигелл и энтероинвазивных эшерихий и повысить ее качество, что было продемонстрировано при лабораторных испытаниях.
Испытания системы проводили в соответствии с требованиями, предъявляемыми ФГУН ГИСК им. JI.A. Тарасевича Роспотребнадзора. На момент разработки диагностикума мы не смогли найти коммерческих аналогов для проведения сравнительных испытаний, поэтому сравнивали экспериментальную тест-систему с вариантом ПЦР-детекции шигелл и энтероинвазивных эшерихий, предложенным в практическом руководстве "Diagnostic Molecular Microbiology, Principles and application" [152].
Определяли предел измерения (аналитическая чувствительность), чувствительность, специфичность, ценность положительных результатов, ценность отрицательных результатов. Для сравнительных исследований использовали чистые культуры бактерий рода Shigella и фекальные пробы от больных ОКИ.
Выделение ДНК для ПЦР-исследования проводили набором реактивов «ДНК-сорб Б».
ПЦР с использованием экспериментальной тест-системы «Amply-Inv» осуществляли согласно методике, изложенной в разделе «Материалы и методы» данной работы.
ПЦР с применением «контрольной» системы выполняли по инструкции, изложенной в руководстве. Был изменен только метод выявления продукта амплификации. Вместо гибридизации по Саузерну использовали электрофорез в агарозном геле.
В качестве контрольных образцов были использованы препараты ДНК штаммов из рабочей коллекции лаборатории молекулярно-генетических методов надзора за инфекционными заболеваниями ННИИЭМ. -отрицательный контрольный образец (К-) — водный раствор тотальной ДНК
S. typhimurium №1433;
-положительный контрольный образец (К+) - водный раствор тотальной ДНК S.flexneri 2а №38.
Отрицательный контроль. Результаты анализа считали достоверными, если при анализе электрофореграммы в отрицательном контроле отсутствовал фрагмент ДНК размером 760 п. н - специфичный ампликон для тест-системы «Ampli Inv» и фрагмент 348 п.н. - специфичный ампликон для «контрольного» варианта ПЦР.
Положительный контроль. Результаты анализа считали достоверными, если при анализе электрофореграммы в положительном контроле при использовании системы «Amply-Inv» присутствует фрагмент размером 760 п.н. Для «контрольного» варианта ПЦР результаты анализа считали достоверными, если в положительном контроле выявлялся фрагмент размером 348 п.н. Сравнение аналитической чувствительности тест-систем проводили с использованием десятикратных разведений культуры S.flexneri 2а №38. 18-часовую бульонную культуру разводили стерильным физиологическим раствором в 10, 100, 1000, 10000 и 100000 раз. Количество микроорганизмов в разведениях оценивали по количеству колоний, выросших на чашке с МПА после высева по 0.1 мл из каждого разведения.
Тест-система «АмрН Inv» в 100% случаев выявляла Shigella.2a №38 при концентраци клеток в пробе 5x10" кл/мл. Аналитическая чувствительность «контрольной» системы была ниже - 5x103 кл/мл (табл.3.).
Проведено сравнение аналитической чувствительности тест-систем при анализе препаратов нуклеиновых кислот. Концентрацию препарата тотальной ДНК S.flexneri 2а №38 измеряли на спектрофотометре СФ-26 в соответствии с методом, предложенным в руководстве Т.Маниатиса с соавторами [46]?и готовили разведения ДНК от 10"8 г/мл до 10"11 г/мл (табл.4.).
Таблица 3.
Аналитическая чувствительность тест-систем (минимально выявляемое количество клеток 8.Аехпеп 2а №38 в 1 мл.)
|
Концентрация |
Число |
Положительные результаты | |
|
бакт.клеток |
постановок |
|
|
|
(кл/мл) |
ПЦР |
«АмрН-Inv» |
«Контрольная» |
|
5x107 |
5 |
5 |
5 |
|
5x106 |
5 |
5 |
5 |
|
5х105 |
5 |
5 |
5 |
|
5x104 |
5 |
5 |
5 |
|
5x10" |
5 |
5 |
5 |
|
5x102 |
5 |
5 |
1 |
|
50 |
5 |
1 |
0 |
Таблица
4
Аналитическая чувствительность тест-систем (минимальное выявляемое количество ДНК Shigella flexneri 2а №38 в 1 мл)
|
Концентрация ДНК (г/мл) |
Число постановок ПЦР |
ножительные результаты | |
|
«АмрН-Inv» |
контрольная» | ||
|
Ю-8 |
5 |
5 |
|
|
10"у |
5 |
5 |
|
|
10~'° |
5 |
5 |
|
|
10-" |
5 |
5 |
|
Тест-система «Ашр1у-1пу» стабильно выявляла ДНК Б.Пехпеп 2а №38 в концентрации 10"11 г/мл, а "контрольная" система - в концентрации ДНК КЗ"10 г/мл.
Проведено сравнение тест-системы «Ашр1у-1пу» и «контрольной» тест- системы при анализе образцов клинического материала. Исследовано 38 ректальных проб от пациентов с диагнозом дизентерия (в 92% подтвержденном бактериологическим исследованием) и 44 ректальные пробы от больных с желудочно-кишечными заболеванииями неинфекционной природы (энтерит). Бактериальные возбудители ОКИ в них не выявлены. Результаты исследования представлены в таблице 5.
Таблица 5.
Сравнение тест-систем «Атр1у-1пу» и «контрольной» системы по результатам исследования образцов клинического материала.
|
12Результаты исследования тест-системой |
Пробы от больных с диагнозом |
1 Чувствительность |
Специифичность * |
Ожидаемая ценность*** | |||||
|
дизент ерия |
энтерит |
полож. рез-та |
отриц. рез-та | ||||||
|
АмрН 1пу |
| ||||||||
|
положительн. |
37 |
2 |
97,3 ±2,6% |
95,4 ±3,2% |
94,8 ±3,3% |
97,6 ±2,3% | |||
|
отрицательн. |
1 |
42 | |||||||
|
Контрольная |
| ||||||||
|
положительн. |
36 |
2 |
94,7 ±3,6% |
95,4 ±3,2% |
94,7 ±3,4% |
95,4 ±3,2% | |||
|
отрицательн. |
2 |
42 | |||||||
дизентерия к общему количеству проб от этих пациентов. Показатель чувствительности составил:
-для тест-системы «Amply-Inv» - 37/38 х 100 % = 97,3 % для «контрольной» системы - 36/38 х 100% = 94,7%
**Специфичность определяли как процентное отношение количества отрицательных результатов в группе пациентов с желудочно-кишечными заболеваниями неинфекционной природы к общему количеству проб от этих пациентов. Показатель специфичности составил для обеих тест-систем: 42/44 х 100 % = 95,4 %
* * * Ожидаемую ценность положительного результата определяли как процентное отношение количества положительных результатов в группе больных с диагнозом дизентерия к общему количеству положительных проб в обеих группах обследованных. Показатель составил:
-для тест-системы «Amply-Inv» - 37/39 х 100 % = 94,8 % -для «контрольной» системы - 36/38 х 100% = 94,7%
Ожидаемую ценность отрицательного результата определяли как процентное отношение числа отрицательных результатов в группе больных с желудочно-кишечными заболеваниями неинфекционной природы к общему числу отрицательных результатов в обеих группах. Показатель составил:
-для тест-системы «Amply-Inv» - 42/43 х 100 % = 97,6 % -для «контрольной» системы - 42/44 х 100% = 95,4%
При ПЦР-исследовании искусственно контаминированных образцов продуктов питания чувствительность тест-систем составляла от 500 до 1000 клеток на 1г или 1мл пробы.
Сравнительные исследования продемонстрировали, что ПЦР тест- система «Amply-Inv» для выявления ДНК бактерий рода Shigella и энтероинвазивных Escherichia практически по всем определяемым параметрам превосходила «контрольную» тест-систему.
Показатели аналитической чувствительности, практической
чувствительности и специфичности свидетельствуют о том, что тест-система «Amply-Inv» соответствует требованиям, предъявляемым к дииагностическим препаратам подобного класса, и может использоваться в практике здравоохранения для экспресс-детекции шигелл и энтероинвазивных эшерихий. Это было подтверждено при проведении испытаний диагностикума (раздел 2.2.2.2. Использование ПЦР тест-систем для детекции бактерий родов Shigella и Salmonella в санитарно- эпидемиологической и клинической практике).
Параллельно с практическим применением продолжались работы по совершенствованию тест-системы. С 2003 года она комплектуется внутренним контрольным образцом (ВКО), который позволяет выявлять случаи ингибирования ПЦР и тем самым избегать ложноотрицательных результатов. С целью предотвращения контаминации продуктами амплификации и получения ложноположительных результатов тест-система комплектуется системой антиконтаминационной модификации ампликонов На рисунке 1 представлена электрофореграмма ампликонов, полученных с использованием современного варианта тест-системы для детекции шигелл.
1 2 3 4 5 6 7 8 9 10 И 12 13 14 15 16 17 18 Рис. 1. Электрофореграмма продуктов ПЦР. Пример использования тест-системы для выявления бактерий рода Shigella, имеющих ВКО, трек 18 - К+;
треки 8, 13 - положительные пробы, остальные треки - отрицательные пробы, 2.2.1.5. Адаптация отечественных ПЦР тест-систем для выявления бактерий рода Salmonella к практическим исследованиям.
Бактерии рода Salmonella являются одними из наиболее распространенных, социально и экономически значимых возбудителей ОКИ. Разработка технологий для экспресс-детекции сальмонелл является актуальной проблемой. Предложенные ранее методы, основанные на выявлении антигенов сальмонелл, не нашли широкого применения в практической диагностике. В связи с тем, что антигенные детерминанты сальмонелл сходны с аналогичными структурами Е. coli, Citrobacter и ряда других энтеробактерий [89], что приводит к перекрестным реакциям и получению ложноположительных результатов.
В этом разделе работы мы изучали возможность использования отечественных экспериментальных ПЦР тест-систем для экспресс-детекции сальмонелл в смывах с объектов внешней среды, в продуктах питания и клиническом материале.
Первая в Российской Федерации ПЦР тест-система для выявления бактерий рода Salmonella была разработана в фирмой «Ниармедик» в 1994г. Праймеры диагностикума позволяют амплифицировать консервативный участок ДНК арабинозного оперона АгаС сальмонелл.
Согласно инструкции по применению, полученной от разработчиков, тест-система предназначалась для ПЦР-детекции S.typhimurium. Создание тест-системы с такой высокой специфичностью представлялось нам мало вероятным, поскольку различные сероварианты сальмонелл являются генетически близкими формами. В связи с этим, на первом этапе работы была проведена оценка специфичности тест-системы на коллекции чистых культур энтеробактерий. Результаты проверки представлены в таблице 6.
Для всех серовариантов сальмонелл, использованных в качестве тестерных, был получен положительный результат. Праймеры тест-системы не взаимодействовали с микроорганизмами других родов энтеробактерий, включая такие антигенно близкие формы как Citrobacter freutidii 021, 022, 038; Е. coli 0111,044, Oll.
Тест-система наряду с S.typhimurium позволяет выявлять другие сероварианты сальмонелл. Это свидетельствует о ее специфичности на уровне рода, а не на уровне отдельного сероварианта.
Таблица 6
Проверка специфичности ПЦР тест-системы для экспресс-детекции сальмонелл на чистых культурах энтеробактерий
|
Микроорганизм |
Результат ПЦР |
|
Salmonella typhimurium В |
положительный |
|
Salmonella enteritidis D1 |
положительный |
|
Salmonella haifa В |
положительный |
|
Salmonella kottbus C2 |
положительный |
|
Salmonella infantis Q |
положительный |
|
Salmonella senftenberg E4 |
положительный |
|
Citrobacter freundii 021 |
отрицательный |
|
Citrobacter freundii 022 |
отрицательный |
|
Citrobacter freundii ОЗ8 |
отрицательный |
|
Klebsiella pneumoniae |
отрицательный |
|
E. coli Ol 11 |
отрицательный |
|
E. coli Oll |
отрицательный |
|
E. coli 044 |
отрицательный |
Для определения аналитической чувствительности тест-системы были выбраны штаммы доминирующих серовариантов Б^урЫтигшт и 8.еп1егШё1з. В экспериментах с десятикратными разведениями культур
тестерных штаммов для каждого из них была установлена аналитическая
"3
чувствительность 10 кл/мл.
При постановке ПЦР согласно инструкции к тест-системе наблюдался неспецифический синтез. Кроме этого, предложенная авторами программа амплификации сложная и громоздкая, включает пять стадий.
|
горячий старт |
93°С 10 мин |
1 цикл |
|
денатурация ДНК |
93°С 1 мин. 60°С 1 мин. 72°С 1,5 мин. |
5 циклов |
|
отжиг праймеров | ||
|
синтез фрагмента | ||
|
денатурация ДНК |
93°С 1 мин. 57°С 1 мин. 72°С 2 мин. |
5 циклов |
|
отжиг праймеров | ||
|
синтез фрагмента | ||
|
денатурация ДНК |
93°С 1 мин. 55°С 1 мин. 72°С 3 мин. |
25 циклов |
|
отжиг праймеров | ||
|
синтез фрагмента | ||
|
денатурация ДНК |
93°С 1 мин 55°С 4 мин. 72°С 7 мин. |
1 цикл |
|
отжиг праймеров | ||
|
синтез фрагмента |
На этапе адаптации тест-системы на основании результатов экспериментов с культурами бактерий и контаминированными субстратами были внесены изменения в состав реакционной смеси: на 25% уменьшено количество праймеров - с 4 до 3 мкл (по 1,5 мкл каждого) на одно исследование, объем вносимой бидистиллированной воды соответственно увеличился с 4 до 5 мкл. Изменена программа амплификации: горячий старт сократили до 4-х минут, процесс проводили при одной температуре отжига праймеров: 57° С, температуру денатурации повысили до 94° С После адаптации исследование проводили по следующей программе:
|
горячий старт |
94°С 4 мин. |
1 цикл |
|
денатурация ДНК |
94°С 1 мин. 57°С 1 мин. 72°С 1 мин. |
35 циклов |
|
отжиг праймеров | ||
|
синтез фрагмента |
Оптимизация программы и состава реакционной смеси позволила сократить продолжительность исследования и получить более качественные электрофореграммы продуктов амплификации.
При проведении исследований клинического материала, смывов с объектов внешней среды, продуктов питания был выявлен ряд недостатков данного диагностикума. Для стабильной работы тест-системы было необходимо подращивание исследуемого материала в накопительной хлор- магниевой среде, что приводило к усложнению исследования и увеличению его продолжительности.
Вторая тест-система для детекции бактерий рода Salmonella, «Ампли- сенс - Salmonella species 250» разработки ФГУН ЦНИИЭ Роспотребнадзора, апробированная нами, является диагностикумом следующего поколения. Она, как и другие системы серии «Ампли-сенс», представляет комплект из двух реакционных смесей. Праймеры, входящие в состав тест-системы, позволяют амплифицировать фрагмент гена белка фимбрий сальмонелл размером 225 п.н.
В таблице 7 представлены результаты сравнения тест-системы «Ампли- сенс - Salmonella species 250» и тест-системы для детекции сальмонелл разработки фирмы «Ниармедик» Москва
.Таблица 7
Сравнительная характеристика отечественных экспериментальных ПЦР тест- систем для экспресс-детекции бактерий рода Salmonella первого и втрого поколений
|
Тест-система |
Комплек тация |
Длительн. анализа |
Чувствитель ность кл/мл |
Специфич ность |
Подращи вание |
|
Тест-система фирмы «Ниармедик» |
Все реактивы отдельно |
26 часов |
1000 |
95% |
Требует ся |
|
Тест-смстема «Амплисенс- Salmonella species 250» |
Реактивы в составе 2-х реакц. смесей |
6-8 часов |
500 |
95% |
Не требу ется |
Проведенные исследования выявили преимущества экспериментальной ПЦР тест-системы «Ампли-сенс-Salmonella species 250» разработки ФГУН ЦНИИЭ Роспотребнадзора. По своим рабочим характеристикам она наиболее полно соответствует требованиям практической медицины. Чувствительность новой системы в 2 раза выше. Применение на стадии подготовки проб сорбционной технологии и более удобное комплектование реактивов делает тест-систему ЦНИИЭ более технологичной и простой в работе. Отсутствие стадии подращивания исследуемых проб сокращает продолжительность исследования.
Все дальнейшие исследования проводились нами с использованием тест-системы «Ампли-сенс-Salmonella species 250».
2.2.1.6. Адаптация ПЦР тест-системы для выявления генов токсина и адгезинов V.holerae.
При проведении работ в соответствии с наставлением по применению тест-системы, представленным разработчиком (НИИ микробиологии МО, г. Киров) не удалось получить интерпретируемые результаты, в связи с низкой
эффективностью ПЦР и наличия неспецифического синтеза в положительных контролях и исследуемых образцах. В ходе адаптации тест системы были внесены следующие изменения: для проведения ПЦР использован принцип верхней и нижней реакционных смесей, в качестве нижней смеси использовались праймеры и дезоксинуклеотидтрифосфаты из комплекта данной тест-системы, в качестве верхней была использована универсальная верхняя реакционная ПЦР-смесь производства ФГУН «ЦНИИЭ Роспотребнадзора»; программа амплификации, основанная на регулировании процесса по температуре матрицы, заменена на программу с активным регулированием, температура на стадии отжига праймеров увеличена на 2° С (см раздел 2.1. Материалы и методы). 2.2.1.7. Адаптация ПЦР тест-систем для выявления H.pylori.
Нами были апробированы три отечественные тест-системы: «Helicobacter» (СП «Ниармедик», Москва), «АмплиСенс-Helicobacter pylori- 520» (ФГУН ЦНИИЭ Роспотребнадзора) и «Хеликопол II» (фирмы «Литех», Москва). Специфичность этих систем показана разработчиками и рядом авторов [16, 47]. По их данным, праймеры гибридизовались с геномом H.pylori и не взаимодействовали с ДНК близкородственных видов (C.jejuni, С. fetus, С. venereae) и рядом других микроорганизмов (V.cholerae, F.tularensis, Y.pestis, Y. pseudotuberculosis, Y.enterocolitica, E.coli, L.pneumofila, L.interrogans), а также с ДНК человека и теленка [47]. Проведенные нами исследования с препаратами хромосомной ДНК бактерий родов семейства Enterobacteriaceae (Escherichia, Salmonella, Shigella, Klebsiella, Enterobacter, Citrobacter) также подтвердили специфичность тест- систем.
Первой на отечественном рынке появилась тест-система «Helicobacter» производства СП «Ниармедик» (Москва), выявляющая фрагмент гена 16SpPHK H.pylori размером 209 п.н.
При исследовании биоптатов слизистой желудка тест-системой «Helicobacter» по инструкции разработчиков, кроме амплификации специфического фрагмента синтезировались фрагменты ДНК размером - 500 п.н. и 2000 п.н. (рис. 2, 3). Они присутствовали как в Н. pylori положительных, так и отрицательных образцах.
12
34 56 78 К+
2000
п.н
500
п.н.
209
п.н.
Рис.
2. Электрофореграмма продуктов
амплификации биоптатов слизистой
желудка.
ПЦР проведена в соответствии с
инструкцией разработчиков
123456
78 К+
Рис.
3. Электрофореграмма продуктов
амплификации биоптатов слизистой
желудка.
ПЦР проведена при уменьшении количества
праймеров,
трифосфатов и фермента до 90% от рекомендуемых разработчиками норм и сокращении стадии элонгации цепи с 5 до 3 мин.
Неспецифические фрагменты ухудшали качество электрофореграмм и зарудняли интерпретацию резултата. Было предположено, что фрагменты в 500 п.н. и 2000 п.н. образуются при амплификации участков геномной ДНК. Освободиться от балластных нуклеиновых кислот без потери специфической ДНК-мишени невозможно. Для снижения эффективности неспецифического синтеза была проведена серия экспериментов:
амплификация в обедненной реакционной смеси (уменьшение количества праймеров, нуклеотидтрифосфатов, Тац-полимеразы);
амплификация с менее продолжительной стадией синтеза цепи;
амплификация при увеличении температуры отжига праймеров.
Количество праймеров, трифосфатов и фермента было сокращено до 80% от нормы, температура отжига праймеров увеличена с 66°С до 67°С и продолжительность стадии синтеза уменьшена с 4 до 2,5 мин. При данном режиме были получены наиболее качественные результаты.
Оптимизация состава реакционной смеси и программы амплификации позволила значительно снизить уровень неспецифического синтеза, не уменьшая объема амплификации специфического фрагмента. Сохранение синтеза неспецифических фрагментов при оптимизированной ПЦР свидетельствовало о не достаточно качественном дизайне праймеров тест- системы.
При использовании тест-системы фирмы «Ниармедик» для исследования проб желудочного сока неспецифический синтез ДНК, как правило, не наблюдался. Это объясняется низким содержанием эукариотической ДНК в желудочном соке по сравнению с биоптатом.
Апробация ПЦР тест-систем второго поколения. Были апробированы тест-система «Хеликопол II» производства фирмы «Литех», Москва, амплифицирующая участок гена уреазы (игеС) Н.ру1оп размером 492 п.н.
и
тест-система «АмплиСенс-Helicobacter pylori-520» производства ФГУН «ЦНИИЭ Роспотребнадзора», амплифицирующая фрагмент гена 16SpPHK размером 520 п.н. Эти тест-системы были совершеннее, чем «Helicobacter». Они обладали достаточно близкими рабочими характеристиками: были удобны в работе и имели удачно подобранные праймеры. При сравнительном исследовании тест-система «АмплиСенс-Helicobacter pylori-520» показала более высокую чувствительность (рис. 4).
При работе с этими тест-системами не было необходимости варьировать состав реакционной смеси. Мы изменили лишь программу амплификации - температура отжига праймеров была увеличена на 2°С. Поскольку такое изменение положительно сказалось на работе обеих тест систем, можно предположить, что это связано с индивидуальными особенностями амплификатора, использованного в работе.
ПЦР тест система «АмплиСенс-Н.ру1оп-520»
ПЦР тест-система «Хеликопол II»
исх. 10"310"2 10"3 КГ4 10"5 10"6 10"7 К+ проба
Рис. 4. Сравнение чувствительности ПЦР тест-систем «АмплиСенс-H.pylori- 520» и «Хеликопол II» при выявлении Н. pylori в десятикратных разведениях ДНК, выделенной из пробы желудочного сока.
• 7
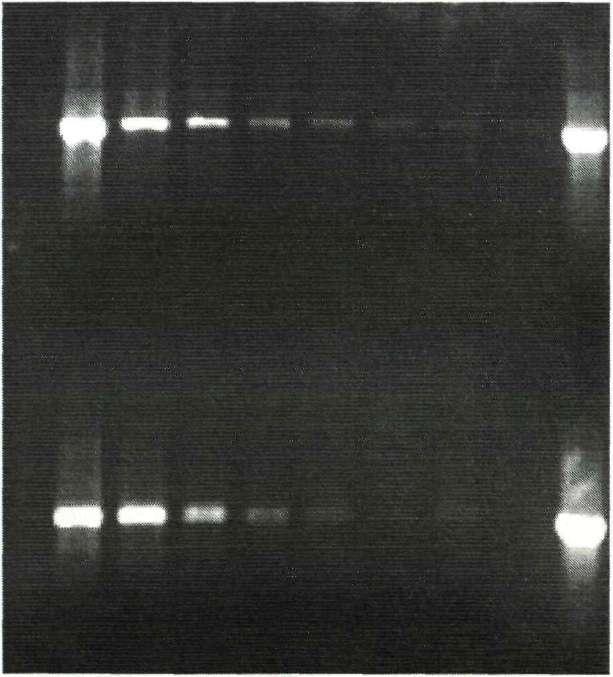
м
присутствовал специфический фрагмент при работе с тест-системой «Хеликопол II» - 10"6. В дальнейших исследованиях использовалась ПЦР тест-система «АмплиСенс-НеПсоЬас1ег ру1оп-520» ФГУН «ЦНИИЭ Роспотребнадзора», так как она имела большую чувствительность и была удобнее в работе.
Контроль ингибирования ПЦР. Все отечественные ПЦР тест-системы для выявления Н.ру1оп не содержат компонентов, позволяющих контролировать возможность ингибирования ПЦР. Для решения этой задачи используется внутренний контрольный образец (ВКО) - фрагмент ДНК, содержащий на концах участки гомологичные праймерам тест-системы. ВКО вводится в пробу на стадии подготовки и проходит все этапы выделения ДНК. При положительном исходе ПЦР синтезируются два фрагмента: специфический фрагмент ДНК-мишени и фрагмент, синтезирующийся с ВКО. Размер ВКО должен отличаться от размера специфического фрагмента. Как правило, он больше специфического, и в процессе электрофореза образуются две полосы, верхняя соответствует ВКО, нижняя - ДНК мишени (рис. 5).
Количество ВКО, вносимое в пробу, рассчитывается таким образом, чтобы он минимально конкурировал со специфической мишенью за компоненты реакционной смеси и не снижал чувствительность тест-системы.
При высокой концетрации ДНК-мишени возможен синтез только специфического фрагмента, при этом на электрофореграмме наблюдается одна яркая полоса, (рис 12 трек К+). При отрицательном результате синтезируется только фрагмент ВКО. Отсутствие полос на электрофореграмме свидетельствует об ингибировании ПЦР. В этом случае требуется повторная обработка пробы.
Специфический ВКО в тест-системе «АмплиСенс-Helicobacter pylori- 520» отсутствует, поэтому в его качестве был использован универсальный внутренний контрольный образец (УВКО) тест-систем для детекции возбудителей урогенитальных инфекций ФГУН «ЦНИИЭ Роспотребнадзора». Пробы, в которых H.pylori не был выявлен, амплифицировали с праймерами для U.urealyticum. Отсутствие фрагмента УВКО U.urealyticum размером 750 п.н. свидетельствовало об ингибировании реакции иложноотрицательном результате при выявлении H.pylori.
Этим методом была оценена вероятность ложноотрицательных результатов ПЦР-детекции H.pylori. Из 46 образцов биоптатов слизистой желудка, обработанных с помощью «ДНК-сорб А», ингибирование ПЦР наблюдалось в 4 случаях. При использовании для подготовки тех же проб «ДНК-сорб Б», в котором предусмотрена дополнительная отмывка буфером, содержащим гуанидинизотиоцианат, ингибирование ПЦР не отмечалось.
В дальнейших исследованиях подготовку проб биоптатов и желудочного сока проводили только «ДНК-сорб Б». УВКО добавляли в каждую пробу, чтобы в спорной ситуации имелась возможность выявлять иРазработка полуколичественного варианта ПИР детекции Н.ру1оп для контроля эффективности антихеликобактерной терапии.
Большинство существующих методов диагностики не позволяют осуществлять ранний контроль эффективности антихеликобактерной терапии. Для решения этой задачи нами разработан полу количественный вариант ПЦР, позволяющий оценивать изменения уровня обсемененности слизистых Н.ру1оп до и после лечения. Ранее проведенные исследования показали, что наиболее интегративным и информативным субстратом для ПЦР-детекции Н.ру1оп является утренняя тощаковая порция желудочного сока. Метод базируется на ПЦР обнаружении хеликобактера в десятикратных разведениях ДНК, выделенной из проб желудочного сока до и после лечения. Н.ру1оп выявляется в разведениях в 10, 100. 1000 раз. Применение метода на практике описано в главе ПЦР в диагностике хеликобактерной инфекции и изучении ее возбудителя.
Адаптация ПЦР тест-системы для выявления гена вакуолизирующего цитотоксина Н.ру1оп УасА.
Затруднения возникли при выявлении гена УасА Н.ру1оп с использование тест-системы «Хеликопол УА» фирмы Литех г. Москва. Она имела сложную комплектацию - содержала три пары праймеров для выявления аллельных б и гп вариантов. Первая пара при проведении ПЦР дискриминирует варианты и б2 (синтезируется один из двух фрагментов, различающихся по размеру - 259 п.н. для и 286 п.н. для б2). Вторая и третья пары выявляют в отдельных ПЦР реакциях т1 и т2 аллели, при этом синтезируются фрагменты размером 352 п.н. и 290 п.н. соответственно. Таким образом, для определения УасА-генотипа необходимо проведение трех отдельных ПЦР.
При апробации трех комплектов праймеров на положительном контроле и клинических пробах в соответствии с инструкции по применению наблюдался синтез большого количества различных по размеру фрагментов ДНК, среди которых невозможно было выделить специфические варианты.
Кроме того, ряд проб при наличии реакции с праймерами на ш-участок УасА-гена не взаимодействовали с праймерами к участку э; имелись и обратные варианты, с наличием синтеза с праймерами к аллелям э, и не дающие синтеза с праймерами к аллелям т.
С целью снижения эффективности неспецифического синтеза была проведена оптимизация условий проведения ПЦР. Повышение температуры на стадии отжига на 2°С (для праймеров на аллели ш1, б2), на 3°С (для праймеров на аллель т2) и снижение количества праймеров, дезоксинуклеотидтрифосфатов и Тац-полимеразы до 80% от нормы позволило существенно уменьшить количество неспецифических фрагментов. Для тест-системы на аллель ш1 была получена однозначная картина - в контроле и положительных пробах синтезировался только специфический фрагмент. С праймеров на аллели и з2 во всех пробах продолжали синтезироваться фрагменты размером ориентировочно 500п.н. и 700 п.н., которые не мешали интерпретации результата. С праймеров на аллель ш2 при амплификации во всех исследуемых образцах синтезировались 2-3 крупных фрагмента с размерами в интервале 800-1000 п.н. Наличие крупных неспецифических фрагментов не мешало дискриминации на электрофореграммах специфических фрагментов. Следует отметить, что неспецифические фрагменты, сохранившиеся после повышения температуры отжига праймеров, синтезировались более эффективно, чем специфические. При дальнейшем подъеме температуры отжига они продолжали синтезироваться, в то время как образование специфических фрагментов практически прекращалось. Таким образом, проведенная оптимизация условий ПЦР позволила добиться интерпретируемых результатов. Сохранение эффективного
неспецифического синтеза свидетельствовало о недостатках дизайна праймеров. В дальнейшем все исследования на аллельные варианты гена УасА проводились по модернизированным программам.
2.2.1.10. Выбор и адаптация ПЦР тест систем для выявления возбудителей вирусных гепатитов и НУГИ.
ПЦР детекция возбудителей вирусных гепатитов и НУГИ являются наиболее коммерчески выгодными и востребованными направлениями. Разработке ПЦР тест-систем на данные инфекционные агенты уделялось существенное внимание, поэтому среди отечественных диагностикумов эти тест-системы наиболее качественные и представлены большим количеством вариантов. По техническим характеристикам, простоте и удобству проведения исследования предпочтительнее других были тест-системы производства ФГУН «ЦНИИЭ Роспотребнадзора» и фирмы «Изоген» (Москва). Системы серии «Ампли-сенс» ФГУН «ЦНИИЭ Роспотребнадзора», представляют собой комплекс из двух реакционных смесей: нижней, состоящей из праймеров и нуклеотидтрифосфатов и верхней, состоящей из компонентов буфера для проведения ПЦР, Tag- полимеразы, красителя для электрофореза. Нижняя смесь внесена в пробирки 0,5 мл или 0,2 мл и запечатана пробкой из легкоплавкого воска. Для проведения исследования в пробирки добавляется ПЦР-смесь-2, сверху наслаивается минеральное масло, под которое вносится исследуемый образец, после чего проба готова к ПЦР. В тест-системах «Изоген» большая часть компонентов реакционной смеси лифилизирована в микропробирке. Подготовка к проведению ПЦР заключается в растворении осадка элюентом, входящим в состав диагностикума, наслаивании минерального масла и внесении под него пробы. Эти варианты подготовки минимизирует манипуляции с компонентами реакционной смеси, что уменьшает вероятность контаминации и позволяет избежать ложноположительных результатов. Достоинством тест-систем «АмплиСенс» и «Изоген» является также то, что для выявления M.hominis, U.urealyticum, C.trachomatis, Cytomegalovirus, Herpes simplex I/II используются единые универсальные программы амплификации. Кроме этого у систем «АмплиСенс» исключается возможность низкотемпературного неспецифического синтеза, поскольку реакция полимеризации ДНК начинается только после плавления восковой перегородки при 95° С.
Для проведения исследований возбудителей вирусных гепатитов и НУГИ нами были выбраны тест-системы «АмплиСенс». Это сделано по двум причинам: у них температура отжига праймеров выше, чем у систем «Изоген», что способствует более высокой специфичности исследования; продолжительность программы амплификации у диагностикумов «АмплиСенс» практически в 2 раза меньше, это сокращает продолжительность исследования и способствует более длительной эксплуатации амплификаторов. Адаптация к практическим исследованиям систем «АмплиСенс» особых проблем не вызвала. При работе на определенных амплификаторах была на 1 -2° С увеличена температура отжига праймеров.
2.2.1.11. Разработка полуколичественного варианта ПЦР для детекции ВГВ и ВГС. Этот вариант был разработан для оценки вирусной нагрузки и эффективности противовирусной терапии. Основными критериями для метода являлись максимально низкая себестоимость, простота исполнения и максимально возможная информативность и достоверность. Предложенная схема базируется на использовании классического варианта ПЦР с элекрофоретической детекцией продукта амплификации.
Для оценки концентрации вируса был использован метод десятикратных серийных разведений. Нами были изучены три варианта:
-при первом варианте разводили плазму или сыворотку из каждого разведения выделяли нуклеиновые кислоты, для каждого проводили обратную транскрипцию и ПЦР;
-при втором варианте из сыворотки или плазмы выделяли нуклеиновые кислоты, делали их десятикратные разведения, для каждого из них проводили обратную транскрипцию и ПЦР;
-при третьем варианте из сыворотки или плазмы выделяли нуклеиновые кислоты, осуществляли одну реакцию обратной транскрипции, делал
и
десятикратные серийные разведения полученной к-ДНК и для каждого из них проводили ПЦР.
Анализировали разведения в 10, 100, и 1000 раз. Результаты, полученные при использовании любого из трех вариантов, оказались идентичными. Для определения вирусной нагрузки был выбран вариант 3 как самый экономичный и непродолжительный. В этом варианте проводится однократное выделение нуклеиновых кислот и одна обратная транскрипция, а на последней стадии осуществляется несколько ПЦР, соответствующих количеству разведений.
Экспериментально было установлено, что минимально достаточно проанализировать для ДНК-содержащих вирусов (ВГВ, ТТУ) разведения в 10, 100 и 1000 раз; для РЖ - содержащих (ВГА, ВГС, ВГО, ВГО) - разведения в 10 и 100 раз.
Расчет
вирусной нагрузки ВГВ в соответствии
с результатом ПЦР- исследования
десятикратных серийных разведений.
|
Таблица
8. |
Результат ПЦР* |
| ||||
|
Вариант |
Разведение ДНК |
Вирусная | ||||
|
результата |
1 |
1 : 10 |
1 : 100 |
1 :1000 |
нагрузка | |
|
1 |
+ |
- |
- |
- |
Не более 102 ч/мл | |
|
2 |
+ |
+ |
- |
- |
Не более 103 ч/мл | |
|
3 |
+ |
+ |
+ |
- |
Не более 104 ч/мл | |
|
4 |
+ |
+ |
+ |
+ |
Не менее 103 ч/мл | |
*
+ положительный результат в ПЦР; -
отрицательный результат в ПЦР
|
Таблица
9. |
Результат ПЦР* |
| |||
|
Вариант результата |
Разведение к-ДНК |
Вирусная нагрузка | |||
|
1 |
1 : 10 |
1 : 100 | |||
|
1 |
+ |
- |
- |
Не более 10 ч/мл | |
|
2 |
+ |
+ |
- |
Не более 104 ч/мл | |
|
3 |
+ |
+ |
+ |
Не менее 105 ч/мл | |
*
+ положительный результат в ПЦР; -
отрицательный результат в ПЦР
Приведенный выше вариант ПЦР, названный нами полуколичественным, оказался достаточно объективным и информативным для определения вирусной нагрузки и оценки эффективности противовирусной терапии. Он значительно дешевле исследований с применением тест-систем, использующих гибридизационно-ферментное выявление продукта, и ПЦР, базирующейся на технологии «Real time».
Расчет
вирусной нагрузки ВГС в соответствии
с результатом ПЦР- исследования
десятикратных серийных разведений.
На данном этапе работы проводилось определение роли и места ПЦР в комплексе методов диагностики бактериальных ОКИ, разработка оптимальных алгоритмов применения ПЦР в клинической практике и в системе эпиднадзора за ОКИ.
2.2.2.1. Изучение распространенности генов факторов патогенности бактериальных возбудителей ОКИ с использованием молекулярно- биологических методов
Большая часть бактериальных возбудителей ОКИ успешно культивируется в лабораторных условиях, их выявление и идентификация базируется на микробиологических и серологических методах. В то же время имеется ряд областей, связанных с изучением ОКИ, в которых необходимо и целесообразно использование молекулярно-биологических методов. Одним из таких разделов является выявление энтеробактерий, продуцирующих факторы патогенности (токсины, факторы адгезии и инвазии). Наличие факторов патогенности обусловливает эпидемическую значимость штаммов энтеробактерий и их способность инициировать инфекционный процесс в макроорганизме. При этом совокупность различных факторов патогенности определяет симптомокомплекс и тяжесть заболевания.
Исследовались культуры бактерий различных родов семейства Enterobacteriaceae: Shigella, Salmonella, Escherichia, Klebsiella, Enterobacter, Hafnia на наличие генов термолабильного (LT), термостабильного (ST), шигаподобного (VT) токсинов и фактора инвазии (Inv). В 1986-1994 гг. для выявления генов патогенности применялись ДНК зонды (разработка
; лаборатории). Анализ осуществлялся методом гибридизации колоний. С 1994
{
по настоящее время исследования осуществляются методом ПЦР. Использовали лабораторные (in hause) тест системы и коммерческие
)диагностикумы производства ФГУН «ЦНИИЭ Роспотребнадзора» и Кировского НИИМ МО. Полученные результаты представлены в таблице 10
Таблица 10.
Распространенность генов факторов патогенности у представителей семейства ЕгйегоЬа^епасеае (1985-2006 гг.).
|
Энтеробактерии |
Исследовано штаммов |
Частота выявления генов факторов патогенности (в абс.ч.) | ||||||
|
VT1 |
VT2 |
LT |
ST |
Inv | ||||
|
Shigella |
542 |
23 |
- |
- |
- |
536 | ||
|
Escherichia |
284 |
21 |
- |
- |
- |
6 | ||
|
Salmonella |
505 |
- |
- |
- |
- |
- | ||
|
Klebsiella,Enterobacter, Citrobacter, Haffnia |
297 |
|
|
|
|
| ||
Среди клинических изолятов бактерий родов Shigella, Escherichia, Salmonella, Klebsiella, Enterobacter, Citrobacter, Haffnia не было выявлено штаммов, продуцирующих термолабильный и термостабильный энтеротоксины. Работоспособность зондов и ПЦР тест-систем в отношении этих маркеров подтверждена положительными результатами с коллекционными штаммами, полученными ранее из ГУ НИИЭМ РАМН им. Н.Ф.Гамалеи.
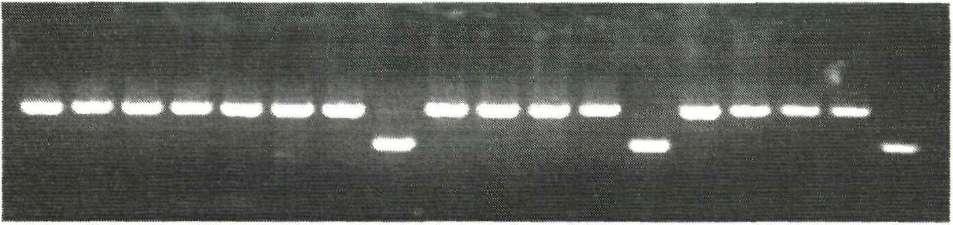
Из генов токсинов выявлялся только ген шигатоксина первого типа VT1. В 1994 г. он был обнаружен у 10 клинических изолятов энтеробактерий, выделеных от больных граждан Вьетнама с тяжелым течением ОКИ (рис. 6). Выделенные от них штаммы окончательно идентифицировать не удалось. По биохимическим свойствам они занимали промежуточное положение между шигеллами и эшерихиями и поступили на исследование как атипичные Е. coli. Возможно, это была инфекция, обусловленная E.coli 0157:Н7. Но на то
т
123456789
10
Рис.
6. ПЦР-исследование штаммов E.coli
с
использованием праймеров к
гену
шигаподобного токсина VT1
1,10- гидролизат ДНК фага А, эндонуклеазой Hind III
