
moskvich_fizika
.pdf•Уравнение первого начала применимо как к равновесным, так и к неравновесным процессам. Оно не запрещает полностью преобразовать количество теплоты, полученное системой, в макроскопическую работу.
•Первое начало запрещает существование вечного двигателя первого рода, т.е. машины, совершающей работу без затрат энергии и без поступления количества теплоты извне.
Фундаментальное и прикладное значение постулата
Первое начало дает математическое выражение количественной стороны закона сохранения и превращения энергии в термодинамических системах, позволяет решать множество прикладных задач, например, таких как:
•Определение теплоёмкостей макросистем в различных процессах и установление связей между ними.
•Вывод уравнений различных процессов.
•Вычисление показателей эффективности тепловых машин.
•Расчёт теплового эффекта химических реакций.
Далее мы рассмотрим большинство из перечисленных следствий и приложений первого начала.
9.2. Теплоёмкость
Микроскопическую природу этого физического свойства макросистем мы с вами уже обсуждали и даже научились вычислять теплоёмкости многоатомных газов и твердых тел путем подсчёта числа статистических степеней свободы. Далее мы продолжим обсуждение предмета в рамках феноменологического, то есть термодинамического подхода.
Напомним определение теплоёмкости:
Теплоемкостью называется количество теплоты, которое нужно сообщить системе, чтобы изменить ее температуру на 1 К.
Главный вывод из ранее изученного материала заключается в том, что теплоёмкость зависит как от свойств макросистемы, так и от самого процесса передачи энергии. Теплоёмкости при постоянном объёме и при постоянном давлении играют важную роль, поскольку без их знания невозможно проведение полного термодинамического анализа системы. На схеме 9.2.1 приведены термодинамические определения и .
Как видно из схемы наш список функций состояния пополнился тремя величинами. Это энтальпия и теплоемкости и . Отметим, что теплоемкость в любом другом процессе является функцией процесса, а не функцией состояния. Первое начало термодинамики позволяет найти значения теплоемкостей в различных процессах и установить связь между ними.
101

|
|
|
|
|
|
|
|
|
|
|
|
Схема 9.2.1. |
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
Определение теплоёмкостей |
и . |
|
|
|
|
|||||
|
|
|
|||||||||||
Теплоёмкость при постоянном объёме |
Теплоёмкость при постоянном давлении |
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
δ |
. |
|
|
|
|
|
δ |
. |
|
|
|
При постоянном объёме |
|
, сле- |
При постоянном давлении |
|
, поэтому |
|
|||||||
довательно, |
|
=0, |
и первое |
начало |
первое |
начало |
термодинамики |
принимает |
|
||||
|
|
|
|
0 |
|
|
|||||||
термодинамики принимает вид |
|
|
вид |
|
|
|
|
0 |
|
|
|||
|
δ |
|
. |
|
|
|
|
|
|
|
. |
|
|
|
δ |
|
|
|
δ |
|
|
|
|
|
|
||
Следовательно |
|
– полный диф- |
Следовательно |
|
– полный дифферен- |
|
|||||||
ференциал, а выражение для |
можно |
циал, а выражение для |
можно записать в |
|
|||||||||
|
|
δ |
|
|
|
|
|||||||
записать в виде |
|
|
|
|
δ |
виде |
|
|
|
|
|||
|
|
|
. |
|
9.4 |
|
|
|
. |
|
9.5 |
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
Где |
|
функция состояния, назы- |
|
||||
Согласно (8.1) |
- функция состояния |
|
ваемая энтальпией. |
|
|
|
|||||||
Согласно (8.1) – функция состояния. |
|
||||||||||||
|
|
|
|
|
|
||||||||
Связь между теплоёмкостями |
и |
(общий случай) |
|
|
|||||||||
Описание системы
Рассматриваемая термодинамическая система является закрытой, т. е. она может обмениваться энергией с окружающей средой.
Актуальная информация о процессе и системе |
|
|
• Процесс теплообмена является квазистатическим. |
, . |
|
• Известно термическое уравнение состояния данной системы |
||
• Известно калорическое уравнение состояния |
, . |
|
|
||
102

Постановка задачи
Найти соотношение между молярными теплоёмкостями и
Вывод формулы
• Воспользовавшись записью первого начала термодинамики в дифференциальной форме (9.2), получим выражение для теплоёмкости произвольного процесса:
δ
, 9.6
• Представим полный дифференциал внутренней энергии через частные производные по параметрам и :
.
После чего формулу (9.6) перепишем в виде
. 9.7
Соотношение (9.7) имеет самостоятельное значение, поскольку определяет теплоёмкость в любом термодинамическом процессе и для любой макроскопической системы, если известны калорическое и термическое уравнения состояния.
Рассмотрим процесс при постоянном давлении |
α |
и получим об- |
||||||
щее соотношение• |
между |
и . |
|
|||||
Ответ: |
|
|
|
|
. |
|
9.8 |
|
|
|
|
||||||
Исходя из полученной формулы, можно легко найти связь между теплоемкостями и в идеальном газе. Этим мы и займемся. Впрочем, ответ уже известен, мы его активно использовали в 7.5.
103

Уравнение Роберта Майера
Выразим частные производные в правой части уравнения (9.8), с помощью термического и калорического уравнений, записанных для одного моля идеального газа. Внутренняя энергия идеального газа зависит только от температуры и не зависит от объёма газа, следовательно
0. 9.9
Из термического уравнения легко получить
,следовательно |
|
|
|
. |
9.10 |
|
|
Подставим (9.9) и (9.10) в (9.8), тогда
0 .
Окончательно запишем
9.11
Вы, надеюсь, узнали (9.11). Да, конечно, это уравнение Майера. Еще раз напомним, что уравнение Майера справедливо только для идеального газа.
9.3. Политропические процессы в идеальном газе
Как отмечалось выше первое начало термодинамики можно использовать для вывода уравнений процессов, происходящих в газе. Большое практическое применение находит класс процессов, называемых политропическими.
Политропическим называется процесс, проходящий при постоянной теплоемкости .
Уравнение процесса задается функциональной связью двух макроскопических параметров, описывающих систему. На соответствующей коорди-
натной плоскости |
|
|
уравнение процесса наглядно представля- |
ется в виде графика - |
кривой процесса. Кривая, изображающая политропиче- |
||
, |
или |
|
|
ский процесс, называется политропой. Уравнение политропического процесса для любого вещества может быть получено на основе первого начала термодинамики с использованием его термического и калорического уравнений со-
104

стояния. Продемонстрируем, как это делается на примере вывода уравнения процесса для идеального газа.
Вывод уравнения политропического процесса в идеальном газе
• Требование постоянства теплоёмкости |
в процессе позволяет запи- |
сать первое начало термодинамики в виде |
9.12 |
. |
• Используя уравнение Майера (9.11) и уравнение состояния идеального газа, получаем следующее выражение для
. 9.13
• Разделив уравнение (9.12) на T и подставив в него (9.13) придем к выражению
0. 9.14
• Разделив (9.14) на |
, находим |
0 9.15
• Интегрированием (9.15), получаем
|
1 |
|
const, |
|
|
9.16 |
||
где |
|
|
|
. |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
||
Это уравнение политропы в переменных |
|
|
|
|||||
Исключая из уравнения ( |
) |
, с помощью, . |
равенства |
/ |
по- |
|||
лучаем уравнение политропы в |
переменных |
, |
|
|
|
|||
9.16 |
|
|
|
|
9.17 |
|||
|
|
|
const, |
|
|
|||
105
где |
|
|
|
. |
9.18 |
|
|
|
|
||
|
|
|
|
||
Параметр |
называется показателем политропы, который может прини- |
||||
ные, целые и |
|
9.18 |
|
|
|
мать согласно ( |
) самые разные значения, положительные и отрицатель- |
||||
|
дробные. За формулой ( |
) скрывается множество процессов. |
|||
9.17
Известные вам изобарный, изохорный и изотермический процессы являются частными случаями политропического.
К этому классу процессов относится также адиабатный или адиабатический процесс. Адиабатным называется процесс, проходящий без теплообмена (δ 0). Реализовать такой процесс можно двумя способами. Первый способ предполагает наличие у системы теплоизолирующей оболочки, способной изменять свой объем. Второй – заключается в осуществлении столь быстрого процесса, при котором система не успевает обмениваться количеством теплоты с окружающей средой. Процесс распространения звука в газе можно считать адиабатным благодаря его большой скорости.
Из определения теплоемкости следует, что в адиабатическом процессе
|
0. Согласно 9.18 |
|
|
γ |
|
, |
9.19 |
|
где |
γ |
– показатель адиабаты. |
|
|
||||
|
|
|||||||
|
В этом случае уравнение политропы принимает вид |
9.20 |
||||||
|
|
|
|
|
|
|
const, |
|
|
|
Уравнение адиабатного процесса (9.20) называют также уравнением |
||||||
Пуассона, поэтому параметр |
|
часто именуют постоянной Пуассона. Посто- |
||||||
|
|
γ |
характеристикой газов. Из опыта следует, что ее |
|||||
янная является важной |
|
γ |
|
|
|
|
||
значения для разных газов лежат в интервале 1,30 ÷ 1,67, поэтому на диаграмме процессов адиабата «падает» более круто, чем изотерма.
Графики политропических процессов для различных значений представлены на рис. 9.1.
106
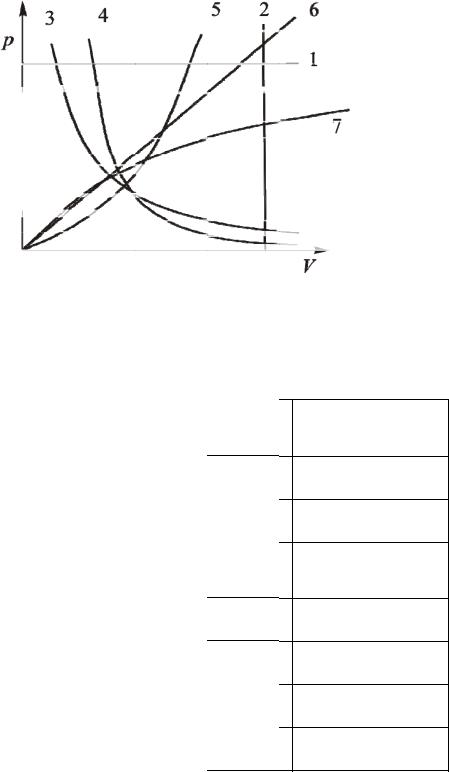
Рис. 9.1 .
На рис. 9.1 графики процессов пронумерованы в соответствии с таб л. 9.1.
|
|
|
|
|
|
|
|
Н омер полит- |
Знач ение показа- |
Уравнение по- |
|||||
р опы на рис. |
теля политроп ы |
литропы ( |
|||||
1 |
|
const)st |
|||||
9.1 |
|
|
|
con |
|||
|
0 |
|
|
||||
2 |
∞ |
|
|
const |
|||
3 |
1 |
|
|
|
, |
|
|
|
|
||||||
|
|
|
const |
||||
4 |
γ 1,4 |
|
|||||
|
|
|
const |
||||
5 |
2 |
|
|
|
|
|
|
6 |
1 |
|
|
|
√ |
|
|
7 |
1/2 |
|
|
|
|
|
|
|
|
|
|
||||
Таблица. 9.1.
Назван ие процесса
изобарический
изохорический
изотермический
адиа батический
-
-
-
Знание по казателя политропы позволяет без особого труда рассчитать теплоём кость системы. Знание теплоёмкости в свою очередь даёт возмож-
ность рассчитать количество теплоты, сообщённое |
макросистеме в данном |
политр опическом процессе. Действительно, из 9.18 |
следует |
107

1 |
или |
1 |
. |
9.21 |
Тогда, бесконечно малое количество теплоты, сообщённое макросистеме в политропическом процессе равно
δ |
. |
|
Соответственно полное количество теплоты, полученное системой при |
||
измене нии её температуры от до |
, определяется простой формулой |
|
|
. |
9.22 |
Зная , мо жно определить макроскопическу ю работу |
, совершенную |
|
системой в политропическом процессе, с помощью уравнения первого начала в интегральной форме и ф ормулы 9.21 .
∆ , |
, |
9.23 |
1 |
. |
Таким образом, мы можем получить исчерпывающую информацию об энергообмене системы с окружающей средой.
Теперь уместно поставить следующ ие вопросы. Что д елать, если процесс не политропический? Можно ли глядя на график процесса, догадаться, что это не политропа?
Иногда можно. Взгляните на рис. 9.2. Это уж точно не политропы.
Рис. 9.2.
108

Для подобных процессов количество теплоты рассчитать не так просто
как в случае политропны х процессов |
|
так как теплоёмкость системы |
||
будет зависеть от температуры |
. |
Соответственно |
|
|
9.22 , |
|
9.24 |
||
δ |
|
. |
|
|
Полное к оличеств о теплоты, |
полученное системой в |
произвольном |
||
процессе, можно рассчитать только интегр ированием 9.24 |
9.25 |
|||
|
|
|
|
|
Вычислен ие теплоемкости и количества теплоты в различных процессах является внутренней подзадачей многих учебных задач, с которыми вы встретитесь при изучении термодинамики.
9.4. Тепловые машины и их эффективность.
Циклические процессы являются основой действия теп ловых машин. В используемых на практике разнообразных теплов ых машинах реализованы различные виды термодинамических циклов. Тепловыми ма шинами являются двигатели внутреннего сгорания, реактивные двигатели, хо лодильники, кондиционеры, тепловые насосы, паровые турб ины и т. д.
На диаграмме процессов цикл изображается замкну той кривой (рис. 9.3) с указанием направления перехода (по часовой стрелке или против часовой стрелки). Работа, совершаемая машиной за цикл равна площади, ограниченной этой кривой.
|
|
|
|
|
9.26 |
|
|
|
|
Работа расширения |
равна площади под |
|
Рис. 9.3. |
криво й 1-2-3 на диаграмме |
(рис. 9.3). Работа |
||
сжатия |
- |
от рицатель ная, поскольку объём на участке 3-1 уменьшается. |
|||
Величина |
|
определяется площадью под кривой 3-1. Рассчитывать работу |
|||
таким образом ц елесообр азно, |
если цикл представл яет простую геом етриче- |
||||
скую фигуру: |
прямоугольник, |
треугольник, трапецию, |
окружность. Более |
||
общий подход основан на вычислении количества теплоты, поступающей в машину на отдел ьных участках цикла.
109
Действительно, проинтегрировав по циклу равенство, выражающее первое начало термодинамики, получим важный результат:
δ,
из которого следует, что работа равна количеству теплоты, полученной системой за цикл
δ |
ц |
ц. |
9.27 |
Теплота в каких-то частях цикла поступает в систему ( (+)), а в каких-то частях уходит из системы . Обобщённо можно записать так
ц. 9.28
Определить поступает в систему количество теплоты или оно теряется иногда можно только расчётом, но зачастую это видно на графике процесса:
• Если температура |
растёт или (и) объём |
увеличивается, то в систе- |
||
му поступает количество теплоты |
. |
|
||
• Если температура |
падает или (и) объём |
уменьшается, то система |
||
отдаёт количество теплоты |
окружающей среде. |
|||
Принципиальная схема работы тепловой машины
Схематически работа машин по прямому и обращенному циклу представлена на рис. 9.4 и 9.5. Любая машина должна включать в себя нагреватель с температурой (горячий термостат), холодильник с температурой (холодный термостат), а также рабочее вещество, или рабочее тело, заключённое в некотором техническом устройстве (цилиндр с поршнем, турбина и т. п.), имеющем силовой привод. Если циклический процесс, описывающий состояние рабочего вещества в машине, идет по часовой стрелке, то машина работает в режиме двигателя (рис. 9.4), если против часовой стрелки, то в режиме холодильника, кондиционера или теплового насоса (рис. 9.5). Последние три названия часто объединяют одним термином – холодильная машина.
110
