
moskvich_fizika
.pdf
где |
η |
– КПД произвольного цикла с фиксированными температурами и . |
||||||||||||
|
||||||||||||||
Запишем это неравенство более детально |
1 |
|
|
|
, |
|
|
|||||||
|
1 |
|
|
|
|
|
|
|
|
|
||||
или, что, то же самое |
|
|
|
|
|
. |
|
10.18 |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
Знак минус в этом неравенстве показывает, что |
и |
имеют раз- |
||||||||||
ные знаки. Приведём окончательную форму соотношения (10.18), которую называют неравенством Клаузиуса для цикла Карно
0. 10.19
Отметим, что знак равенства относится к равновесному циклу Карно, а знак неравенства к неравновесному (необратимому).
Неравенство Клаузиуса можно обобщить для произвольного цикла [12]. Оно имеет следующий вид
δ
0, 10.20
здесь под , следует понимать температуру самой системы. Для обратимых процессов в (10.20) справедлив только знак равенства, а для необратимых – знак неравенства.
Запишем (10.20) для произвольного обратимого цикла
δ
0. 10.21
Из этого следует (см. 8.1), что бесконечно малая величина под интегралом в (10.21) является полным дифференциалом некоторой функции состояния. Обозначим её буквой . Эта термодинамическая функция называется
энтропией
δ |
. |
10.22 |
Равенство (10.22) определяет энтропию для обратимых процессов. Дальнейшему обсуждению этой важной термодинамической величины будет
121

посвящена следующая лекция. Кроме того, свойства энтропии в окрестности абсолютного нуля температур мы рассмотрим при изучении третьего начала термодинамики.
10.5. Оценка эффективности тепловых машин сверху
В повседневной жизни мы постоянно используем различные виды тепловых машин. Наземные транспортные средства невозможно представить без бензинового двигателя внутреннего сгорания или дизельного мотора. На тепловых электростанциях работают паровые турбины. В небо нас уносят турбореактивные самолеты. В основе работы этих и многих других машин лежат различные циклические процессы и в них применяются разные рабочие вещества. У вас будет возможность научиться рассчитывать КПД и КИЭ на основе рассмотрения конкретных циклов Отто, Дизеля, Брайтона и других. Возникает вопрос, можно ли рассчитать показатели эффективности машины, не вдаваясь в детали ее работы. Оказывается можно, но, разумеется, приближенно. Вторая теорема Карно позволяет сделать оценки эффективности реальных машин сверху. Для этого нужно знать только максимальную температуру цикла машины и его минимальную температуру .
Полагая, что
,
,
будем рассчитывать КПД и КИЭ реальных машин по формулам цикла Карно. Эти формулы приведены на схеме 10.5.1.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Схема 10.5.1. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
Эффективность идеальной машины Карно |
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Коэффициент полезного |
|
|
Коэффициент использования |
|
|
|||||||||||
|
|
действия |
|
|
|
|
энергии |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Двигатель |
Холодильник, кондицио- |
|
Тепловой насос |
|
|||||||||||
|
|
нер |
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
η |
|
|
1 |
|
|
ξ |
|
|
|
|
|
ξ |
|
|
1 |
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||
122

Примеры оценок эффективности тепловых машин сверху
КПД бензинового двигателя внутреннего сгорания
= 2427°C +273 = 2700 – температура воздушно-бензиновой смеси в момент ее воспламенения от искры свечи зажигания;
= 27°C+273 = 300 – температура наружного воздуха.
КПД реальногоη |
1 |
|
1 |
300 |
1 0,11 0,89 0,90. |
|
|
|
|
||||
|
теплового двигателя, работающего по циклу Отто, не превос- |
|||||
ходит 0,56. |
|
|
|
2700 |
|
|
КПД паровой турбины
Обычно на тепловых электростанциях, работающих на минеральном топливе, используется перегретый пар под давлением не выше 240 МПа с температурой не более 540°С, что соответствует мощности станции, равной 1200 МВт. Дальнейшее увеличение мощности станции за счет увеличения расхода пара (давления и температуры) затруднительно, так как это приводит к разрушению материалов и конструкции. Проведем оценку КПД паровой турбины при стандартных условиях ее работы.
=540°C+273 = 813 – рабочая температура пара;
=20°C+273 = 293 – температура наружного воздуха.
293 η 1 1 813 1 0,36 0,64.
КПД реальных паровых и газовых турбин не превосходят 0,32.
КИЭ бытового холодильника
=40°C+273 = 313 – температура воздуха вблизи радиатора (теплообменника) морозильной установки, расположенного на задней стенки холодильника;
=-23°C+273 = 250 – температура продуктов в морозильной камере.
ξ |
250 |
250 |
3,97 4. |
|
|
313 250 |
63 |
||
Реально КИЭ бытового холодильника не превосходит 3.
123

КИЭ кондиционера воздуха
=40°C+273 = 313 – температура наружного воздуха в жаркий день;
=22°C+273 = 295 – температура в охлаждаемом кондиционером помещении.
ξ |
295 |
295 |
16,38 16. |
|
|
313 295 |
18 |
||
Значения КИЭ у реально существующих бытовых кондиционеров воздуха не превышают 3,5.
КИЭ теплового насоса
Поместив холодильник на улице, можно передавать количество теплоты от холодного воздуха за окном внутрь дома и обогревать его.
= 27°C+273 = 300 – температура в обогреваемом тепловым насосом помещении;
= -23°C+273 = 250 – температура наружного воздуха в зимнее вре-
мя года.
ξ |
300 |
300 |
6. |
|
|
300 250 |
50 |
||
В действительности КИЭ бытовых тепловых насосов не превосходит 2,5. Как видим эффективность теплового насоса, работающего с макси-
мально допустимой эффективностью, составляет 600%. Это означает, что 1 Дж упорядоченной электрической энергии, подводимой к тепловому насосу позволяет передать от холодного воздуха за окном к теплому воздуху в доме 6 Дж энергии! Если же в качестве отопительного прибора использовать электрический тен, то КИЭ будет составлять 100%. Значит, использование теплового насоса оказывается в 6 раз эффективнее, чем использование традиционных электронагревательных приборов.
Тепловое загрязнение окружающей среды
В процессе работы любой тепловой машины часть получаемой от топлива энергии возвращается низкотемпературному резервуару (холодильнику). Эта энергия в конечном итоге полностью рассеивается и приводит к нагреву окружающей среды, т.е. атмосферы или прилегающих водоемов. Такой нагрев окружающей среды нежелательное явление с экологической точки зрения. Его называют тепловым загрязнением среды.
124
Контрольные вопросы |
|
1. Что называется циклом Карно? Изобразите его график на |
диаграмме. |
Запишите формулу для КПД этого цикла. |
|
2.Почему КПД машины Карно не может быть равным единице?
3.Почему в реальных машинах не используется цикл Карно?
4.Сформулируйте первую теорему Карно. Перечислите ее приложения.
5.Сформулируйте вторую теорему Карно. Перечислите ее приложения.
6.Сформулируйте принцип построения абсолютной термодинамической шкалы температур.
7.В чем заключается сущность метода циклов? Поясните на примере.
8.Получите неравенство Клаузиуса для цикла Карно. Запишите неравенство Клаузиуса в обобщенном виде. Для каких процессов неравенство переходит в равенство? Что из этого следует?
9.Сделайте оценку сверху КПД двигателя внутреннего сгорания, если температура воспламенения бензиново-воздушной смеси составляет 2000оС?
10.Сделайте оценку сверху КПД дизельного двигателя, если известно, что температура самовоспламенения дизельного топлива при сжатии равна 800оС.
11.Сделайте оценку сверху КИЭ бытового кондиционера, если температура наружного воздуха достигает 37оC, а в доме требуется поддерживать температуру 18оС.
12.Какое устройство называется тепловым насосом? Оцените его эффективность.
125
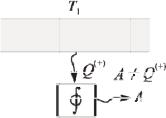
ЛЕКЦИЯ 11
ВТОРОЕ НАЧАЛ О ТЕРМОДИНА МИКИ.
Второе начало является решающей аксиомой термодинамики, поскольку име нно оно определяет направление процессов, которые могут происходить в действительности. Кроме того, совместно с первым началом второе начало позволяет установить множество точных количественных соотношений между различными макроскопическими параметрами тел в состоянии термодинамического равновесия. Это оказ ывается возможным благодаря введению такого фундаментального понятия как энтропия. Энтропия (греч. – поворот, превра щение) служит мерой прео бразовани я или эволюции системы.
Исторически открытие второго начала связано с анал изом работы тепловых машин, чем и определяются его исходные формулировки. Основоположником второго начала по праву считается Сади Карно. Подойдя в плотную ко второму началу, в своих знаменитых теоремах он не дал его чёткую формулировку. Это было сделано только в 1850-1851гг. независимо друг от друга Рудольфом Клаузиусом и Вильямом Томсоном (лордом Кельвином).
1 1.1. Форм улировк и второго начала термодинамики
К настоящему времени известно неск олько десятков различных формулирово к второго начала, больши нство из которых носят запретительную форму, т.е. констатируют невозможность некоторых процессов и механизмов (машин). Таким образом, они отражают необратимость естественных процессов.
Ниже приведены три наиболее популярные формулировки постулата.
Формулировка К ельвина: невозможен циклически й процесс, единственным
результ атом которого является производство работы за счет уменьшения внутренней энергии т олько одного теплового резервуара (рис. 11.1).
Формулировка Оствальда: невозможен вечный двигатель второго рода. Вечный двигатель второго рода – это тепловая машина без низкотемпературного резервуара (рис 11.1).
Формулировка Клаузиуса: тепл ота не может
сам опроизвольно переходить от тела менее нагретого к более нагретому (рис. 11.2).
Как видно, формулировки Кельв ина и Оствальда по содержанию совпадаю т. И в то й, и в другой предполагается, что для преобразования теплоты в работу необходима компенсация – отдача части количества теплоты, полученной рабочим телом, други м телам (холодильнику). Формулировка К лаузиуса вроде бы совсем про другое, в ней нет ни работы,
126

ни двигателя. Несмотря на явные текстовы е разли- |
|
|
чия можно док азать эквивалентность формулиро- |
|
|
вок Кельвина и Клаузиуса [12]. |
|
|
Как уже отмечалось в 10.1 вечный двигатель |
|
|
первого |
рода запрещён первым началом термоди- |
|
намики. |
Получить работу из нич его невозможно. |
|
Парижская академия наук ещё в 1775 году отказалась |
Р ис. 11.2. |
|
рассматривать проекты перпетуу м-мобиле. Однако, первое начало не запре-
щает полностью |
преобразовать теплоту в работу, |
например, |
в изотермиче- |
||||
ском процессе |
идеального газа. Так |
как |
в этом |
процессе |
|
const |
, то |
0, следовательно, уравнение перв |
ого начала примет вид |
|
|||||
|
δ |
δ . |
, |
|
|
|
|
Совершать полное преобразование теплоты в работу циклически запрещает второе начало термодинамики, то есть оно запрещает существование вечного двигателя второго рода. П ричём это утверж дение не допускает обращения. Это означает, что, в то время как т еплоту нельзя превратить в ра-
боту полностью (без компенсации), работу в теплоту можно превра-
тить без всяки х компенсаций. Существует фундаментальная асимметрия между теплотой и работой, хаосом и порядком. Эта универсальная концепция может б ыть выражена с помощью такого понятия как энтропия.
Современные формулировки второго начала термодинамики вы ражают закон существования энтропии у всякой равновесной системы и ее неубывания при любых процессах в изолированных системах. Первая часть формулировки - это определение энтропии по Клаузиусу (10.22), а вторая – закон возрастания энтропии. В некоторых учебниках [14,5] закон возрастания энтропии рассматривается как самодостаточная формулировка второго начала. Большую известность получила формулировка постулата в редакции А.Зоммерфельда. Она пр иведена ниже.
Энтропийная формулировка второ го начала термодинамики
Ча сть первая
Каждая термодина мическая система обладает функци ей состояния, называемой энтро пией. Энтропия данного состояния системы вычисляется следующим образом. Система переводится из произвольно выбранного начального состояния ( 0) в соответствующее конечное состояние ( 1) через последовательность сос тояний р авновес ия. Вычисляются все подводимые при этом к системе порции теплоты δ , каждая из которых делится на соответствую-
127

щую ей абсолютную температуру , и все полученные таким образом значения суммируются:
δ |
, |
δ |
|
11.1 |
∆ |
. |
11.2 |
||
Часть вторая
При реальных (неравновесных) процессах энтропия замкнутой системы возрастает.
∆0. 11.3
Информационное содержание постулата
• Энтропия есть функция состояния системы.
•Энтропия - величина аддитивная: энтропия макросистемы равна сумме энтропий её отдельных частей.
•Рост энтропии в изолированной системе означает нарастание хаоса и приближение системы к состоянию термодинамического равновесия. В этом состоянии S – максимальна, а dS=0.
•В неизолированной системе энтропия может и возрастать, и убывать, и оставаться неизменной.
Заметим, что вторая часть приведенной выше формулировки постулата имеет строгое обоснование.
11.2. Закон возрастания энтропии в изолированных системах
Для того, чтобы получить заключение об изменении энтропии в процессах изолированной системы, необходимо провести определенную цепочку логических рассуждений.
Пусть замкнутая система, т.е. система теплоизолированная, переходит в некотором процессе из равновесного состояния 1 в равновесное состояние 2 (рис. 11.3). Возвратим систему с помощью обратимого процесса в состояние 1. При этом, конечно, необходимо ликвидировать изолированность системы.
128

В результате возвращения системы в состояние 1 образовался цикл, к которому можно применить неравенство Клаузиуса
δ δ δ
0.
Рис. 11.3.
Учитывая особенности процессов, отметим, что первый интеграл обращается в нуль, поскольку система на этом участке цикла изолирована, чит δ 0. Второй интеграл можно в соответствии с определением энтропии для обратимых процессов записать в виде
δ
0
или
0; |
0. |
Следовательно
. 11.4
Вконтексте рассмотренной задачи неравенство (11.4) имеет ед инствен-
ный смысл: в процессах замкнутой системы энтропия не убывает . Полу-
ченный результат называют законом возрастания энтропии в изолированных системах. Знак равенства в (11.4) соответствует идеальным (равновесным) процессам, а знак неравен ства – неравновесным процессам.
Вкачестве запоми нающегося примера применения закона возрастания энтропи и в проц ессах изолированной системы рассмотрим парадокс под названием «Демон Максвелла», сфор мулированный ещ е в 1879 году.
Демон Максвелла
Имеется изолированная система, представляющая соб ой некоторый сосуд, разделенный перегородкой на две половины, в одной из них находится газ, другая поло вина пустая.
« Демон» - живое разумное существо или тех ническое устройство, способное в изолированной системе пропускать через отверстие в перегородке «горячие» молекулы и не пропускать «холодные», т.е. откр ывать дверцу для одних и закрывать её для других ( рис. 11.4).
129

Рис. 11.4.
Если кинетическая энергия молекулы , подлетающей к дверце, отвечает услови ю ε ε , то ее будем считать горячей, если нет – то холодной. ε – это наперед заданное значение энергии. В результате «работы» демона в одной половине сосуда ранее пустой соберутся горячие молекулы, а в другой – первоначально заполненной горячими и холодными молекулами, останутся только холодны е молекулы.
Формулировка парадокса
Если существовани е демона возмож но, то в изолированной системе возникает порядок, т. е. её энтропия уменьшается. Э то противоречит второму началу термодинамики.
Разреш ение парадокса
Существование демона невозможно по следую щим причинам:
• Живое, а тем более разумное существо в изолирова нной системе погибнет. Даже если живой Демон что и успеет, то после его к ончины хаос быстро восстановится. Если серьезно, то науке не известен биологический объект с требуемыми свойствами.
•Лёгкая дверца, которую может открыть только «энер гичная» молекула, непременно бу дет броуновской частицей . Следовательно, она будет откры ваться и закрываться случайным образом и пропускать кого попало. Хаос сохранится, энтропия не умень шится.
•Управлен ие дверцей извне возможно, напри мер, с по мощью лазера, но
тогда нарушается изолированность системы. В неизолированной системе энтр опия может убывать, это не проти воречит второму началу, но тогда условия « игры» не выполнены.
130
