
- •1 Билет
- •2 Билет
- •3 Билет
- •4 Билет
- •5 Билет
- •3. Полноценное питание должно содержать:
- •6 Билет
- •7 Билет
- •8 Билет
- •9 Билет
- •10 Билет
- •2.Синтез жиров в печени и жировой ткани.
- •11 Билет
- •12 Билет
- •13 Билет
- •14 Билет
- •3. Терминация
- •15 Билет
- •16 Билет
- •17 Билет
- •18 Билет
- •19 Билет
- •3. Регуляция обмена ионов ca и фосфатов. Строение, биосинтез и механизм действия паратгормона, кальцитонина и кальцитриола. Рахит, гипо- и гиперпаратиреоидизм.
- •20 Билет
- •1. Классификация и номенклатура ферментов, примеры.
- •3. Регуляция водно-солевого обмена. Строение, механизм действия и функции альдостерона и вазопрессина. Роль системы ренин-ангиотензин-альдостерон. Предсердный натриуретический фактор.
- •21 Билет
- •1. Ингибирование активности ферментов: обратимое (конкурентное и неконкурентное) и необратимое. Лекарственные препараты как ингибиторы ферментов.
- •2. Неконкурентное ингибирование
- •3. Гормоны гипоталамуса и передней доли гипофиза, хим. Природа и био. Роль.
- •22 Билет
- •2. Дезаминирование аминокислот: прямое, непрямое. Виды прямого дезаминир-я. Окисл. Дезаминирование. Оксидазы l-аминокислот. Глутаматдегидрогеназа. Схема реакции, кофактор, регуляция процесса.
- •3. Передача сигналов через внутриклеточные рецепторы.. Строение рецептора ацетилхолина.
- •23 Билет
- •1. Ферменты, определение. Особенности ферментативного катализа. Специфичность действия ферментов, виды.
- •2. Транскрипция. Характеристика компонентов системы синтеза рнк. Структура днк-зависимой рнк-полимеразы. Инициация процесса. Элонгация, терминация транскрипции.
- •24 Билет
- •1. Принципы классификации белков. Классификация по составу и биологическим функциям, примеры представителей отдельных классов.
- •2. Повреждения и репарация днк. Виды повреждений. Способы репарации. Дефекты репарационных систем и наследственные болезни.
- •3. Циклические амф и гмф как вторичные посредники. Активация протеинкиназ и фосфорилирование белков, ответственных за проявление гормонального эффекта.
- •25 Билет
- •2. Непрямое дезаминирование ак. Схема процесса, субстраты, ферменты, кофакторы.
- •26 Билет
- •1. Физико-химические свойства белков. Молек. Масса, размеры и форма, растворимость, ионизация и гидратация. Денатурация - признаки и причины.
- •2. Аэробный гликолиз. Последовательность реакций до образования пирувата (аэробный гликолиз). Значение. Использование глюкозы для синтеза жиров. Энергетический эффект аэробного распада глюкозы.
- •3. Классификация гормонов по хим. Строению и биологическим функциям.
- •27 Билет
- •1.Четвертичная структура белков. Особенности строения и функционирования олигомерных белков на примере гемоглобина. Кооперативные изменения конформации протомеров.
- •2. Цтк: реакции и характ-ка ферментов. Роль цикла в метаболизме.
- •28 Билет
- •1. Биологические мембраны, строение, функции и общие свойства: жидкостность, поперечная асимметрия, избирательная проницаемость.
- •1. Структура и свойства липидов мембран
- •2. Первичный транскрипт и его процессинг. Рибозимы как пример каталитической активности нуклеиновых кислот. Биороль.
- •3. Гемоглобины человека, структура. Транспорт кислорода и диоксида углерода. Гемоглобин плода и его физиолог. Значение. Гемоглобинопатии.
- •29 Билет
- •1. Липиды. Общая характеристика. Биологическая роль. Классификация липидов. Вжк, особенности строения. Полиеновые жк. Триацилглицеролы.
- •2. Элонгация и терминация репликации. Ферменты. Асимметричный синтез днк. Фрагменты оказаки. Роль днк-лигазы.
- •3. Белки сыв. Крови. Энзимодиагностика. АктивносТь аминотрансфераз .
- •30 Билет
- •1. Переваривание липидов пищи. Всасывание продуктов. Нарушения переваривания и всасывания. Ресинтез триацилглицеролов. Образование хиломикронов и транспорт жиров. Липопротеинлипаза, её роль.
- •2. Репликация. Принципы репликации днк. Стадии репликации.
- •3. Коллаген: особенности ак-состава, первичной и пространственной структуры. Особенности биосинтеза и созревания коллагена.
- •31 Билет
- •1. Активный центр белков и его специфическое взаимодействие с лигандом. Конформационная лабильность белков. Комплементарность.
- •2. Распад жирных кислот в клетке. Β-Окисление жк, энергетический эффект.
- •3. Структурная организация межклеточного матрикса. Адгезивные белки. Строение и функции гликозаминогликанов. Структура протеогликанов.
- •32 Билет
- •1. Третичная структура белков. Супервторичная структура. Доменная структура. Роль шаперонов в формировании 3 структуры белков invivo.
- •2. Анаэробный гликолиз. Распространение и физиологическое значение. Энергетический эффект.
- •3. Молекулярная структура миофибрилл. Структура и функция белков миофибрилл миозина, актина, тропомиозина, тропонина.
- •33 Билет
- •1. Вторичная структура белков. Связи, стабилизирующие 2 структуру.
- •2. Холестерин. Пути поступления, использования и выведения из организма.Биосинтез холестерина, его этапы. Регуляция синтеза.
- •3. Биохимические механизмы мышечного сокращения и расслабления. Роль ионов кальция в сокращении. Особенности энергетического обмена в мышцах; роль креатинфосфата.
- •34 Билет
- •1. Переваривание белков: протеазы жкт, их активация и специфичность, оптимум рн и результат действия. Образование и роль соляной кислоты в желудке. Защита клеток от действия протеаз.
- •2. Биосинтез глюкозы (глюконеогенез). Цикл кори.
- •3. Химический состав нервной ткани. Миелиновые мембраны. Энергетический обмен в нервной ткани. Значение аэробного распада глюкозы. Медиаторы нс. Физиологически активные пептиды мозга.
- •35 Билет
- •1. Первичная структура белков. Пептидная связь. Гемоглобин s
- •2.Синтез гема, всас-е железа, транспорт в крови,
- •3. Значение воды для жизнедеятельности организма. Водный баланс, регуляция водного обмена.
19 Билет
1. СТРОЕНИЕ ФЕРМЕНТОВ. КАТАЛИТИЧЕСКИЙ И РЕГУЛЯТОРНЫЙ ЦЕНТРЫ. ВЗАИМОДЕЙСТВИЕ ФЕРМЕНТОВ С ЛИГАНДАМИ. МЕХАНИЗМ ДЕЙСТВИЯ ФЕРМЕНТОВ. ФОРМИРОВАНИЕ ФЕРМЕНТ-СУБСТРАТНОГО КОМПЛЕКСА. ГИПОТЕЗА «КЛЮЧ-ЗАМОК» И ГИПОТЕЗА ИНДУЦ. СООТВЕТСТВИЯ.
Ферменты (энзимы) – это биокатализаторы преимущественно белковой природы, которые принимают участие в химических реакциях в организме. По химическому строению различают простые ферменты (состоят только из АК) и сложные ферменты (имеют небелковую часть или простетическую группу). Белковая часть – апофермент, а небелковая, если она связана ковалентно с апоферментом, то называется кофермент, а если связь нековалентная (ионная, водородная) – кофактор (ионы Zn, Cu, K).
В процессе катализа реакции в контакт с субстратом вступает активный центр (АЦ) фермента. Эта зона молекулы формир-ся при скручивании белковой молекулы в третичную структуру. Особенность строения АЦ - его поверхность комплементарна поверхности субстрата, т.е. остатки АК этой зоны фермента способны вступать в химическое взаимодействие с определенными группами субстрата. Можно представить, что активный центр фермента совпадает со структурой субстрата как ключ и замок.
В АЦ различают две зоны: центр связывания, ответственный за присоединение субстрата, и каталитический центр, отвечающий за химическое превращение субстрата. В состав каталитического центра большинства ферментов входят такие АК, как Сер, Цис, Гис, Тир, Лиз. Сложные ферменты в каталитическом центре имеют кофактор или кофермент.
Помимо активного центра ряд ферментов снабжен регуляторным (аллостерическим) центром. С этой зоной фермента взаимодействуют вещества, влияющие на его каталитическую активность.
Ферменты обладают высокой специфичностью, поэтому выдвинули гипотезу, согласно которой активный центр фермента комплементарен субстрату, т.е. соответствует ему как "ключ замку". После взаимодействия субстрата ("ключ") с активным центром ("замок") происходят химические превращения субстрата в продукт. Активный центр при этом рассматривался как стабильная, жёстко детерминированная структура.
"Гипотеза индуцированного соответствия": активный центр является гибкой структурой по отношению к субстрату. Субстрат, взаимодействуя с активным центром фермента, вызывает изменение его конформации, приводя к формированию фермент-субстратного комплекса, благоприятного для химических модификаций субстрата. При этом молекула субстрата также изменяет свою конформацию, что обеспечивает более высокую эффективность ферментативной реакции.
2. ВСАСЫВАНИЕ ПРОДУКТОВ ПЕРЕВАРИВАНИЯ БЕЛКОВ. ТРАНСПОРТ АМИНОКИСЛОТ В КЛЕТКИ КИШЕЧНИКА. ОСОБЕННОСТИ ТРАНСПОРТА АМИНОКИСЛОТ В ГЕПАТОЦИТАХ. Y -ГЛУТАМИЛЬНЫЙ ЦИКЛ. НАРУШЕНИЯ ПЕРЕВАРИВАНИЯ БЕЛКОВ И ТРАНСПОРТА АМИНОКИСЛОТ.
Транспорт аминокислот в клетки
Аминокислоты, образовавшиеся при переваривании белков, быстро всасываются в кишечнике. Транспорт их осуществляется двумя путями: через воротную систему печени, ведущую прямо в печень, и по лимфатическим сосудам, сообщающимся с кровью через грудной лимфатический проток. Максимальная концентрация аминокислот в крови достигается через 30-50 мин после приёма белковой пищи (углеводы и жиры замедляют всасывание аминокислот). Всасывание L-аминокислот (но не D-изомеров) - активный процесс, требующий затраты энергии. Аминокислоты переносятся через кишечную стенку от слизистой её поверхности в кровь (рис. 9-4).
Одна из специфических транспортных систем для некоторых нейтральных аминокислот функционирует в кишечнике, почках и, по-видимому, мозге. Она получила название γ-глутамильного цикла (рис. 9-5). Рис. 9-5. γ-Глутамильный цикл. Система состоит из одного мембранного и пяти цитоплазматических ферментов. Перенос аминокислоты внутрь клетки осуществляется в комплексе с глутамильным остатком глутатиона под действием γ-глутамилтрансферазы. Затем аминокислота освобождается, а γ-глутамильный остаток в несколько стадий превращается в глутатион, который способен присоединять следующую молекулу аминокислоты. Е1 - γ-глутамилтрансфераза; Е2 - у-глутамилциклотрансфераза; Е3 - пептидаза; Е4 - оксопролиназа; Е5 - γ-глутамилцистеинсинтетаза; Е6 - глутатионсинтетаза. Дипептид цистеинилглицин расщепляется под действием пептидазы на 2 аминокислоты - цис-теин и глицин.
Нарушение
переваривания белков и транспорта
аминокислот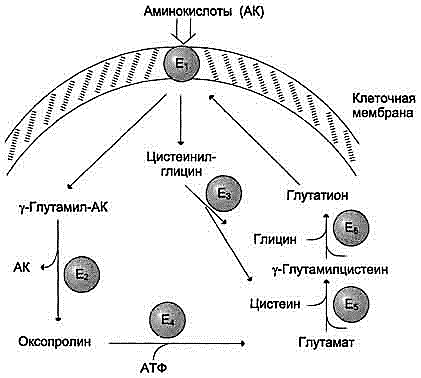
Небольшую долю продуктов переваривания белка составляют негидролизованные короткие пептиды. У некоторых людей возникает иммунная реакция на приём белка, что, очевидно, связано со способностью к всасыванию таких пептидов. Продукты полностью переваренного белка (аминокислоты) лишены антигенных свойств и иммунных реакций не вызывают.
У новорождённых проницаемость слизистой оболочки кишечника выше, чем у взрослых, поэтому в кровь могут поступать антитела молозива (секрет молочных желёз, выделяющийся в первые дни после родов, обогащённый антителами и антитоксинами). Это усугубляется наличием в молозиве белка - ингибитора трипсина. Протеолитические ферменты в пищеварительных секретах новорождённых обладают низкой активностью. Всё это способствует всасыванию в кишечнике небольшого количества нативных белков, достаточного для обеспечения иммунной реакции.
Целиакия характеризуется повышенной чувствительностью к глютену - белку клейковины зёрен злаков, употребляемых с пищей человеком. Этот белок оказывает токсическое действие на слизистую оболочку тонкой кишки, что приводит к её патологическим изменениям и нарушению всасывания. Патогенез заболевания недостаточно ясен. Цистинурия, болезнь Хартнапа и др., возникают вследствие дефекта переносчиков нейтральных аминокислот в кишечнике и почках.
