
- •ФІЗИЧНА ТА КОЛОЇДНА ХІМІЯ
- •КИЇВ НУХТ 2012
- •ВСТУП
- •Лабораторна робота № 1
- •Теоретичні відомості
- •Поверхневий натяг розчинів оцтової кислоти
- •Лабораторна робота № 8
- •Прилади, лабораторний посуд та реактиви
- •Опрацювання результатів
- •Таблиця 8.1
- •Результати розрахунку адсорбції на межі поділу тверде тіло – рідина
- •Номери
- •Лабораторна робота № 9
- •Теоретичні відомості
- •Прилади, лабораторний посуд, реактиви
- •Перевірка на ефект Тіндаля
- •Одержання емульсії типу М/В
- •Одержання емульсії типу В/М
- •Одержання емульсій, стабілізованих порошками
- •Емульсії соняшникової олії у воді
- •Опрацювання результатів
- •Лабораторна робота № 10
- •Теоретичні відомості
- •Швидкість електрофоретичного перенесення визначають за рівнянням:
- •Градієнт потенціалу дорівнює:
- •Прилади, лабораторний посуд, реактиви
- •Опрацювання результатів
- •Лабораторна робота № 11
- •Теоретичні відомості
- •Опрацювання результатів
- •Лабораторна робота № 12
- •Теоретичні відомості
- •Лабораторна робота № 12.1
- •Прилади, лабораторний посуд, реактиви
- •Опрацювання результатів
- •Лабораторна робота № 12.2
- •Опрацювання результатів
- •Результати дослідження кінетики набухання желатину
- •Залежність граничного набухання желатину від рН розчину
- •Порядок виконання роботи
- •Опрацювання результатів
- •Залежність граничного ступеня набухання желатину від рН розчину
- •Прилади, лабораторний посуд та реактиви
- •Опрацювання результатів
можливість студентам ознайомитися з фізико-хімічними процесами, які лежать в основі одержання та дослідження складу і властивостей продуктів харчування, а також продуктів біотехнології необхідними приладами, методикою проведення лабораторних досліджень та навчитися самостійно аналізувати системи і виконувати необхідні розрахунки.
Для самостійної підготовки студентів передбачені теоретичні відомості на початку кожної лабораторної роботи та питання для самоперевірки знань.
Лабораторна робота № 1
ВИЗНАЧЕННЯ ІНТЕГРАЛЬНОЇ ТЕПЛОТИ РОЗЧИНЕННЯ СОЛІ
Мета роботи – ознайомитися з принципом калориметричних вимірювань, навчитися експериментально визначати теплові ефекти хімічних та фізикохімічних процесів.
Теоретичні відомості
Термохімія є розділом термодинаміки, що вивчає теплові ефекти хімічних реакцій, фазових перетворень, процесів розчинення, адсорбції, змочування, набухання та ін.
Теоретична основа термохімії – перший закон термодинаміки. Це закон збереження і перетворення енергії, який стверджує, що теплота Q, яка надана системі, витрачається на збільшення її внутрішньої енергіїU і на виконання системою роботи проти зовнішніх сил А.
Для будь-якого елементарного термодинамічного процесу перший закон термодинаміки записується у вигляді:
dU = dQ - dA |
(1.1) |
Рівняння (1.1) є математичним виразом першого закону термодинаміки. Величина dU – повний диференціал енергії. Внутрішня енергія характеризує загальний запас енергії системи, тобто енергію поступального і обертального руху молекул, енергію коливань атомів, що входять до складу молекули, енергію обертання електронів навколо ядер і ядерну енергію. Коли система під дією різних чинників переходить із одного стану в інший, зміна її внутрішньої енергії U не залежить від шляху, яким система перейшла від початкового до кінцевого стану, а залежить лише від цих станів.
Функції, заміна яких не залежить від способу проведення процесу, називаються функціями стану. Внутрішня енергія є функцією стану термодинамічної системи.
Теплота та робота– різні форми передачі енергії, що характеризують визначений процес, і, в загальному вигляді, не можуть бути функціями стану, тому в рівнянні (1.1) вони виражені не повним диференціалом, а нескінченно малим приростом теплоти та роботи.
Якщо процес виконується за сталого об'ємуV=const (ізохорний процес), робота проти зовнішніх сил(робота розширення) відсутня і рівняння(1.1) можна записати у вигляді:
4
dU = dQv , Qv = DU (1.2)
Оскільки U – функція стану, Qv також є функцією стану.
Якщо процес йде за умови сталого тискуΡ=const (ізобарний процес), згідно з (1.3) в системі можливе виконання роботи розширення:
dQp = dU + PdV |
(1.3) |
Після інтегрування рівняння (1.3) отримуємо: |
(1.4) |
Qp = DU + P(V2 -V1 ) = D(U + P ×V ) = DH |
|
Величина U+P·V=H називається ентальпією. Зміна ентальпії, як |
і зміна |
внутрішньої енергії, не залежить від шляху процесу і є функцією стану. Зміну ентальпії відносять до одного моля речовини і вимірюють у Дж/моль. Отже Qр також є функцією стану
Qp = DH |
(1.5) |
З (1.5) видно, що кількість теплоти, наданої системі за сталого тиску, дорівнює зміні ентальпії даної системи. Як випливає з(1.2) і (1.5), теплота процесу за умови V=const і Ρ=const залежить тільки від різниці енергії кінцевого і початкового стану системи. Ці рівняння є математичним виразом закону Гесса.
Закон Гесса є основним законом термохімії і формулюється так: якщо з даних вихідних речовин можна одержати задані кінцеві продукти різними шляхами, сумарна теплота процесу для всіх шляхів буде одна. Цей закон є цілком правильним лише для процесів, що проходять при сталому об'ємі (Qv=DU) або тиску (Qp =DН) за сталої температури.
Тепловим ефектом реакції називається кількість теплоти, що виділяється або поглинається при хімічній реакції за сталого об’єму та тиску за умови однакової температури початкових і кінцевих речовин.
Для порівняння теплових ефектів їх приводять до однакових умов. З цією
метою введено поняття стандартних |
ефектів, значення яких вимірюють при |
|
T = 298 K і P = 101,325 кПа. Стандартні теплові ефекти позначають DH 2980 . |
||
Згідно закону |
Гесса тепловий |
ефект процесу не залежить від шляхів |
переходу або проміжних стадій, а визначається лише початковим і кінцевим |
||
станами системи. Цей закон дозволяє розрахувати теплові ефекти процесів, які |
||
експериментально |
визначити немає |
можливості, через табличні значення |
теплот утворення, згоряння, розчинення.
Теплота утворення хімічної сполуки– це кількість тепла, що поглинається або виділяється при утворенні одного моля цієї сполуки із простих речовин при стандартних умовах. Теплоту утворення простих речовин умовно приймають рівною нулю.
Через те що більшість хімічних реакцій проходить за сталого тиску, для характеристики теплових ефектів використовують ентальпію Н. Ентальпія – це теплота утворення1 моль сполуки з відповідних простих речовин за стандартних умов.
Розчинення речовини супроводжується виділенням або поглинанням теплоти, що характеризується інтегральним або диференціальним тепловим ефектом.
5

Інтегральною теплотою розчинення ( Нр) називають теплоту розчинення
1 моль речовини з утворенням розчину заданої моляльності(моляльна концентрація характеризується числом молів речовини, розчиненої в 1000 г розчинника).
Диференціальна теплота розчинення– це теплота розчинення1 моль речовини в нескінченно великій кількості розчину постійної концентрації.
Тепловий ефект при розчиненні кристалічної солі( Нр) визначається двома стадіями. Перша стадія характеризується ендотермічним процесом(E) руйнування кристалічних ґраток солі і віддалення іонів на значну відстань від поверхні кристалу. Друга - екзотермічним процесом( Нг) гідратації (сольватації) іонів. Отже
Нр=Е+ Нг |
(1.6) |
||||
Для розрахунку теплового ефекту розчинення |
солі була введена |
||||
додаткова функція – теплоємність термодинамічної системи, яка визначається |
|||||
рівнянням: |
|
||||
С р = |
dQ |
= |
dH |
|
(1.7) |
|
|
||||
|
dT dT |
|
|||
Тобто, теплоємність визначається такою величиною теплоти процесу, при |
|||||
якій температура системи змінюється на 1ºС. |
(1.8) |
||||
dQ = dH = C p × dT |
|||||
після інтегрування (1.8) отримаємо: |
(1.9) |
||||
Qp = DH = C p × DT |
|||||
Завдання на виконання роботи
1.Визначити сталу калориметра за азотнокислим калієм.
2.Визначити інтегральну теплоту розчинення невідомої солі.
Прилади, лабораторний посуд та реактиви |
|
|
|
|
Калориметрична |
установка, |
|
||
терези, дистильована |
вода, |
сіль, |
|
|
термометр. |
|
|
|
|
Калориметр |
(рис. |
1.1) |
|
|
складається з кожуха |
та |
склянки, |
|
|
яку розміщують |
в кожух. Для |
|
||
зменшення |
теплообміну |
з |
||
навколишнім |
|
середовищем |
|
|
калориметр закривають кришкою, у |
|
|||
яку вставляють мішалку, термометр і пробірку з сіллю.
Рис. 1.1. Калориметр
6

Лабораторна робота № 1.1 ВИЗНАЧЕННЯ СТАЛОЇ КАЛОРИМЕТРА
Порядок виконання роботи
1.В склянку заливають 200 г дистильованої води.
2.Розраховують кількість KNO3, що припадає на 200 г води, для одержання
розчину концентрацією 0,2 - 0,3 Μ.
3.Для визначення маси наважки зважують порожню пробірку, а потім пробірку разом із сіллю з точністю до 0,01 г.
4.Збирають калориметричну установку як показано на рис.1.1.
5.Проводять вимірювання зміни температури у калориметричній системі, яка відбувається внаслідок розчинення солі. При безперервному перемішуванні розчину фіксують зміну температури з точністю до0,1 °С через кожні30 с і заносять у робочий зошит. Для визначення точної зміни температури під час досліду процес розчинення умовно поділяють на три періоди :
а) Попередній, який триває до 5 хв.
б) Головний – процес розчинення солі. в) Заключний – до 5 хвилин.
Упопередньому періоді
визначають інтенсивність теплообміну калориметра з навколишнім середовищем.
|
Для |
|
|
цього |
при |
|
|
безперервному |
|
|
|||
|
перемішуванні |
|
води |
|||
|
вимірюють |
її |
температуру |
|||
|
через |
кожні 30 |
с. |
Після |
||
|
встановлення |
|
|
сталої |
||
|
температури, |
тобто |
зміна |
|||
|
температури через кожні 30 |
|||||
|
с |
буде |
майже |
однакова |
||
Рис. 1.2. Графічне визначення температурного |
(через 5 |
хв |
вимірювань), у |
|||
перепаду в калориметрі |
склянку |
з |
водою |
вносять |
||
сіль. |
|
|
|
|
|
|
|
|
|
|
|
|
|
В головному періоді не припиняють перемішування розчину до повного розчинення солі, фіксуючи зміну температури кожні 30 с.
Заключний період прийнято вважати з моменту досягнення рівноваги розчинення солі, тобто з моменту припинення зниження температури (тривалість не менше 5 хв).
6. Зміну температури в системі, яка відбувається внаслідок розчинення солі визначають графічно. Для цього на міліметровому папері, будують графік, де на вісі абсцис відкладають час, а на вісі ординат – температуру. На рис. 1.2
7
показано одну з можливих діаграм, де FА – попередній період, AD – головний і DС – заключний. Для визначення зміни температуриΤ продовжують (пунктиром) лінію попереднього періоду вправо(ділянка АВ), а лінію заключного періоду вліво (ділянка ОD). Через середину головного періоду (точка К) проводять пряму, паралельну вісі ординат, до перетину з пунктирними лініями. Відстань ОВ дорівнює зміні температуриDΤ при розчиненні солі з урахуванням теплообміну між калориметром і навколишнім середовищем.
7. Після розчинення солі за зміною температури розчину в калориметрі визначають кількість теплоти, наданої системі (калориметричний тепловий ефект).
Опрацювання результатів
Калориметричний тепловий ефект розраховують за рівнянням:
Q = åci × mi × Dt = (Cp-H × m p-H +W ) × Dt, |
(1.10) |
де Сp-н– питома теплоємність розчину; mр-н – маса розчину, W – стала калориметра або водяний еквівалент; Dt – зміна температури розчину в процесі розчинення.
Водяний еквівалент калориметра(W) являє собою теплоємність калориметричної системи, тобто кількість теплоти, необхідної для нагрівання або охолодження всіх частин калориметра на один градус:
n |
|
W = åci × mi , |
(1.11) |
i=1
де Σm – маса частин калориметра, що беруть участь в теплообміні; ci – питома теплоємність кожної частини калориметра. Отже, водяний еквівалент можна визначити з(1.11) як суму добутків теплоємності кожної з частин калориметра на її мacy крім теплоємності розчину.
Сталу калориметра можна визначити за рівнянням(1.10), якщо ввести в
калориметр відому кількість теплоти. Калориметричний тепловий ефект для солі KNO3 (QKNO3 ) обчислюють за відомою інтегральною теплотою розчинення DH= 35,6 кДж/моль. Калориметричний тепловий ефект для солі KNO3 буде:
QKNO |
= |
mKNO |
× DH KNO |
(1.12) |
|
3× |
3 |
||||
M KNO |
|||||
3 |
|
||||
|
|
|
|||
|
|
|
3 |
|
|
Підставивши отримане значення у |
формулу(1.10) визначають сталу |
||||
(водяний еквівалент) калориметра за експериментально визначеним значенням
ΤКNO3:
W = |
QКNO3 - c p × mKNO 3 |
× Dt |
|
|
|
(1.13) |
|
Dt |
|
||
|
|
|
|
де cp – питома теплоємність розчину, яка |
визначається за питомою |
||
теплоємністю води, оскільки розчин розбавлений (при 298 К вона становить
4,18 Дж/г×К).
8
Лабораторна робота № 1.2 ВИЗНАЧЕННЯ ІНТЕГРАЛЬНОЇ ТЕПЛОТИ РОЗЧИНЕННЯ
НЕВІДОМОЇ СОЛІ
Порядок виконання роботи
1.Після визначення теплового ефекту розчинення соліKNO3 (сталої калориметра) калориметр звільняють від розчину, корки висушують, пробірки витирають тампоном з фільтрувального паперу.
2.В пробірку вносять невідому сіль і зважуванням визначають її масу.
3.Збирають калориметричну установку (рис. 1.1) і, відповідно до п. 5, 6, 7 лабораторної роботи №1.1 здійснюють процес розчинення невідомої солі,
будують графік залежності t=f(t), визначають стрибок температуриt та розраховують калориметричний тепловий ефект за формулою (1.10).
Опрацювання результатів
1. Обчислюють питому теплоту розчинення невідомої солі(теплота
розчинення 1 г), Дж/г: |
|
||
q = |
Q |
(1.14) |
|
mc |
|||
|
|
||
де Q – калориметричний тепловий ефект; mс – маса солі.
Перевіряють одержаний результат у викладача, порівнюючи з табличним
значенням. |
|
2. Знаючи назву солі, відповідно, її молярну масу(М, |
г/моль)), |
визначають інтегральну теплоту розчинення цієї солі DНр , кДж/моль |
(1.15) |
DH р = q × M |
3. Знайдену інтегральну теплоту розчинення порівнюють з табличним значенням і обчислюють відносну похибку експерименту за формулами (1.16).
D = |
|
q |
розрах - qтабл . |
×100% |
;або D = |
|
|
DН |
розрах |
- DН |
табл . |
|
×100% |
|
|
|
|||||||||||
|
|
qтабл . |
|
|
|
|
|
|
|||||
|
|
|
|
|
DН табл . |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|||
(1.16)
Питання для самоперевірки
1. |
Сформулюйте перший закон термодинаміки та |
наведіть його |
||||
аналітичний вираз. |
|
|
|
|
||
2. |
Дайте |
визначення |
внутрішньої |
енергії |
системи. Яка |
функція |
називається функцією стану? |
|
|
|
|
||
3.Сформулюйте закон Гесса.
4.Що називається тепловим ефектом хімічної реакції?
9
5.В яких випадках застосовують закон Гесса для розрахунку теплових
ефектів?
6.Які теплові ефекти виникають під час розчинення солі?
7.Що називається теплотою розчинення речовини?
8. |
Що розуміють під інтегральною і |
диференціальною |
теплотами |
|
розчинення речовини? |
|
|
||
9. |
В чому |
суть калориметричного способу вимірювання теплового |
||
ефекту? |
|
|
|
|
10. |
Що таке стала (водяний еквівалент) калориметра і як її визначають? |
|||
11. |
Чому для |
визначенняDt необхідно |
накреслити графік |
зміни |
температури з часом?
Лабораторна робота № 2
ПОБУДОВА ТА АНАЛІЗ ДІАГРАМ СТАНУ ОБМЕЖЕНО РОЗЧИННИХ РІДИН
Мета |
роботи – |
ознайомитися з принципами |
фізико-хімічного |
аналізу і |
навчитися |
будувати за експериментальними |
даними діаграми |
стану двохкомпонентних рідких систем з обмеженою розчинністю компонентів.
Теоретичні відомості
Для аналізу поведінки систем, які складаються з декількох фаз застосовують фізико-хімічний метод, який ґрунтується на дослідженні зв’язків між складом системи (або іншими параметрами її стану) та її властивостями.
Однорідні частини гетерогенної системи називають фазою. Фаза – це сукупність гомогенних частин системи, однакових у всіх точках за складом та фізико-хімічними властивостями та розмежованих одна від одної поверхнею розділу. Кожна з фаз гетерогенної системи може складатися з кількох речовин. Речовина при зміні тиску та температури може переходити з одно агрегатного стану в інший. Ці переходи називають фазовими переходами.
Фазове перетворення (фазовий перехід) – процес переходу речовини з однієї фази в іншу, в якому не відбувається хімічних реакцій. Це такі процеси як випаровування, сублімація, плавлення та ін.
Характеристики систем з фазовими переходами прийнято відображати у вигляді графічної залежності стану системи від зовнішніх умов– так званих
діаграм стану.
Аналіз діаграм стану дозволяє визначити кількість фаз в системі, межі їх існування, характер взаємодії компонентів.
Діаграми стану також дають можливість виявити наявність хімічних сполук в системі, склад цих сполук, температуру фазових перетворень тощо. Якщо в системі досліджується залежність температури плавлення від складу, одержують діаграму плавкості. Якщо криві будують в координатах електрична
10
провідність – склад, в'язкість – склад або температура змішування двох рідин – |
|
||||||||||||
склад, отримують відповідно діаграму електричної провідності, в'язкості або |
|
||||||||||||
розчинності. Будь-яка точка на діаграмі стану( . |
з. |
фігуративна |
точка) |
|
|||||||||
відповідає певному стану системи з визначеними значеннями параметрів стану. |
|
||||||||||||
Теоретична основа фізико-хімічного аналізу – правило фаз Гіббса. |
|
|
|
||||||||||
Правило фаз Гіббса: у термодинамічній системі, що перебуває у стані |
|
||||||||||||
рівноваги, на яку з усіх можливих факторів діють лише температура та тиск, |
|
||||||||||||
число |
термодинамічних |
|
степенів |
вільності |
визначається |
різницею |
між |
||||||
кількістю компонентів К і кількістю фаз Ф плюс два. |
|
|
|
|
|
|
|||||||
|
С |
|
|
|
|
С=К–Ф+2 |
|
|
|
(2.1) |
|
||
де |
– |
число |
степенів |
вільності– це |
|
кількість |
незалежних |
||||||
термодинамічних параметрів системи, які можна одночасно та незалежно |
|
||||||||||||
змінювати, не викликаючи зникнення або появи |
нових ;фазК – кількість |
|
|||||||||||
незалежних компонентів системи– це мінімальна кількість незалежних |
|
||||||||||||
складових, за допомогою яких можна виразити склад любої фази даної системи; |
|
||||||||||||
Ф – кількість фаз (число однорідних частин системи, які мають визначений |
|
||||||||||||
хімічний склад і термодинамічні властивості, відокремлених від інших фаз |
|
||||||||||||
поверхнею поділу); |
2 – число зовнішніх чинників, які обумовлюють існування |
|
|||||||||||
системи, наприклад, тиск і температура. Якщо один із цих чинників сталий, |
|
||||||||||||
замість "2" в рівнянні пишуть "1". |
|
|
|
|
|
|
|
||||||
Система з одним степенем вільності називається моноваріантною. Якщо |
|
||||||||||||
число ступенів вільності дорівнює нулю, система називається нонваріантною. |
|
||||||||||||
Таким чином, число ступенів вільності за правилом фаз Гіббса можна виразити |
|
||||||||||||
як різницю між кількістю компонентів і фаз плюс2. Число 2 показує, що всі |
|
||||||||||||
фази системи перебувають в рівновазі за двох заданих параметрів: температури |
|
||||||||||||
і тиску. В цьому випадку повну об'ємну діаграму стану будують в координатах |
|
||||||||||||
температура – тиск – склад. |
|
|
|
|
|
|
|
|
|
||||
Якщо процес |
відбувається за сталого тиску, будують пласку |
діаграму |
|
||||||||||
стану в координатах температура–склад (Т–N) і правило фаз Гіббса запишеться |
|
||||||||||||
так: С=К–Ф+1. |
|
|
|
|
|
|
|
|
|
|
|
||
Температура, |
за якої |
фази |
перебувають |
в |
рівновазі, є |
основною |
|
||||||
характеристикою фазового перетворення. |
|
|
|
|
|
|
|||||||
Обмежена |
|
взаємна |
розчинність двох |
рідин |
спостерігається |
у |
|||||||
системах зі значним відхиленням від ідеальності. Така розчинність |
|
||||||||||||
компонентів системи залежить від температури, проте вплив останньої |
на |
|
|||||||||||
різні системи неоднаковий. В одних системах взаємна розчинність рідин |
|
||||||||||||
збільшується |
|
з |
підвищенням температури |
і при цьому склад двох |
|||||||||
рівноважних фаз зближується. За деякої температури, яку називають |
|
||||||||||||
критичною температурою розчинення (КТР), склад обох рівноважних фаз |
|
||||||||||||
стає однаковим і досягається повна гомогенність системи. При обмеженій |
|
||||||||||||
розчинності двох рідин утворюється двошарова система: верхній і нижній |
|
||||||||||||
шари мають різний склад і становлять |
насичений |
розчин |
за |
даної |
|||||||||
температури однієї рідини в іншій. Між ними існує чітка межа поділу. |
|
|
|||||||||||
Взаємна розчинність двох рідин значною мірою залежить від зміни |
|
||||||||||||
температури. |
З |
ростом |
температури збільшується |
кількість |
молекул |
з |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
11 |
|

підвищеним запасом енергії руху, які здатні здійснити роботу переходу через межу поділу фаз . Отже, збільшується і взаємна розчинність рідин . Таким чином, склад спряжених розчинів буде дедалі зближуватися і за якоїсь температури зрівняється. Ця температура, починаючи з якої і вище рідини необмежено розчиняються одна в одній, називається верхньою критичною температурою розчинення.
Системи, що складаються із двох обмежено розчинних рідин, взаємна |
|
||||||||||
розчинність яких зростає із підвищенням температури, називаються системами |
|
||||||||||
з верхньою КТР. До них належать система вода–анілін, вода–фенол, вода– |
|
||||||||||
нітробензол. Залежність взаємної розчинності рідин від температури за сталого |
|
||||||||||
тиску відображають на діаграмах стану в координатах температура–склад. |
|
|
|||||||||
|
|
|
|
|
На |
|
рис. |
2.1 |
наведена |
|
|
|
|
|
|
|
діаграма стану для системи вода– |
|
|||||
|
|
|
|
|
анілін. На цій діаграмі крива аКв |
|
|||||
|
|
|
|
|
називається кривою розшарування |
|
|||||
|
|
|
|
|
і розділяє діаграму на дві |
|
|||||
|
|
|
|
|
частини: |
гомогенну, |
яка |
|
|||
|
|
|
|
|
знаходиться |
|
вище |
кривої |
|||
|
|
|
|
|
розшарування, і гетерогенну, яка |
|
|||||
|
|
|
|
|
знаходиться |
|
нижче |
кривої |
|||
|
|
|
|
|
розшарування. |
|
|
|
|
||
|
|
|
|
|
Фігуративні |
|
точки |
|
в |
||
Рис. 2.1 |
Діаграма |
взаємної |
гомогенній |
області, наприклад |
|
||||||
точка |
d, |
відображають |
стан |
|
|||||||
розчинності води й аніліну за Р=сonst |
|
однофазної |
|
двохваріантної |
|
||||||
|
|
|
|
|
системи (С=2–1+1=2). |
|
|
|
|||
Будь-яка фігуративна точка, що лежить всередині гетерогенної області, |
|
||||||||||
наприклад точка 0, відображає стан двохфазної рівноважної системи з одним |
|
||||||||||
ступенем вільності (С=2–2+1=1). Склади рівноважних рідких фаз знаходяться |
|
||||||||||
за правилом з'єднувальної прямої(правило важеля), |
відповідно |
з |
яким |
|
|||||||
фігуративні точки, що відображають склад усієї системи у цілому і склади |
|||||||||||
окремих рівноважних фаз, лежать на одній прямій – ноді (ізотерма). |
|
|
|
||||||||
Так, |
суміш |
складу x, відображена |
на |
діаграмі |
фігуративною |
точкоюО, |
|
||||
розшаровується на дві рівноважні фазиа і b(пряма ав – нода) |
складу x1, і х2. |
|
|||||||||
Характерна особливість систем, що розшаровуються, полягає у тому, що зі |
|
||||||||||
зміною |
складу |
всієї |
системи |
при |
даній |
температурі |
склади |
окрем |
|||
рівноважних фаз залишаються без змін, а змінюється лише їх кількісне співвідношення. Зі зміною температури склади рівноважних рідких фаз змінюються. В точці К розчини стають тотожними, система стає гомогенною.
Система, що відображена на діаграмі точкоюК, за умови сталого тиску (P=const) буде безваріантною (С=2–З+1=0). Для визначення положення критичної точки К на діаграмі застосовується правило Б.Ф. Алексєєва (правило важеля), відповідно до якого середини нод(точки g та l), що знаходяться між точками, які відображають склади рівноважних фаз(x1, і х2) лежать на одній прямій (лінія g, l), спрямованій до критичної точки K.
12

Більшість |
сумішей, |
в |
|
яких |
взаємна |
розчинність |
|
двох рідин збільшується зі |
|||
зниженням |
температури, |
||
називається |
системами |
з |
|
нижньою |
критичною |
||
температурою |
розчинення |
||
(КТР). |
Прикладом може |
||
бути |
система |
– вода |
|
триметилпіридин (рис. 2.2).
Рис. 2.2. Діаграма стану вода– триметилпіридин з нижньою критичною температурою розчинення
|
|
|
|
Інколи |
|
|
взаємна |
|
|
|
|
|
розчинність |
|
|
рідин |
|
|
|
|
|
збільшується |
|
як |
з |
|
|
|
|
|
підвищенням температури, |
так |
|||
|
|
|
|
і з її зниженням(системи з |
||||
|
|
|
|
верхньою і нижньою )КТР. |
||||
|
|
|
|
Прикладом |
такої |
системи |
||
|
|
|
|
може |
бути |
діаграма |
стану |
|
|
|
|
|
вода–нікотин (рис. 2.3). |
|
|
||
|
Рис. |
2.3 |
Діаграма стану |
система |
|
|
|
|
|
вода–нікотин з верхньою та нижньою |
|
|
|
|
|||
|
критичними |
температурами розчинення |
|
|
|
|
||
|
(Р= сonst) |
|
|
|
|
|
|
|
|
|
|
Завдання на виконання роботи |
|
|
|
|
|
1. |
Експериментально визначити |
температури |
взаємного |
розчинення |
||||
однієї рідини в іншій для двохкомпонентної системи обмежено розчинних |
||||||||
рідин з різним співвідношенням компонентів. |
|
|
|
|
||||
2. |
На підставі |
експериментальних даних побудувати |
діаграму |
стану |
||||
температура – склад для даних систем.
Прилади, лабораторний посуд та реактиви
Електроплитка, водяна баня, штатив з набором запаяних пронумерованих пробірок, в яких міститься суміш фенолу і води або гліцерину і ізоамілового спирту з різним співвідношенням компонентів, таблиця, у якій наведено склад сумішей в пробірках, термометр, затискач для пробірок.
13
Порядок виконання роботи
1.Одержують у лаборанта штатив з набором запаяних пробірок, склад суміші яких наведений у таблиці, що додається до штативу.
2.Заповнюють водяну баню на 3/4 водопровідною водою.
3.Пробірку закріплюють в затискач і занурюють у водяну баню, яку ставлять на електроплитку і повільно нагрівають. Температуру води у водяній бані вимірюють термометром. Суміш в пробірці періодично збовтують. Фіксують температуру гомогенізації суміші, за якої каламутна рідина стане прозорою.
4.Охолоджують суміш та відмічають температуру гетерогенізації
суміші, за якої рідина у пробірці знову стане каламутною. Якщо результати процесу охолодження співпадають з результатами процесу
нагрівання, переходять до іншої пробірки з сумішшю |
і проводять |
|||||||||
аналогічний дослід. Результати обох вимірювань не повинні відрізнятись |
||||||||||
більше, ніж на 1 ˚С. |
|
|
|
|
|
|
|
|
|
|
5. Результати кожного досліду заносять до таблиці: |
Таблиця |
|||||||||
|
|
|
|
|
|
|
|
|||
Номер пробірки |
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
Масова частка |
|
|
|
|
|
|
|
|
|
|
речовини |
|
|
|
|
|
|
|
|
|
|
Температура |
|
|
|
|
|
|
|
|
|
|
гомогенізації |
|
|
|
|
|
|
|
|
|
|
Температура |
|
|
|
|
|
|
|
|
|
|
гетерогенізації |
|
|
|
|
|
|
|
|
|
|
Середня |
|
|
|
|
|
|
|
|
|
|
температура |
|
|
|
|
|
|
|
|
|
|
6. На основі отриманих результатів будують діаграму середня температура – склад. Визначають критичну температуру розчинення. Розраховують степені вільності та склад фаз для , точоквказаних викладачем на діаграмі температура розчинення – склад.
Опрацювання результатів
За допомогою правила важеля з діаграми можна визначити не лише число рівноважних фаз та їх склад, але й кількісні співвідношення між масами фаз: маси рівноважних фаз обернено пропорційні до відрізків, на які поділяє ноду фігуративна точка системи (рис. 2.1):
|
|
|
g1 |
= |
Ob |
|
|
(2.2) |
|
|
|
g 2 |
Oa |
|
|||
|
|
|
|
|
|
|||
Степені |
вільності |
системи(число |
змінних |
термодинамічних |
||||
параметрів в системі) визначаються за правилом фаз Гіббса (2.1).
14
Оскільки досліди з визначення температури гомогенізації та розшарування шляхом нагрівання та охолодження двохкомпонентних
систем |
проводять |
за |
сталого , тискуправило |
фаз |
Гіббса |
для |
||||||
двохкомпонентної системи можна записати: |
|
|
(2.3) |
|
||||||||
|
|
|
|
|
С = К - Ф +1 = 3 - Ф |
|
|
|
||||
Оскільки |
студент |
|
одержує |
системи |
фенол–вода |
та ізоаміловий |
||||||
спирт–гліцерин у запаяних ампулах, похибка проведення експерименту |
|
|||||||||||
буде залежати тільки від вимірів температури |
розшарування, яка |
|
||||||||||
визначається |
за допомогою |
термометра |
100на |
°С. |
Вимірювання |
|
||||||
температури проводиться з точністю до одного градуса. Тоді загальна |
|
|||||||||||
похибка експерименту: |
|
DT |
|
1 |
|
|
|
|
|
|
||
|
|
|
|
= |
|
×100% = 1% . |
|
|
|
|
||
|
|
|
|
T |
|
|
|
|
|
|||
|
|
|
|
100 |
|
|
|
|
|
|
||
Питання для самоперевірки
1.У чому суть фізико-хімічного аналізу?
2.Дайте визначення поняттям фаза, фазовий перехід, компонент, незалежний компонент, степінь вільності?
3.Сформулюйте правило фаз Гіббса.
4.Застосуйте правило фаз до двокомпонентних систем за умови змінних тиску та температури. Розрахуйте максимальну кількість рівноважних фаз.
5.Дайте визначення поняттю «нода»?
6.Сформулюйте правило Алексєєва щодо визначення кількісного співвідношення між масами рівноважних фаз в даній точці за діаграмою стану.
7.Фізичний зміст критичної точки двокомпонентної рідкої системи.
8.Які системи називають системами з верхньою КТР? Накреслити,
як приклад, діаграму стану.
9. Які системи називають системами з нижньою КТР? Накреслити, як приклад, діаграму стану.
Лабораторна робота № 3
КРІОМЕТРИЧНЕ ВИЗНАЧЕННЯ МОЛЯРНОЇ МАСИ РЕЧОВИНИ
Мета роботи - ознайомитися з кріометричним методом визначення молярної маси розчиненої речовини.
Теоретичні відомості
Визначення молярної маси базується на властивості розчинів замерзати за
температури, нижчої |
за |
температуру |
замерзання |
чистого |
розчинника. |
Залежність температури |
замерзання розчину |
від його концентрації |
кількісно |
||
|
|
|
|
|
15 |
описує фізична теорія розчинів. Ця теорія розглядає так званіідеальні розчини, тобто такі, для яких відсутні явища асоціації, дисоціації, сольватації та ін. Близькими за властивостями до ідеальних є дуже розведені розчини.
Якщо до складу розчину входить леткий розчинник (вода, спирт, бензол та ін.), в якому розчинена якась нелетка речовина(сахароза, сіль та ін.), то чим вища концентрація розчину, тим нижчий тиск насиченої пари (пружність пари) розчинника над ним. Кількісну сторону цієї закономірності описує закон Рауля:
відносне зниження тиску насиченої пари розчинника над розчином дорівнює молярній частці розчиненої речовини:
DP |
= |
P0 - P |
= N |
2 |
(3.1) |
|
P0 |
P0 |
|||||
|
|
|
де Ρ – тиск насиченої пари розчинника над розчином; Ро – тиск насиченої пари над чистим розчинником; Ρ–Ρо – зниження тиску насиченої пари розчинника над розчином; N2 – молярна частка розчиненої речовини. Закон
використовується тільки для ідеальних або для нескінченно розведених розчинів.
Молярною часткою i-го компонента розчину(Ni) є відношення кількості молів цього компонента до сумарної кількості молів всіх компонентів розчину:
|
|
Ni = |
|
|
|
|
ni |
|
|
|
|
= |
ni |
(3.2) |
||
|
|
|
|
|
|
|
|
|
|
|
|
i |
|
|||
|
|
|
n1 + n2 + ... + ni + ... + nk -1 + nk |
åni |
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
i |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
Рівняння |
(3.1) |
можна |
використати для |
визначення |
молярної маси |
|||||||||||
розчиненої речовини (М). Запишемо рівняння для двокомпонентного розчину: |
||||||||||||||||
|
|
|
|
|
N2 = |
|
|
n2 |
|
, |
|
|
|
|
(3.3) |
|
|
|
|
|
|
n1 |
|
|
|
|
|
|
|||||
де n1 |
та n2 – |
|
|
|
|
|
+ n2 |
|
|
|
||||||
кількість |
|
молів |
відповідно |
розчинника |
та розчиненої |
|||||||||||
речовини. Тоді |
|
|
|
DР |
n 2 |
|
|
|
||||||||
|
|
|
|
|
|
|
(3.4) |
|||||||||
|
|
|
|
|
|
= |
|
|
|
|
|
|||||
|
|
|
|
|
Р о |
n1 + n 2 |
|
|
||||||||
Оскільки розчин є дуже розведеним, значенням n2 можна знехтувати у |
||||||||||||||||
порівнянні зі значенням n1 в знаменнику і рівняння буде мати вигляд |
|
|||||||||||||||
|
|
|
|
|
|
D Р |
= |
n 2 |
|
|
(3.5) |
|||||
|
|
|
|
|
|
Р о |
n1 |
|
|
|
||||||
Позначимо g1 – масу наважки розчинника; g2 – масу наважки розчиненої речовини, a M1 та M2 – молярні маси відповідно розчинника і розчиненої речовини. Тоді n1=g1/M1 і n2=g2/M2. Підставимо значення n1 та n2 в (3.5) і одержимо:
|
DР |
= |
g2 × M1 |
|
|
(3.6) |
|||
|
|
|
g1 × M 2 |
||||||
Звідки |
Ро |
|
|
||||||
|
|
|
g2 × M1 |
|
|
||||
M 2 |
= |
|
|
(3.7) |
|||||
g1 ×(DP / Po ) |
|||||||||
|
|
|
|||||||
Різниця у тиску насиченої пари над розчином і розчинником є малою та |
|||||||||
незручною для експериментального |
|
визначення |
з достатньою точністю. |
||||||
|
|
|
|
|
|
|
|
16 |
|

Набагато легше вимірювати інші величини, які залежать від зниження тиску насиченої пари. До них належить зміна температур кипіння та замерзання
розчинів порівняно з відповідними значеннями для чистого розчинника. |
|
|
||||||
Залежність між тиском насиченої пари і температурою |
розчинника і |
|||||||
розчинів різної концентрації зображено на рис. 3.1. |
|
|
|
|
|
|
|
|
|
Крива |
1 |
показує |
залежність |
||||
|
тиску |
|
насиченої |
пари |
над |
|||
|
розчинником |
від |
температури, |
|
||||
|
крива |
2 |
– |
залежність |
тиску |
|
||
|
насиченої |
|
пари |
|
того |
самого |
||
|
розчинника від температури над |
|
||||||
|
розчином |
з |
концентрацією C1; |
|
||||
|
крива 3 – те саме над розчином з |
|
||||||
|
більшою |
концентрацією |
С2. |
|
||||
|
Крива ОВ2 дає зміну тиску пари |
|
||||||
|
над твердою фазою розчинника |
|
||||||
Риc. 3.1. Залежність тиску насиченої |
(у випадку |
водних |
розчинів– |
|
||||
над |
льодом |
за |
температур |
|||||
пари над розчинником і розчином від нижчих за нуль). температури
В точці 0 співіснують одночасно рідка фаза– вода та тверда фаза–лід з рівноважним тиском насиченої париРо. Цій точці відповідає температура замерзання води – Т 3о .
Розглянемо, як змінюється температура замерзання розчинів зі зміною їх концентрації і, відповідно, зі зміною тиску насиченої пари над ними.
При замерзанні розведеного розчину з нього кристалізується чистий розчинник. Замерзання розчину на відміну від чистої рідини йде в деякому інтервалі температур. Перші кристали розчинника виділяються за певної температури (при цьому концентрація розчину збільшується); подальше
виділення кристалів з розчинів проходить при зниженні |
температури. |
||
Температурою замерзання розчину певної концентрації називають температуру, |
|||
за якої з'являються перші кристали розчинника. |
|
||
Розглядаючи рис. 3.1, можна |
зробити висновок, що температура |
||
замерзання відповідних розчинів Т 31 |
та Т 32 |
нижча за температуру замерзання |
|
чистого розчинника Т 3о . Різниця |
між |
температурою замерзання |
чистого |
розчинника і розчину називається зниженням температури замерзання |
T3: |
||
DТ з = Т з0 -Т 1з |
(3.8) |
||
Здопомогою термодинамічних розрахунків можна показати, що між
зниженням |
температури |
замерзання |
і |
концентрацією |
розчину |
існ |
прямопропорційна залежність: |
DТ з = К к |
× С |
|
(3.9) |
|
|
|
|
|
|
|||
де Т3 – зниження температури замерзання розчину; Кк – кріоскопічна стала; С – моляльна концентрація розчину, г/л.
17
Кріоскопічна стала чисельно дорівнює зниженню температури замерзання одномоляльного розчину за умови, що розчин цієї концентрації має властивості ідеального, а розчинена речовина не дисоціює на іони.
Кріоскопічна стала дорівнює:
|
|
|
|
|
|
Kk = |
|
R ×(T o |
)2 |
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
(3.10) |
|
|
||
|
|
|
|
|
|
|
|
1000 ×l |
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
де R |
– |
універсальна газова |
стала; l – |
|
питома |
теплота |
кристалізації |
|
|||||||||||||
розчинника. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
З (3.10) виходить, що кріоскопічна стала є величиною, що залежить тільки |
|
||||||||||||||||||||
від природи розчинника. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Концентрація |
розчиненої |
речовини |
|
|
|
|
подається |
|
як |
кількість |
молів |
||||||||||
розчиненої |
|
речовини |
|
у 1000 г |
розчинника. Тоді |
у |
формулі(3.9) цю |
|
|||||||||||||
концентрацію можна виразити через маси розчинника g1 |
і розчиненої речовини |
|
|||||||||||||||||||
g2 міркуючи таким чином: якщо розчин вміщує g2 грамів розчиненої речовини, |
|
||||||||||||||||||||
що становить g2/M моль (М – молярна маса розчиненої речовини) у g1 грамах |
|
||||||||||||||||||||
розчинника, |
на 1000 г розчинника припадає C моль розчиненої речовини: |
|
|||||||||||||||||||
|
|
|
|
|
|
С = |
1000 × g |
2 |
|
|
|
|
|
|
|
(3.11) |
|
|
|||
|
|
|
|
|
|
|
|
M × g1 |
|
|
|
|
|
|
|
|
|
|
|||
Тоді рівняння (3.9) набирає вигляду |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
1000 × g2 |
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
Tз = К |
к |
|
|
|
|
(3.12) |
|
|
|||||||
|
|
|
|
|
|
|
M × g1 |
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
Рівняння (3.12) вирішують відносно молярної маси розчиненої речовини: |
|
||||||||||||||||||||
|
|
|
|
|
М = К к |
|
1000 × g2 |
. |
|
|
|
(3.13) |
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
Т з × g1 |
|
|
|
|
|
|
|||||
Кріоскопічні сталі деяких розчинників наведені в табл. 3.1. |
Таблиця 3.1 |
|
|||||||||||||||||||
|
|
|
Кріоскопічні сталі деяких розчинників |
|
|||||||||||||||||
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
Розчинник |
|
|
Кк |
|
|
|
|
|
Розчинник |
|
|
Кк |
|
||||||||
Вода |
|
|
|
|
1,86 |
|
|
|
|
|
Фенол |
|
|
|
7,80 |
|
|
||||
Нітробензол |
|
|
5,90 |
|
|
|
|
|
Камфора |
|
|
|
49,00 |
|
|
||||||
Бензол |
|
|
|
5,10 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
Зниження тиску насиченої пари над розчином так само, як і зниження |
|
||||||||||||||||||||
температури замерзання розчину залежить лише від кількості часток, молекул, |
|
||||||||||||||||||||
іонів, асоціатів розчиненої речовини і не залежить від природи цих частинок. |
|
||||||||||||||||||||
Зазначені |
властивості |
одержали |
назвуколігативних властивостей розчинів. |
|
|||||||||||||||||
Відомо, що 1 моль речовини вміщує NА= 6,02×1023 молекул (стала Aвогадро). Однак, якщо утворення розчину супроводжується асоціюванням молекул розчиненої речовини, тобто утворенням часток, що складаються з груп молекул, при розчиненні 1 моль речовини, утворюється менша кількість часток
у розчині (N£NА), тобто концентрація виявиться меншою порівняно з тією, що була б за відсутності асоціації. Це призводить до того, що зменшення
18

температури замерзання розчину DTз = Tз0 -Tз1 |
виявиться |
замалим, а |
розрахована молярна маса буде завеликою. |
|
|
При розчиненні електроліту дисоціація його |
молекул |
призводить до |
збільшення кількості частинок у розчині залежно від природи електроліту і ступеня його дисоціації. В цьому випадку(N> NА) концентрація виявиться більшою за розраховану і зниження температури замерзання розчину буде завеликим, а розрахована молярна маса – замалою.
Одержані таким чином молярні маси називають "уявними".
Для слабкого електроліту відношення істинної молярної масиМ до
іст
"уявної" Муяв показує в скільки разів збільшилась кількість частинок в розчині внаслідок дисоціації:
М іст М уяв = і |
(3.14) |
||
Число і називається ізотонічним коефіцієнтом Вант-Гоффа. Залежність між |
|||
ізотонічним коефіцієнтом і та ступенем дисоціації a така: |
|
||
і = 1 + a × (n - 1) |
(3.15) |
||
звідки |
|
||
a = |
i - 1 |
|
(3.16) |
|
|||
n - 1 |
|
||
де n – кількість іонів, на які дисоціює молекула в розчині.
Якщо розчинення неелектроліту не супроводжується його асоціацією (наприклад, утворення водних розчинів невеликих концентрацій сахарози, сечовини), кріометричні вимірювання дають істині значення молярної маси. Таким чином, у водних розчинах істинна молярна маса визначається тільки у випадку неелектролітів (сахароза, глюкоза та ін.).
При визначенні істинної молярної маси електролітів кріометричним методом, необхідно використовувати органічні розчинники, в яких розчинена речовина не дисоціює.
Визначення температури замерзання чистого розчинника
Найчастіше охолодження рідини до температури замерзання не спричинює утворення твердої фази(льоду). Рідина, що має температуру нижчу за
температуру |
її |
замерзання, називається |
переохолодженою. |
Іноді |
||
переохолодження може досягати кількох градусів, що призводить до нових |
||||||
ускладнень |
при |
визначенні |
температур |
замерзання. Переохолодження |
||
неоднаково |
впливає |
на визначення |
температур замерзання розчинника і |
|||
розчину. |
|
|
|
|
|
|
Якщо |
зміну температури води з часом подати в системі координат |
|||||
температура–час, одержимо криву (рис. 3.2). В початковий момент часу вода |
||||||
мала температуру оточуючого середовищаT1 – точка а на кривій. До часу t2 |
||||||
вода досягла температури замерзання Т о |
– точка в, але не замерзла і до часу t , |
|||||
|
|
|
3 |
|
|
3 |
в точці с зазнала переохолодження до Т2
19

|
|
На |
|
ділянці вс |
|
|
|
|
відбувалось |
|
точці с |
|
|
|
|
переохолодження. В |
|
|||
|
|
почали |
швидко |
випадати |
||
|
|
кристали льоду. Температура |
|
|||
|
|
замерзаючої води за рахунок |
|
|||
|
|
теплоти |
|
кристалізації |
||
|
|
підвищилась |
і |
|
стала |
|
|
|
дорівнювати |
температурі |
|||
|
|
замерзання |
Т3о |
(точка d). |
|
|
|
|
Різниця Т3о –Т2 |
називається |
|
||
|
|
температурою |
переохолод- |
|||
|
|
ження. |
|
Подальше |
|
|
Рис. 3.2. Термографічна |
крива |
охолодження |
не |
веде |
до |
|
зменшення |
|
температури, |
|
|||
охолодження води |
|
|
|
|||
|
вона залишається сталою Т 3о , |
|
||||
бо в рівновазі співіснують фази: пара–вода–лід. Температура залишається сталою доки в системі існують усі три фази, тобто поки не замерзла вся вода.
Замерзання всієї води при охолодженні веде до подальшого зниження температури і, починаючи з точки f, йде охолодження льоду.
На практиці, спостерігаючи меніск у термометрі, при охолодженні рідини будемо бачити, що температура води постійно знижується, потім різко зростає і встановлюється на сталому значенні протягом значного .часуЦе й буде температура замерзання води.
Температуру замерзання визначають не менше як два рази. Відхилення не повинно становити більше як 0,01 °С.
Температура переохолодження може бути більшою або меншою залежно від умов заморожування. При перемішуванні вона є набагато меншою, оскільки за цих умов легше виникають центри кристалізації. При визначенні Т3о води переохолодження не збільшує похибку. Енергійне та рівномірне перемішування пришвидшує вимірювання.
Визначення температури замерзання розчину
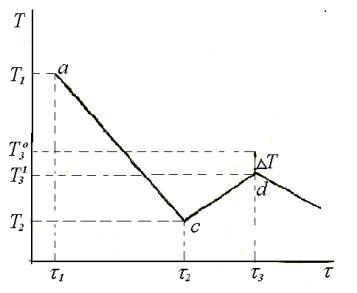
При охолодженні розчину температура його знижується, він може охолодитись нижче температури замерзання– стати переохолодженим (рис. 3.3).
20
В момент часу τ1 |
розчин |
|
|||
мав температуру Т1. |
З |
часом |
за |
||
розчин |
|
охолоджується |
|||
прямою |
ас. |
У точці |
с |
розчин |
|
настільки |
переохолоджується, |
|
|||
що |
починає |
замерзати |
і |
||
утворюються |
|
|
кристали |
||
розчинника (води). Виділення |
|
||||
льоду |
підвищує |
температуру |
|
||
розчину |
за |
рахунок |
теплоти |
||
кристалізації і в точціd часу t3 |
|
||||
розчин |
буде |
мати температуру |
|
||
замерзання розчину Т 31 . |
|
|
|||
Рис. 3.3. |
Термографічна |
крива |
охолодження розчину |
|
|
Різниця між |
величинами Т3о |
(температура замерзання розчинника) і Т31 |
(температура замерзання розчину) визначає величину DТ.
Завдання на виконання роботи
1. За допомогою кріоскопа провести дослідження щодо замерзання розчинника при поступовому зниженні температури в часі.
2. Побудувати термографічну криву та визначити температуру замерзання розчинника.
3.Провести аналогічні експерименти з розчином певної концентрації.
4.Визначити зниження температури замерзання розчину в порівнянні з розчинником.
5.Визначити молярну масу розчиненої речовини.
Установки, прилади, лабораторний посуд, реактиви
Кріоскоп (мікрохолодильник), випрямлювач постійного струму, термометр Бекмана, пробірка, мішалка, вода, сіль.
Мікрохолодильник використовують для одержування низьких температур за допомогою термоелектричної батареї. Під час проходження постійного струму крізь контакт різнорідних провідників в залежності від напрямку струму виділяється або поглинається деяка кількість . теплотиВпатрон мікрохолодильника вставляють пробірку з широким горлом, закривають її корком, в який вставлено термометр Бекмана та мішалку.
Термометр Бекмана використовують для визначення відносної відносної зміни температури (до 5–6 ºС), має ціну поділки0,01 ºС. Він із великою точністю вимірює малі зміни температури. Термометр складається з основного і додаткового резервуарів ртуті, сполучених між собою капіляром. Лаборант налаштовує термометр для кріометричних вимірювань.
21

Порядок виконання роботи
1. В суху широкогорлу пробірку наливають таку кількість розчинника, щоб його рівень був вищий ртутної кульки термометра на8–10 мм. Поміщений в пробірку з рідиною термометр Бекмана з мішалкою треба встановити так, щоб відстань між ртутною кулькою і стінками пробірки була приблизно однаковою знизу і з боків. Потім термометр витягують з пробірки і вимірюють об’єм цієї рідини мірним циліндром. Вважаючи, що густина води дорівнює одиниці,
визначають масу розчинника g1. |
Бекмана |
та |
мішалкою |
||
2. Пробірку |
з |
розчинником, термометром |
|||
встановлюють в |
патрон |
мікрохолодильника і при |
постійному |
перемішуванні |
|
охолоджують розчинник. За термометром Бекмана визначають зниження температури з часом до встановлення рівноваги(до сталої температури, дослід повторюють двічі).
3. |
Будують |
термограму |
охолодження |
і |
визначають |
температуру |
|
замерзання розчинника Т30, тобто коли в рівновазі знаходяться три фази пара– |
|||||||
вода–лід (рис. 3.2). Коли замерзне вся вода іде переохолодження льоду. |
|
||||||
4. |
Виймають з пробірки термометр Бекмана. Отримують робочу сіль і в |
||||||
широкогорлу пробірку вносять речовину, що розчиняється шляхом висипання |
|||||||
із попередньо зваженої на технічних терезах маленької |
пробірки. Потім |
||||||
маленьку пробірку знову зважують. За різницею визначають масу наважки |
|||||||
розчиненої речовини g2. |
|
|
|
|
|
||
5. |
При постійному перемішуванні охолоджують розчин і за термометром |
||||||
Бекмана визначають зниження температури з часом до встановлення рівноваги |
|||||||
(дослід повторюють двічі), фіксують температуру замерзання розчину Т31. |
температуру |
||||||
6. |
Будують |
термограму |
охолодження |
і |
визначають |
||
замерзання розчину Т31 (рис. 3.3). Розбіжність |
між |
двома |
послідовними |
||||
вимірами не повинна перевищувати 0,01 ºС. |
|
|
|
|
|||
Опрацювання результатів
1. Обчислюють зниження температури замерзання розчину за рівнянням
3.8. |
|
|
|
|
|
|
2. |
При визначенні істинної молярної маси електролітів кріометричним |
|||||
методом, необхідно використовувати органічні розчинники, в яких розчинена |
||||||
речовина не дисоціює. Обчислюють молярну масу розчиненої речовини за |
||||||
рівнянням 3.13. |
|
|
|
|
|
|
3. |
Порівнюють одержані значення молярної маси |
з |
довідковими |
|||
значеннями, що знаходяться у лаборанта. |
|
|
|
|||
4. |
Якщо |
розчинена |
речовина |
неелектроліт, визначають |
похибку |
|
вимірювань і на цьому роботу закінчують. |
|
|
|
|||
5. |
Якщо |
розчинена речовина електроліт, визначена молярна |
маса |
буде |
||
“уявною”, тобто значно меншою за |
дійсне значення за рахунок процесу |
|||||
дисоціації розчиненої речовини. Тому знаходять відношення М іст М уяв |
= і . |
|
||||
|
|
|
|
|
|
22 |
6. Знаючи і (ізотонічний коефіцієнт), можна визначити ступінь дисоціації за рівнянням 3.16.
Питання для самоперевірки
1.Сформулюйте закон Рауля. Для яких розчинів справджується цей закон ?
2.Властивості якого компоненту розчину(розчиненої речовини чи розчинника) визначають кріоскопічну сталу?
3.Поясніть взаємозв’язок між зниженням тиску насиченої пари розчинника над розчином та зниженням температури замерзання розчину.
4.Поясніть зміст поняття “уявна” молярна маса розчиненої речовини.
5.Як практично визначити температуру замерзання розчину? Як визначити зниження температури замерзання розчину порівняно з розчинником?
6.Як визначити ступінь дисоціації слабкого електроліту за зниженням температури замерзання розчину?
7.Як обчислити молярну масу розчиненої речовини– неелектроліту за зниженням температури замерзання розчину?
8.Особливості термометра Бекмана. З якою точністю і в яких межах можна проводити виміри цим приладом?
9.Які величини можна розрахувати після експериментального визначення температури замерзання розчину?
Лабораторна робота №4
ЕЛЕКТРОПРОВІДНІСТЬ РОЗЧИНІВ ЕЛЕКТРОЛІТІВ
Мета роботи - ознайомитися з класичним методом визначення електропровідності розчинів слабких та сильних електролітів та навчитися розраховувати питому та еквіваленту електропровідності розчинів електролітів, ступінь та константу дисоціації розчинів слабких електролітів та коефіцієнт електропровідності сильних електролітів.
Теоретичні відомості
За електричною провідністю розрізняють провідники першого і другого роду. До перших належать всі метали та їх сплави, а до других – розчини і розплави електролітів. В розчинах електролітів електричний струм проводиться за допомогою іонів, які переміщуються до відповідних електродів.
Згідно з теорією Арреніуса, молекули електролітів у водних розчинах дисоціюють на іони, які і переносять електричний струм. Одні електроліти дисоціюють в розчинах повністю(сильні), інші частково (слабкі). Електрична провідність слабких електролітів визначається в основному ступенем дисоціації, яка залежить від концентрації електроліту і температури.
23
Властивість систем проводити електричний струм |
визначається |
|||
опором або електричною провідністю. Опір R провідника пропорційний |
||||
його довжині l (м) і обернено пропорційний площині |
поперечного |
|||
перерізу S (м2). |
|
|||
R = ρ |
l |
|
(4.1) |
|
S |
||||
|
|
|||
Коефіцієнт пропорційності r (Ом×м), який дорівнює опору провідника при l = 1 м і S= 1 м2 називається питомим опором.
Електрична провідність – величина, обернена опору, Ом-1:
|
|
I = |
1 |
, |
|
|
(4.2) |
||
|
|
|
|
|
|||||
|
|
|
|
|
R |
|
|
|
|
а питомa електричнa провідність c – величина, обернена питомому опору, |
|||||||||
См/м: |
|
|
1 |
|
|
|
|
|
|
|
|
c = |
|
|
|
(4.3) |
|||
|
|
r |
|
|
|||||
|
|
|
|
|
|
||||
Питома |
електрична |
провідність |
електроліту– електрична |
||||||
провідність розчину об’ємом 1 м3, що міститься між двома паралельними |
|||||||||
електродами, площа кожного з яких становить 1 м2. |
|
|
|
||||||
Питома |
електрична |
провідністьявляє |
собою |
струм, який |
|||||
переноситься через одиницю поперечного перерізу при градієнті потенціалу 1 В/м. Питома електрична провідність визначається швидкістю руху іонів (рухливістю), їх концентраціями в розчині і температурою.
Еквівалентна електрична провідність(молярна) визначається як
електрична провідність розчину , в об’ємі якого міститься |
1 |
г-екв |
|||||||
розчиненого електроліту і який розміщений між |
двома |
паралельними |
|||||||
металевими |
провідниками, віддаленими |
один |
від одного на1 |
м, |
[См×м2 |
||||
/моль]. |
|
|
λj |
= χ ×j ×1000 |
|
|
|
(4. 4) |
|
|
|
|
|
|
|
||||
де j = 1/С - розведення, |
тобто |
число літрів |
розчину, в |
якому |
|||||
міститься 1 |
г-екв розчиненої речовини. Враховуючи швидкість руху іонів |
||||||||
(катіонів та аніонів) |
(uk |
+ua ) , ступінь дисоціації електроліту a , |
коефіцієнт |
||||||
електропровідності |
fl , можна записати: |
|
|
|
|
|
|||
|
|
|
lj =a×F× fl ×(uk +ua). |
|
|
|
(4.5) |
||
де F - стала Фарадея |
|
|
|
|
|
|
|||
Прийнявши |
до |
уваги, що |
рухливість |
катіонів lk |
= F ×uk . |
і аніонів |
|||
la = F ×ua ., маємо |
|
lj =a × fl ×(lk +la ). |
|
|
|
|
|||
|
|
|
|
|
|
(4. 6) |
|||
Залежність від концентрації наведена на рис.4.1.
Питома електрична провідність розчинів зростає зі збільшенням
концентрації електролітів |
до певної межі , тому що в 1 мл об’єму |
збільшується кількість переносників електричного струму – іонів. Як видно |
|
з рис.4.1, для слабких |
електролітів при деякій концентрації питома |
|
24 |

електрична провідність зменшується, тому що зменшується |
ступінь їх |
||||
дисоціації. |
Для сильних електролітів |
||||
|
|||||
|
зі |
|
|
збільшенням |
|
|
концентрації зменшується |
||||
|
відстань |
між |
іонами, |
||
|
внаслідок |
чого |
зростає |
||
|
взаємне гальмування |
за |
|||
|
рахунок |
|
наявності |
||
|
електрофоретичного |
та |
|||
|
асиметричного ефектів |
,і |
|||
|
відповідно, |
зменшується |
|||
|
швидкість |
руху |
іонів. |
||
|
Крім того, зі збільшенням |
||||
|
концентрації |
електроліту |
|||
|
зростає в’язкість розчину, |
||||
|
що |
також |
гальмує |
рух |
|
|
іонів. |
|
|
|
|
Рис. 4.1. Залежність |
питомої |
|
|
|
|
електричної провідності від концентрації |
|
|
|
|
|
розчину сильного та слабкого електроліту |
|
|
|
|
|
|
|
Еквівалентна |
елект- |
||
|
рична провідність слабких |
||||
|
і |
сильних |
електролітів |
||
|
(рис. 4.2) збільшується з |
||||
|
розведенням: для слабких |
||||
|
– |
внаслідок |
збільшення |
||
|
ступеню |
|
дисоціації |
||
|
електроліту, |
для |
сильних |
||
|
– |
внаслідок |
зростання |
||
|
рухливості іонів. |
|
|
||
Рис. 4.2. Залежність еквівалентної електричної провідності від розведення розчину
Електрична провідність розчинів слабких електролітів
Врозчинах слабких електролітів при значних розведеннях іони
рухаються незалежно один від одного і їх електрична провідність при
25

нескінченному розведенні підпорядковується правилу адитивності, |
тому коли |
||
fl=1 рівняння (4.6) має вигляд |
|
||
l¥ =a ×(lk +la ) |
(4.7) |
||
При нескінченному розведені величина ступеню дисоціації прямує |
|||
до одиниці a=1, отже: |
|
||
l¥ = (lk + la ) |
(4.8) |
||
Виходячи із рівнянь 4.7 та 4.8, отримуємо закон Арреніуса: |
|
||
a = |
λj |
(4.9) |
|
|
|
||
λ ¥
Математичний вираз рівняння (4.8) отримав назву закону Кольрауша: еквівалентна електрична провідність при нескінченному розведенні дорівнює сумі рухливостей іонів.
Електрична дисоціація являє собою зворотній процес, тому до нього може бути застосований закон діючих мас і константа електролітичної дисоціації, наприклад, для оцтової кислоти може бути записана
К Д = СН + ×ССН 3СОО -
ССН3СООН
Якщо загальна концентрація С, а ступінь дисоціації a,
|
СН + = ССН 3СОО- |
= a ×С = ССН 3СООН = С × (1 -a) . |
|
||||||||
Тоді константа дисоціації з врахуванням (4.9) буде мати вигляд: |
|
||||||||||
К |
|
a ×С |
×a ×С |
|
a |
2 ×С |
|
lj2 ×С |
(4.10) |
||
Д = |
|
|
= |
|
|
|
= |
|
. |
||
С(1 |
-a) |
(1 |
-a ) |
|
|||||||
|
|
|
|
l¥ (l¥ - lj ) |
|
||||||
Рівняння (4.10) дістало назву закону розведення Оствальда, відповідно до якого константа електролітичної дисоціації за сталої температури не
залежить від концентрації розчину(як константа рівноваги процесу дисоціації).
|
Електрична провідність розчинів сильних електролітів |
|
|||||||||||
Сильні |
електроліти |
внаслідок |
|
повної |
дисоціації |
не |
підлягають |
||||||
закону |
діючих |
|
мас. Еквівалентна |
електрична |
провідність |
сильних |
|||||||
електролітів |
відрізняється |
від |
такої |
слабких |
електролітів |
не тільки |
|||||||
значенням, але |
й |
характером |
залежності |
від |
концентрації. Так, |
якщо |
|||||||
навести графічно залежність l від |
С , для слабких електролітів у ділянці |
||||||||||||
великих розведень одержується крива, а |
|
для |
сильних — пряма |
лінія, яка |
|||||||||
описується емпіричним рівнянням |
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
lj |
= l¥ - а |
С |
|
|
|
|
(4.11) |
|
В цьому рівнянні коефіцієнт а залежить від природи розчинника і |
|||||||||||||
температури. В цілому другий член рівняння а |
С xaрактеризує зменшення |
||||||||||||
електричної провідності за рахунок взаємного гальмування іонів. Для |
|||||||||||||
визначення l∞ проводять лінійну екстраполяцію до нульової концентрації. |
|||||||||||||
Відрізок, |
який |
|
відсікається |
на |
осі |
ординат, відповідає значенню l∞. |
|||||||
Одержані |
значення |
порівняють |
з вирахуваними |
за |
рівнянням(4.8), |
яке |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
26 |

справедливе для розведених розчинів сильних електролітів. Відношення електричної провідності за даної концентрації до електричної провідності
при нескінченному розведенні для сильних |
електролітів називається |
||||
коефіцієнтом електричної провідності |
|
lj |
|
|
|
fl |
= |
. |
(4.12) |
||
|
|||||
|
|
l¥ |
|
||
Цей коефіцієнт може приймати значення менше одиниці не в результаті неповної дисоціації, а за рахунок міжіонної взаємодії.
Методика виміру електричної провідності
Схему приладу для визначення опору провідника наведено на .4рис.3. Вона принципово не відрізняється від схеми моста для вимірювання опору провідників першого роду. Перша відмінність схеми полягає в тому, що для живлення моста тут застосовується не постійний, а змінний струм. Це є необхідним для того, щоб уникнути електролізу розчину і поляризації електродів. Суть цього явища: в результаті проходження постійного струму
через розчин електроліту, наприклад, у розчині СНСООН3 |
, на електродах |
||||||||
відбуватимуться такі процеси: |
|
|
|
|
|
|
|
|
|
на катоді 2Н++ 2е→2Н→Н2 |
|
|
|
|
|
|
|||
на аноді 4ОН–– 4е→О2+2Н2О |
|
|
при |
вимірах |
|||||
|
Таким |
чином, |
|||||||
|
опору |
електроліту |
буде |
||||||
|
додаватися опір на електродах |
||||||||
|
в |
результаті |
газовиділення. |
||||||
|
Джерелом змінного струму, як |
||||||||
|
правило, |
|
є |
генератори |
|||||
|
звукової |
частоти. Задовільні |
|||||||
|
результати |
|
одержують |
при |
|||||
|
вимірюванні |
з |
використанням |
||||||
|
струму |
промислової |
|
частоти |
|||||
|
(50 |
Гц). |
Так, на схемі (рис. |
||||||
|
4.3) |
струм |
|
|
від |
|
джерела |
||
Рис. 4.3. Схема для вимірювання |
надходить в |
|
точку А, |
де він |
|||||
розгалужується до точок О і К, |
|||||||||
електричної провідності розчинів |
|||||||||
а потім |
через |
точку |
В |
||||||
|
|||||||||
повертається до джерела. Повзучий контакт К дозволяє, змінюючи співвідношення опорів R1 і R2,
досягти відсутності струму в ланцюгу ОК, що фіксується індикатором (НІ). У якості індикатора може бути використаний осцилограф або гальванометр змінного струму.
Завдання на виконання роботи
27
1.Визначити електричну сталу посудини (електролітична комірка).
2.Встановити залежність питомої електропровідності від концентрації слабких та сильних електролітів.
3.Встановити залежність еквівалентної електропровідності від концентрації
|
слабких та сильних електролітів. |
|
|
|
|
|
||
4. |
Визначити |
ступінь |
дисоціації |
та |
константу |
дисоціації |
залежно |
ві |
|
концентрації слабких електролітів. |
|
|
|
|
|
||
5. |
Визначити коефіцієнт електропровідності сильних електролітів. |
|
|
|||||
Установки, прилади, лабораторний посуд, реактиви
Реохордний міст Р-38, посудина для вимірів, електричні провідники І роду, 0,02 н розчин КСl, розчини електролітів, піпетки на 20 або 25 мл.
Лабораторна робота № 4.1 ВИЗНАЧЕННЯ ЕЛЕКТРОПРОВІДНОСТІ РОЗЧИНІВ СЛАБКИХ
ЕЛЕКТРОЛІТІВ
Порядок виконання роботи
1. Визначення сталої посудини проводять за допомогою0,02 н розчину КСl, питомий опір якого відомий. В посудину, попередньо промиту цим же розчином наливають його стільки, щоб рівень рідини на3–5 мл перевищував верхній край електродів. Визначають Rx з використанням моста-38Р і підставляють в рівняння
|
|
Const = cKCL × Rx |
|
(4.13) |
||
Значення cKCl беруть з табл.1 при відповідній температурі. |
Таблиця 1 |
|||||
|
|
|
|
|
||
См/ см |
0,002243 |
0,002397 |
0,002501 |
0,002606 |
0,002765 |
|
С |
15 |
18 |
20 |
22 |
25 |
|
2.Вимірюють опори розчинів електроліту різної концентрації. Для цього
впосудину, яку попередньо промили цим же розчином, заливають розчин
елекроліту того ж об’єму, що і при визначенні сталої посудини, а потім методом послідовного розведення одержують розчини1:1; 1:2; 1:4; 1:8; 1:16. Після кожного розведення розчини перемішують. При всіх вимірах об’єм рідини в посудині повинен бути одним і тим же. (Зауваження: в процесі роботи з мостом Р-38 необхідно слідкувати за надійністю контактів та відсутністю короткого замикання в ланцюгу електродів).
Опрацювання результатів
1. Розраховують питому електропровідність розчинів слабких електролітів
28

c = |
const |
(4.14) |
|
R x |
|||
|
|
2.За формулами (4.4), (4.8), (4.9), (4.10) розраховують lj , l¥ , a і КД для досліджуваних концентрацій. Для розрахунків l¥ значення lк і la беруть із довідкових таблиць.
3.Одержані дані заносять до табл.2.
Таблиця 2
№ |
С |
j=1/С |
Rx |
c = |
const |
|
λj |
= χ ×j ×1000 |
a=lj/l∞ |
К Д |
== |
a 2 × С |
. |
|
|||||||||||||
п/п |
R x |
|
|
|
|
(1 -a ) |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4.Знаходять середнє значення константи дисоціації і порівнюють його з табличним.
5.Будують графіки залежностей (c, l , a) = f(C).
Лабораторна робота № 4.2 ВИЗНАЧЕННЯ ЕЛЕКТРОПРОВІДНОСТІ РОЗЧИНІВ СИЛЬНИХ
ЕЛЕКТРОЛІТІВ
Порядок виконання роботи
1.Визначення сталої посудини проводять відповідно до п.1 роботи № 4.1.
2.Вимірюють опори розчинів електроліту різної концентрації відповідно до п.2 роботи № 4.1.
Опрацювання результатів
1.За формулами (4.14) та (4.4) обчислюють питому та еквівалентну електропровідність.
2.Одержані дані заносять до табл. 3.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Таблиця 3 |
|||
№ |
С |
|
R |
x |
|
c |
= |
const |
λj = |
c |
× 1000 |
|
С |
|
f |
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|||||||||||||
п/п |
|
|
|
|
|
|
R x |
|
C |
|
|
|
λ |
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
3. Еквівалентну |
|
електропровідність |
за |
нескінченного |
розведенняl¥ |
||||||||||||
знаходять за |
|
|
|
|
|
|
|
lj |
– |
С , отриману |
пряму |
лінію |
|||||
графіком в координатах |
|||||||||||||||||
екстраполюють на вісь ординат, точка перетину з ординатою дає значення l¥ .
4.Отриману величину l¥ порівнюють із розрахованою за рівнянням (4.8).
5.Розраховують коефіцієнт електропровідності ¦l для всіх концентрацій за формулою (4.12).
Оцінка похибки вимірювань
1. В загальну похибку входить відносна похибка в електропровідності, яка дорівнює:
29
DR |
= |
DR1 |
+ |
DR2 |
, |
(4.15) |
|
R |
R1 |
R2 |
|||||
|
|
|
|
де DR – абсолютна похибка при вимірах плеча моста. Відношення тим більше, чим менше плече. Похибка мінімальна приR1 = R2. Для обчислення похибки при вимірах електропровідності слід брати до уваги похибки при вимірах сталої посудини і розчину електроліту.
Прийнявши DR @ 2мм і R1 = R2 = 250мм , отримаємо:
Dc |
= |
2 × DR |
+ |
2 × DR |
= |
8 |
= 0.032, тобто 3,2 % |
c |
R |
|
25 |
||||
|
|
R |
|
||||
У відповідності з цим, питому електропровідність слід розраховувати з точністю до третьої значущої цифри. Але це в кращому випадку.
2.Похибка роботи самого моста Р-38 складає » 5 % .
3.Похибка при заповненні посудини розчином за допомогою піпетки на 20
мл складає приблизно 0,3/20=0,015; тобто » 1,5 % .
4. Таким чином, загальна похибка може сягати » 10 % .
Аналіз одержаних результатів, висновки
На основі аналізу результатів дослідів та керуючись довідниковими даними, студенти роблять висновок про приналежність досліджуваного електроліту до того чи іншого класу.
Питання для самоперевірки
2.Охарактеризуйте типи провідників.
3.Чим відрізняються сильні електроліти від слабких?
4.Що називають питомою електричною провідністю розчину? Як змінюється її значення з концентрацією в сильних та слабких електролітах? Які фактори зумовлюють цю зміну?
5.Як експериментально вимірюють питому електричну провідність? Одиниця питомої електричної провідності.
6. Що називається еквівалентною електричною провідністю? Як змінюється її значення зі зменшенням концентрації розчинів сильних та слабких електролітів? Чинники, що зумовлюють зміну. Одиниця еквівалентної електричної провідності.
7.Що називають абсолютною швидкістю іону, рухливістю? Сформулюйте закон Кольрауша.
8.Сформулюйте закон розведення Оствальда.
9. |
Який |
зв’язок |
існує |
між |
ступенем |
дисоціації та |
ізотонічним |
коефіцієнтом? |
|
|
|
|
|
|
|
10. |
Охарактеризуйте |
схему |
та |
принцип |
вимірювання |
електричної |
|
провідності. Чому вимір опору розчинів електролітів рекомендують проводити
звикористанням змінного струму?
11.Стала посудини та її вимірювання. Одиниця сталої посудини.
30
Лабораторна робота № 5
ЕЛЕКТРОРУШІЙНІ СИЛИ
Мета |
роботи - навчитися вимірювати |
електрорушійні (ЕРС) |
сили |
||
гальванічних елементів, складених з електродів першого та другого роду та на |
|||||
основі |
отриманих |
експериментальних |
даних |
обчислювати |
електродні |
потенціали досліджуваних електродів. |
|
|
|
||
|
|
Теоретичні відомості |
|
|
|
Електрохімія вивчає закономірності перетворення енергії |
хімічних |
||||
реакцій в |
електричну |
при збереженні загального |
енергетичного |
балансу. |
|
Таке перетворення практично реалізується для електрохімічних систем в формі роботи гальванічних елементів, у яких проходять окисно-відновні реакції.
На межі поділу любих двох фаз тверда–тверда, (наприклад Zn/Сu, Cd/Ag), тверда–рідка, (наприклад Zn/розчин ZnSO4, Cu/розчин CuSO4),
рідка–рідка (розчин ZnSO4, розчин CuSO4), |
кожна з яких окремо є |
електронейтральною, виникає стрибок електричного потенціалу. |
|
Розглянемо систему, яку в електрохімії |
називають"метал в розчині |
своїх іонів" (прикладом є мідна пластинка занурена в розчин сульфату міді). |
|
Через деякий час на межіCu/розчин CuSO4 |
встановлюється рівновага, |
обумовлена рівністю хімічних потенціалів речовини в обох фазах і їй |
|
відповідає рівноважний стрибок потенціалу. |
|
В розглянутому випадку іони міді |
в металі містяться у вузлах |
металевої ґратки, а в водному розчині вони гідратовані. Щоб вилучити іони міді з розчину, необхідно подолати енергію гідратаціїUг, тобто енергію зв’язку його з молекулами води, а для видалення іону з металевої ґратки, необхідно подолати енергію Uв , що дорівнює роботі виходу іона з металу. При зануренні металевої пластинки в розчин своїх іонів напрям переходу іонів визначається співвідношенням Uг і Uв, тобто, якщо Uв³Uг (як
для міді) – іони металу будуть переходити із розчину на межу поділу метал–розчин. Оскільки іони міді несуть позитивні заряди, пластинка набуде позитивного заряду, а розчин – негативного. Відповідні заряди в обох середовищах (позитивні в металі і негативні в розчині) розташовуються поблизу поверхні, утворюючи на поверхні метал– розчин подвійний електричний шар (ПЕШ). При співвідношенні Uв£Uг, метал зарядиться негативно, а розчин – позитивно (рис. 5.1). В цьому випадку подвійний електричний шар утворюється надлишковими електронами на металі та іонами металу в розчині.
31

Рис. 5.1. Схема утворення подвійного електричного шару (ПЕШ)
Різниця |
потенціалів j, |
що |
||
виникає між металом і розчином, |
||||
називається |
|
міжфазовим |
||
потенціалом. Прямих |
методів |
|||
вимірювання абсолютних значень |
||||
міжфазових |
потенціалів |
поки |
що |
|
немає, можна |
виміряти |
лише |
||
різницю потенціалів між точками, |
||||
що знаходяться |
в межах |
однієї |
||
фази. |
|
|
|
|
Гальванічний |
елемент – |
це |
||
пристрій |
для |
|
перетворення |
|
хімічної |
енергії |
будь-якої |
||
окиснювально-відновної |
реакції |
|||
в електричну енергію. |
|
|
||
Розглянемо гальванічний елемент Якобі - Даніеля, схема якого наведена на рис. 5.2.
Рис. 5.2. Схема гальванічного елемента Даніеля-Якобі: 1 – цинковий напівелемент;
2 – цинковий електрод; 3 – розчин ZnSO4; 4, 5 – скляні трубки з зовнішніми
проводами; 6 – розчин CuSO4; 7 – мідний напівелемент; 8 – мідний електрод; 9 – склянка з насиченим розчином KCl (соляний місток)
|
Контакт |
|
|
|
|
між |
|
електродами |
|
здійснюється |
|||||
за допомогою з'єднуючого |
|||||||
провідника |
|
|
(будь-якого |
||||
провідника |
|
першого роду), |
|||||
а |
контакт |
|
між |
|
|
||
електролітами |
|
– |
|
за |
|||
допомогою |
|
|
|
пористої |
|||
перетинки, |
|
|
|
|
що |
||
перешкоджає |
механічному |
||||||
змішуванню |
розчинів |
і |
не |
||||
перешкоджає |
|
переносу |
|||||
струму |
іонами, |
або |
|
за |
|||
допомогою |
|
|
проміжного |
||||
агар-агарового |
|
містка, |
|||||
виготовленого |
на |
розчині |
|||||
хлористого |
|
калію. |
Цей |
||||
кордон |
|
|
|
|
розділяє |
||
гальванічний |
елемент |
на |
|||||
два напівелементи.
32
На одному з них (катоді) йде відновлювальний процес, який супроводжується асиміляцією електронів, наприклад Сu2++2е=Сu, на другому (аноді) – окислювальний, наприклад Zn–2e=Zn2+, що є джерелом електронів.
Часто гальванічні елементи записують схематично, при цьому показують послідовність контактів реагуючих речовин, які перебувають в різних фазах, розділяючи їх вертикальними лініями. Наприклад, запис елемента ДаніеляЯкобі
(–)Cu/Zn/ZnSO4//CuSO4/Cu(+)
Спостерігаємо три міжфазових стрибки електричного потенціалу:
jCu/Zn , jZn / Zn2 + , j Cu 2 + / Cu
які свідчать, що елемент Якобі-Даніеля є нерівноважною електрохімічною системою, в якій виникає різниця потенціалівЕ, що дорівнює сумі міжфазових стрибків потенціалів:
Е = jCu/Zn + jZn/Zn 2 + + jCu 2 + / Cu |
(5.1) |
де Е – електрорушійна сила (ЕРС) гальванічного елемента.
Оскільки чисельні значення міжфазових потенціалів не піддаються експериментальному визначенню, в електрохімічній практиці для розрахунків ЕРС гальванічних елементів широко використовують рівняння, що зв’язує ЕРС з електродними потенціалами e.
Тоді ЕРС дорівнює максимальній різниці електродних потенціалів:
|
|
Е = eCu 2 + / Cu |
- jZn/Zn2 + |
(5.2) |
|
|
За |
визначенням електродний |
потенціал будь-якого |
напівелемента– це |
|
||
ЕРС |
ланцюга, який |
складено |
з |
напівелемента, що |
досліджується |
і |
напівелемента порівняння, електродний потенціал якого постійний. Таким електродом порівняння в електрохімії може бути нормальний водневий електрод (НВЕ), потенціал якого прийнятий рівним нулю.
В гальванічному елементі Якобі-Даніеля відбувається окиснення цинку і
перехід в розчин його іонів:
Ζn – 2е « Ζn2+
і відновлення іонів міді та осадження їх на електроді:
Сu2++2е« Сu
Цинковий електрод в даному елементі буде мати від’ємний заряд, мідний – додатній. Електрони переходять по замкнутому металевому провіднику від цинкового електроду до мідного.
Сумарна реакція в елементі становить:
Ζn+ Сu2+« Ζn2++ Сu
Якщо процес, в гальванічному елементі провести в зворотних умовах (електроліз), за Р=const і T=const, то в елементі виконується максимальна корисна робота, що дорівнює зменшенню ізобарного потенціалу системи:
А’max= –DGT = z·F·E |
(5.3) |
де z – число електронів, що беруть участь в реакції; F – стала Фарадея, 96493 Кл / моль; E – ЕРС гальванічного елемента.
Для цієї реакції запишемо рівняння ізотерми:
33
DG = -R ×T × ln K c |
+ R ×T × ln |
aZn 2+ × aCu |
|
(5.4) |
||||||||||||||||
aCu 2+ × aZn |
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
де активності нейтральних атомів цинку та міді дорівнюють: aZn=аCu=1. |
|
|||||||||||||||||||
Виходячи із рівняння (5.3) |
|
|
|
|
|
|
|
|
|
|
аZn2+ |
|
|
|
||||||
- z × F × E = -R ×T ×lnKC + R ×T ×ln |
|
(5.5) |
||||||||||||||||||
aCu 2+ |
||||||||||||||||||||
звідки, |
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
aCu 2 + |
|
|
|
|
||||||||
Е = |
R ×T |
lnKC |
+ |
R ×T |
ln |
. |
(5.6) |
|||||||||||||
|
|
|
|
|
|
|||||||||||||||
|
z × F |
|
|
|
z × F |
|
|
|
|
аZn2+ |
|
|||||||||
Якщо активності всіх речовин реакції дорівнюють одиниці, то ЕРС (Е) |
||||||||||||||||||||
приймає значення стандартної ЕРС (Ео) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
Е о = |
R ×T |
lnK |
C , |
(5.7) |
|||||||||||||||
|
|
|
||||||||||||||||||
|
|
|
z × F |
|
|
|
|
|
|
|
|
|
|
|
||||||
де Ео– стандартна ЕРС. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Таким чином, рівняння (5.6) можна записати в загальному вигляді: |
|
|||||||||||||||||||
|
Е = Е о + |
R ×T |
ln |
aокис |
. |
(5.8) |
||||||||||||||
|
|
|
||||||||||||||||||
|
|
|
|
|
z × F |
|
|
авідн |
|
|||||||||||
По аналогії для електродного потенціалу одержимо:
e = e о + |
R ×T |
ln а |
|
Zn + , |
(5.9) |
|
ме |
||||
|
z × F |
|
|
||
де e о – нормальний електродний потенціал, що дорівнює |
потенціалу |
||||
рівноважного оберненого електрода, зануреного в розчин, в якому активність потенціалвизначальних іонів а, дорівнює одиниці. Співвідношення (5.8) і (5.9) мають назву рівняння Нернста–Тюріна.
Стандартну ЕРС можна визначити як різницю електродних потенціалів:
Е о = eкo -eao |
(5.10) |
Нормальні електродні потенціали різних металів виміряні відносно нормального водневого електрода і зведені в таблицю. Якщо розмістити метали в порядку зростання їх нормальних(стандартних) електродних потенціалів, отримаємо так званий ряд напруги.
Всі метали, розміщені в ряду напруг до водню, мають негативний нормальний електродний потенціал, тобто на таких електродах при роботі відповідного гальванічного елемента відбувається процес окиснення металу. Позитивний нормальний електродний потенціал, який мають метали, що стоять за воднем, означає, що відносно нормального водневого електроду даний електрод заряджується позитивно, тобто при роботі елемента відбувається процес відновлення металу.
Електроди першого роду – це металеві або газові електроди, занурені в розчин своїх іонів і обернені відносно цих іонів (аніонів і катіонів), від активності яких залежить потенціал електроду. Прикладом електродів першого роду можуть бути міднийCu/Сu2+ , цинковий Zn/Zn2+, водневий
Pt(H2)H+, хлорний Pt(Cl2)Cl– тощо.
34

Рис. 5.3. Нормальний водневий електрод: 1 – посудина; 2 – платиновий електрод; 3 – скляна трубка; 4, 8 – крани; 5 – трубка введення водню; 6 – гідрозатвор; 7
– сифон
Оскільки вимірювання з водневим тиску 1 атм
Нормальний водне електрод (рис. 5.3) складається із платини, покритої платиново чернотою і частково зануреної розчин, в якому активність іонів водню дорівнює одиниці, а тиск водню в газовій фазі – 101325 Па.
Потенціал |
|
такого |
|
електрода при |
||||||||||
t=25 °С умовно прийнято за нуль. |
||||||||||||||
|
|
|
Електродна |
|
реакція, |
що |
||||||||
проходить на платині: |
|
|
||||||||||||
|
|
|
|
|
|
|
|
1/2Н2«Н++е |
водне |
|||||
|
|
|
Потенціал |
|
|
|
||||||||
електрода |
|
в |
|
загальному |
випад |
|||||||||
визначається рівнянням: |
|
|
||||||||||||
e |
|
+ |
|
= e о + |
|
+ |
R ×T |
ln |
aH + |
, |
|
|||
Н |
/ Н |
/ Н |
|
|
|
|||||||||
|
|
|
Н |
|
|
F P1 / 2 |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
H 2 |
|
|
(5.11) |
|
|
|
|
|
|
|
|
|
|
|
|||
де |
|
eо |
+ |
– |
нормальний |
потенціал, |
||||||||
|
|
|
Н |
|
/ Н |
|
|
|
|
|
|
|
|
|
прийнятий рівним нулю; |
|
|||||||||||||
PH2 |
–рівноважний |
тиск |
водню н |
|||||||||||
платиною. |
|
|
|
|
|
|
|
|
|
|||||
електродом проводять приблизно при
|
|
eН + / Н = |
R ×T |
ln aH + , |
|
(5.12) |
|
|
F |
|
|||
|
|
|
|
|
|
|
Незручності |
при |
користуванні |
водневим |
електродом |
обумовлен |
|
необхідністю мати очищений водень, який безперервно пропускають через |
||||||
розчин. Потенціал |
водневого електрода нестійкий і встановлюється повільно, |
|||||
тому на практиці у якості електрода порівняння використовують, як правило, електроди другого роду.
Електроди другого роду – це метали, вкриті шаром малорозчинної солі металу і занурені в розчин добре розчинної солі, яка має спільний аніон з малорозчинною сіллю. Ці електроди можна розглядати як зворотні відносно аніону, тому їх потенціал можна розрахувати через активність аніонів. Прикладом електродів другого роду є каломельний, хлоросрібний тощо.
35

|
Каломельний електрод (рис. |
|||||||
|
5.4) складається з ртуті, пасти, |
|||||||
|
виготовленої |
|
|
|
з |
каломелі, |
||
|
платинового |
|
дроту, |
мідного |
||||
|
дроту-виводу, пробки і сифону. |
|||||||
|
Електрод заливають |
розчином |
||||||
|
КСl, |
залежно |
|
від |
концентрації |
|||
|
якого |
розрізняють |
0,1 |
н, |
||||
|
нормальний |
(1,0 |
|
н |
КСl) |
і |
||
|
насичений |
|
|
|
каломельні |
|||
|
електроди. |
|
|
|
|
|
|
|
|
В |
каломельному |
електроді |
|||||
Рис. 5.4. Каломельний |
проходить реакція |
|
|
|
||||
|
Hg – e « Hg+. |
|
||||||
електрод: 1 – ртуть: 2 – |
Електродний потенціал |
|
||||||
платиновий дріт; 3 – каломель; |
|
|||||||
дорівнює: |
|
|
|
|
|
|
||
4 – сифон; 5 – розчин KCl |
|
R ×T |
|
|
|
|
||
eкал = eкало - |
|
ln аСl - |
(5.13) |
|||||
|
|
|||||||
|
|
|
||||||
|
|
|
|
F |
|
|
|
|
Окисно-відновні електроди (Red-Oxy) – це електроди, матеріал яких не бере участі в електродній реакції, а тільки в передачі електронів від окисника до відновника, що перебувають в одному розчині. Прикладом такого електрода
може бути платина, занурена |
в розчин, що містить Fe2+ і Fe3+ або Sn2+ і Sn4+. |
||||||||||||
Відмінність окисно-відновних електродів від інших полягає |
в , томущо |
||||||||||||
продукти окиснення або відновлення залишаються в розчині, а не виділяються |
|||||||||||||
на електродах. |
|
|
|
|
|
|
|
|
|
|
|
|
|
Електродний потенціал такого електрода, наприклад Pt/Sn4+/Sn2+ |
|||||||||||||
|
e Sn 4 + / Sn 2 + = e Snо |
4 + / Sn |
2 + + |
R ×T |
ln |
aSn 4 + |
|
, |
|
(5.14) |
|||
|
2 × F |
aSn 2 + |
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|||
Серед Red-Oxy-електродів |
широко |
застосовується |
хінгідронний |
||||||||||
електрод, що використовується для визначення концентрації водневих іонів в |
|||||||||||||
розчині. Це |
платиновий |
електрод, |
занурений |
|
в |
розчин |
хінгідрону |
||||||
(С6Н4)2O2(OН)2, |
що розпадається |
|
у |
водному |
|
розчині на |
еквівалентні |
||||||
кількості хінону С6Н4O2 і гідрохінону С6Н4(OН)2. Останній є двохосновною |
|||||||||||||
кислотою, дисоціює з утворенням аніона6НС4O2 |
–, |
|
який при |
окисненні |
|||||||||
переходить в хінон. Сумарно реакцію можна виразити рівнянням: |
|
||||||||||||
|
С6Н4(OН)2 « С6Н4O2+2Н++2е |
|
|
||||||||||
Потенціал хінгідронного електрода: |
|
|
|
|
|
|
|
|
|
||||
|
εxr = εxrо |
+ 0,059 ×lg aH + , |
|
(5.15) |
||
тобто потенціал хінгідронного електрода визначається концентрацією |
||||||
іонів водню або рН розчину ( pH = - lg aH + |
). |
|
|
|
||
Вимірювання |
електродних |
|
потенціалів |
окремих |
електро |
|
(напівелементів) проводиться |
лише |
у |
формі |
гальванічних |
елементів, |
|
|
|
|
|
|
|
36 |
складених із напівелемента, електродний потенціал якого підлягає визначенню і стандартного електрода порівняння каломельного, електродний потенціал якого відносно нормального водневого електрода відомий. eокал=+0,2483 В.
Наприклад, для визначення потенціалів мідного і цинкового електродів в елементі Якобі-Даніеля за допомогою каломельного електрода порівняння складають два ланцюги:
(–)Hg/Hg2Cl2/KClнас//CuSO4/Cu(+)
(–)Zn/ZnSO4//KClнас/Hg2Cl2/Hg(+)
і визначають їх ЕРС.
У першому колі каломельний електрод грає роль негативного електрода, в другому – позитивного. Знаки електродів визначають, користуючись таблицею стандартних електродних потенціалів і порівнюють їх з потенціалом електрода
порівняння. У вказаних елементах проходять такі електрохімічні реакції:
2Cl–+2Hg–2е→ Hg2Cl2 ; Cu2++2е→ Cu
Zn–2е→Zn2+ ; Hg2Cl2+2е→2Hg+2Cl–
Значення потенціалів визначають на підставі таких міркувань, знаючи ЕРС гальванічного елемента:
ЕCu-кал=eСu – eкал, |
(5.16) |
потенціал катоду дорівнює: |
|
eСu=ЕCu-кал + eкал |
(5.17) |
Маючи виміряну ЕРС гальванічного елемента: |
|
ЕZn-кал=eкал – eZn, |
(5.18) |
потенціал аноду дорівнює: |
|
eZn=eкал – ЕZn-кал. |
(5.19) |
Отримані значення електродних потенціалів порівнюють з розрахованими за рівнянням Нернста-Тюріна.
Завдання на виконання роботи
1. Виміряти ЕРС гальванічних елементів, складених із електродів першого та другого роду.
2. Використовуючи одержані результати, розрахувати окремі електродні потенціали.
Прилади, лабораторний посуд та реактиви
Мультиметр, електроди першого роду, стандартний каломельний електрод, насичений розчин КСl, електричні провідники.
Порядок виконання роботи
37
1. |
Складають гальванічний ланцюг, використовуючи два напівелементи з |
|
||||||
електродів першого роду, на прикладі елементу Даніеля-Якобі, підключають |
|
|||||||
його до мультиметра і вимірюють ЕРС. |
|
|
|
|
|
|||
2. |
Записують |
електрохімічну |
|
схему |
досліджуваного |
гальванічного |
||
елемента та рівняння окисно-відновної реакції, що проходить під час роботи |
|
|||||||
даного гальванічного елемента. |
|
|
|
|
|
|
||
3. |
Складають |
гальванічні |
|
ланцюги, використовуючи |
один |
із |
||
досліджуваних |
напівелементів |
та |
електрод |
порівняння(каломельний), |
|
|||
підключають їх до мультиметра і вимірюють їх ЕРС. |
|
|
|
|||||
4. |
Записують |
електрохімічну |
схему |
|
досліджуваних |
гальванічних |
||
елементів та рівняння окисно-відновних реакцій, що проходить під час роботи |
|
|||||||
даного гальванічного елемента. |
|
|
|
|
|
|
||
5.Використовуючи рівняння (5.16) – (5.19) розраховують електродні потенціали досліджуваних напівелементів.
6.Розраховують ЕРС досліджуваного елемента, використовуючи розраховані значення електродних потенціалів.
7.Оцінюють похибку експерименту, порівнюючи виміряне значення ЕРС гальванічного елементу (п.1) та розраховане значення ЕРС (п.6).
Питання для самоперевірки
1.Причини виникнення ЕРС у гальванічних елементах.
2.Від яких факторів залежить значення електродного потенціалу? Що таке нормальний електродний потенціал?
3.Що таке ряд напруг?
4.Які рівняння передають взаємозв’язок ЕРС гальванічного елемента з максимальною роботою та ізобарним потенціалом?
5.Як класифікують електроди? Дайте визначення електроду першого роду, електроду другого роду та окисно-відновного електроду.
6.Які електроди використовують в якості електродів порівняння?
7.Наведіть реакції на електродах залежно від потенціалу електрода, що працює в парі.
8.Як вимірюють експериментально значення електродних потенціалів?
9. Навести рівняння Нернста-Тюріна для розрахунку електродних потенціалів та ЕРС гальванічних елементів.
Лабораторна робота №6 ХІМІЧНА КІНЕТИКА
Мета роботи – ознайомитися з методами вивчення кінетики гомогенних та гетерогенних реакцій, навчитися експериментальним шляхом визначати константу швидкості реакції.
Теоретичні відомості
38
Хімічна кінетика вивчає швидкість проходження хімічних реакцій та залежність її від різноманітних чинників– концентрації реагуючих речовин, температури, впливу каталізаторів тощо.
Прості |
речовини |
та хімічні сполуки, що вступають до реакції, |
називаються |
вихідними |
речовинами. Кінцеві речовини, які утворюються в |
реакції і не зазнають змін в ході перебігу подальших хімічних перетворень, називаються продуктами реакції. Речовини, що виникають в одних і зникають в інших стадіях хімічного процесу, називаються проміжними, а реакції утворення та розкладу цих речовин – проміжними.
Розрізняють два типи реакцій: гомогенні та гетерогенні. Гомогенними називають такі реакції, при яких всі вихідні речовини і продукти реакції перебувають в одній і тій самій фазі, наприклад, в газовій, або в розчині. Гетерогенними називають такі реакції, при яких процес відбувається на межі розділу двох фаз, і речовини, що беруть участь у реакції (в тому числі і каталізатор), перебувають у різних фазах.
Швидкістю хімічної реакції називають зміну концентрації будь-якої з речовин, що беруть участь у реакції за одиницю часу і в одиниці певного об’єму.
Швидкість реакції знаходять, як правило, |
за |
концентрацією |
вихідних |
||
речовин. Позначивши через υ швидкість реакції, що проходить за постійної |
|||||
температури, dС – зміну концентрації |
однієї |
з вихідних |
речовин за |
||
нескінченно малий час реакції dτ, одержуємо: |
|
|
|
||
u = - |
dC |
|
|
|
(6.1) |
dt |
|
|
|||
|
|
|
|
||
Знак "–" у рівнянні (6.1) береться тому, що позитивному приросту часу відповідає негативна зміна концентрації; а за фізичним змістом швидкість реакції завжди позитивна.
В основі хімічної кінетики одностадійних реакцій лежить закон дії мас, згідно з яким швидкість хімічної реакції пропорційна добутку концентрацій реагуючих речовин. Причому кожна з концентрацій береться в степені, що дорівнює стехіометричному коефіцієнту (п1, п2, п3,...), який стоїть перед формулою даної сполуки в рівнянні реакції.
На підставі цього закону можна записати:
- |
dC |
= K ×C1n1 ×C2n2 ×C3n3 |
(6.2) |
|
|||
|
dt |
|
|
Коефіцієнт пропорційності К для даної реакції при сталій температурі є |
|||
величиною постійною і називаєтьсяконстантою швидкості реакції. На
відміну |
від |
швидкості υ |
константа |
швидкості |
реакції К не |
залежить від |
||
концентрації |
для |
даної |
реакції |
при |
даній |
температурі. З |
рівняння (6.2) |
|
випливає |
фізична |
суть |
константи |
швидкості: вона чисельно дорівнює |
||||
швидкості реакції за умови, що концентрація кожної з вихідних речовин дорівнює одиниці C1=C2 =С3 =1
Кінетично хімічні реакції розрізняють |
за ознакою молекулярності або |
||
порядку реакції. |
|
|
|
Молекулярність реакції |
визначається |
числом |
молекул, одночасною |
взаємодією яких здійснюється |
елементарний акт |
хімічного перетворення. |
|
|
|
|
39 |
Розрізняють реакції мономолекулярні, бімолекулярні, тримолекулярні. (Останні трапляються надзвичайно рідко).
Молекулярність реакції не відбиває наявності проміжних стадій. Швидкість складної реакції визначається швидкістю найповільнішої стадії,
тобто кінетично складна реакція описується закономірностями цієї стадії. У |
|
|||||||
зв’язку з цим складні реакції зручніше характеризувати не молекулярністю, а |
|
|||||||
порядком. Порядок реакції дорівнює сумі показників степенів концентрацій у |
|
|||||||
рівнянні, яке |
описує |
залежність |
швидкості |
реакції |
від концентрації |
|||
реагуючих речовин. |
|
|
|
|
|
|
|
|
Для |
реакцій |
першого |
порядку |
кінетичне |
рівняння |
вклю |
||
концентрацію однієї речовини: |
|
|
|
|
||||
|
|
|
dC |
= -K ×C , |
|
(6.3) |
|
|
|
|
|
|
|
|
|||
|
|
|
dt |
|
|
|
|
|
Поділяючи змінні та інтегруючи рівняння (6.3), одержуємо:
|
dC |
= - K × d t ; lnC= -K ×τ +const |
(6.4) |
||||
|
|
||||||
|
С |
|
|
|
|||
Сталу інтегрування визначають, беручи до уваги, що при τ=0 і С=Со |
|||||||
(Со– початкова концентрація), lnСо=const. Підставляючи |
це значення у |
||||||
рівняння (6.4), одержуємо кінетичне рівняння реакції першого порядку: |
|||||||
1 |
|
Co |
(6.5) |
||||
|
|
K = |
|
ln |
|
||
|
|
t |
C |
|
|||
Якщо початкову концентрацію позначитиа (тобто Cо), а кількість речовини, яка зазнала змін за час τ, через х (тобто C = а – x),одержуємо:
K = |
1 |
ln |
a |
(6.6) |
|
|
ta - x
Одна з |
важливих кінетичних |
характеристик– період піврозпаду τ1/2 – |
||||
час, за який |
прореагує |
половина початкової кількості речовини, тобто |
||||
момент, коли х=а/2. |
|
|
|
|
|
|
Підставивши це |
значення |
|
у рівняння(6.6), одержуємо |
період |
||
піврозпаду для реакції першого порядку: |
|
|||||
|
|
τ1 / 2 |
= |
ln 2 |
. |
(6.7) |
|
|
|
||||
K
Отже, період піврозпаду для реакцій першого порядку не залежить від початкової концентрації.
Якщо один з компонентів міститься у великому надлишку, тобто його концентрація практично не змінюється з часом, то такі бімолекулярні реакції протікають за законами реакцій першого порядку. Класичним прикладом такої реакції є реакція гідролізу(інверсії) сахарози у водному розчині. Такі реакції називаються псевдомономолекулярними.
Порядок реакції встановлюється експериментально. Один з простих методів полягає в тому, що дослідні дані зміни концентрації з часом підставляють в кінетичне рівняння першого або другого порядків. Порядок реакції визначають за рівнянням, яке найкраще задовольняє умову сталості константи швидкості. Якщо період піврозпаду не залежить від початкової
40
концентрації, то реакція першого порядку; якщо він обернено пропорційний початковій концентрації –реакція другого порядку.
При підвищенні температури швидкість хімічних реакцій зростає. Для більшості реакцій в діапазоні невисоких температур справджується приблизне правило Вант-Гоффа, згідно з яким при підвищенні температури на 10 °С константа швидкості реакції збільшується в2–4 рази. Математично це можна записати так:
|
|
K t +10 |
= 2...4 , |
|
(6.8) |
||||
|
|
|
K t |
|
|||||
|
|
|
|
|
|
|
|
||
Більш точну залежність константи швидкості реакції від температуриТ |
|||||||||
встановлює рівняння Арреніуса: |
|
|
|
|
|
||||
|
|
|
d ln K |
= |
E |
, |
(6.9) |
||
|
|
|
|
|
R ×T 2 |
||||
|
|
|
dT |
|
|
|
|
||
де Е – енергія активації; R – універсальна газова стала. |
|
||||||||
Після інтегрування рівняння (6.9) набуває вигляду: |
|
||||||||
ln K = - |
E |
|
+ const , |
|
(6.10) |
||||
R ×T |
|
||||||||
|
|
|
|
|
|
|
|||
або представивши в експоненційній формі, отримаємо:
K = K o |
× e - E / R ×T , |
(6.11) |
де Ko – емпірична константа, яка називається передекспоненційним |
||
множником. |
поняття"енергія |
активації". Умовою |
Розглянемо фізичний зміст |
||
протікання реакції є ефективне зіткнення молекул, число яких становить малу частку від загального числа зіткнень. Ефективними є зіткнення між активними молекулами, які мають підвищений запас енергії. Енергія активації – це мінімальна енергія, яку повинні мати реагуючі часточки, щоб зіткнення між ними призвело до реакції. Молекули, енергія яких більше або
дорівнює |
Е, |
називаються |
активними. |
Активацію |
можна |
здійснити, |
підводячи |
до |
системи |
енергію за |
рахунок |
нагрівання |
,системиабо |
опромінення. Енергію активації визначають із рівняння(6.11), визначивши експериментально константу швидкості реакції за двох температур.
Каталізаторами називають речовини, які, як правило, прискорюють хімічну реакцію, беруть участь в тій чи іншій стадії реакції, але в результаті реакції залишаються незмінними хімічно.
Збільшення швидкості реакції під дією каталізатора можна пояснити тим, що каталізатор знижує енергію активації реакції, збільшуючи тим самим
частину активних молекул. Одночасно каталізатор збільшує |
ентропію |
активації. |
|
За агрегатним станом каталізатора і речовин, які беруть |
участь у |
реакції, каталіз поділяють на гомогенний і гетерогенний. |
|
У випадку гетерогенного каталізу хімічна реакція проходить на межі розділу фаз, каталізатор – реагуючі речовини.
При гомогенному каталізі каталізатори перебувають в одній фазі з реагуючими речовинами. Найпоширеніші гомогенні каталізатори – кислоти,
41
основи, іони перехідних металів та їх комплекси і біологічні каталізатори (ферменти або ензими).
Каталітичним реакціям притаманні такі особливості:
–у процесі реакції кількість каталізатора залишається незмінною;
–каталізатор не змінює хімічних властивостей, але може змінюватись фізично – старіти, "отруюватись";
–мізерно мала кількість каталізатора порівняно з кількістю реагуючої речовини значно змінює швидкість реакції;
–як правило, дія каталізатора специфічна, але існують каталізатори, які прискорюють багато реакцій, наприклад, іони Н+ у гомогенному каталізі;
–у оберненій реакції каталізатор не зміщує рівноваги, однаковою мірою прискорюючи пряму та зворотну реакції.
На реакції, які термодинамічно неможливі, каталізатор не впливає. Одним з найпоширеніших видів каталізу є кислотно-основний. Типовий
приклад кислотного гомогенного каталізу– реакція гідролізу сахарози в присутності кислоти. Згідно з теорією протолітичної рівноваги, кислота в
процесі |
реакції |
віддає |
протон(донор |
протонів). |
Іонізація |
кислот |
відбувається внаслідок їх протолітичної реакції з розчинником, в результаті |
||||||
чого з’являється |
іон гідроксонія3О+Н – |
каталітично |
діюче |
начало у |
||
кислотному каталізі. Наприклад, для HCl у воді НСІ+Н2О=Cl–+H3O+. |
||||||
При кислотному каталізі першою стадією є протонізація вихідної речовини за рахунок передачі протона від каталізатора(кислоти). Друга
стадія – саме хімічне перетворення з утворенням |
продуктів реакції і |
||
відщепленням |
протона. |
При цьому каталізатор(кислота) |
відновлюється. |
Лімітуючою |
стадією |
сумарної двохстадійної реакції |
буде найповільніша |
стадія. При кислотному каталізі реакції гідролізу сахарози лімітуючою виявляється друга стадія.
Н+ С12Н22О11+Н3О+« С12Н22О11Н++Н2О (І стадія)
сахароза
Н+ С12Н22О11Н++2Н2О« С6Н12О6+ С6Н12О6+ Н3О+ (ІІ стадія)
фруктоза глюкоза
Друга стадія проходить за рівнянням кінетики реакції першого порядку, бо вода знаходиться у великому надлишку і в ході реакції її концентрацію можна вважати незмінною.
У спрощеному вигляді:
Н+
C12 H 22 O11 + H 2O ® C6 H12O6 + C6 H12 O6
42
Ця реакція є бімолекулярною і проходить у вказаному напрямку практично до кінця. Кінетичне рівняння для неї повинно мати вигляд:
- |
dc |
= Kcсах с |
Н |
|
(6.12) |
|
|
||||
|
dτ |
|
2 |
О |
|
|
|
|
|
||
але у розведеному розчині кількістю води, яка витрачається на гідроліз, можна знехтувати і вважати, що концентрація її залишається сталою. Тоді можна записати:
- |
dc |
¢ |
(6.13) |
|
|||
dt |
= K cсах |
||
|
|
|
Отже, каталітична реакція гідролізу сахарози є реакцією першого порядку. Константа швидкості реакції першого порядку вираховується по рівнянню:
K = |
|
1 |
ln |
c 0 |
(6.14) |
|
t |
ct |
|||||
|
|
|
||||
де t – час від початку досліду, c; c0 – початкова концентрація сахарози; ct – концентрація розчину сахарози до часу t .
У гетерогенному процесі взаємодія відбувається на поверхні поділу |
|
||||||
фаз або в безпосередній близькості від неї. У системах з двох або більше |
|
||||||
компонентів взаємодія на поверхні розділу фаз призводить до виникнення |
|
||||||
різниці у складах поверхневого і внутрішнього шарів даної фази, отжеі, |
|
||||||
процесу вирівнювання складів цих шарів. Якщо процес не прискорюється |
|
||||||
перемішуванням, а відбувається лише внаслідок дифузії, швидкість всього |
|
||||||
процесу, |
як правило, |
визначається |
швидкістю |
вирівнювання |
складів |
|
|
(швидкість найповільнішої стадії). На поверхні поділу фаз рівновага |
|
||||||
досягається значно скоріше. Прикладом гетерогенного процесу може бути |
|
||||||
процес розчинення бензойної кислоти у воді. |
|
|
|
|
|||
У |
більшості |
гетерогенних |
процесів |
спільна |
швидкість |
дуже |
|
збільшується при перемішуванні. Але вплив дифузії в цьому випадку не |
|
||||||
зникає, бо при перемішуванні вирівнюється концентрація |
в більшій |
||||||
частині об’єму, але біля самої поверхні поділу завжди |
залишається |
||||||
невеликий дифузійний шар, який не перемішується, і вирівнювання |
|
||||||
концентрації здійснюється через нього за допомогою дифузії. Чим |
|
||||||
інтенсивніше перемішування, тим тонший дифузійний шap, тим менша |
|
||||||
роль дифузії у зменшенні швидкості процесу в цілому. В деяких випадках |
|
||||||
це може привести до того, що швидкість вирівнювання складів може стати |
|
||||||
більшою за швидкість взаємодії на самій поверхні, тоді |
загальна |
|
|||||
швидкість всього процесу буде визначатися швидкістю цієї взаємодії як |
|
||||||
найповільнішої стадії сумарного процесу. |
|
|
|
|
|||
Необхідно відзначити також вплив поверхні поділу фаз та її стану на |
|
||||||
швидкість реакції. Швидкість зростає при збільшенні площі |
поверхні |
||||||
поділу фаз при проведенні процесу за умов, коли ця поверхня безперервно |
|
||||||
оновлюється. |
|
|
|
|
|
|
|
|
|
|
|
|
|
43 |
|
Вимірювання швидкості реакції базується на визначенні концентрації |
|
||||
реагуючих |
речовин. |
Концентрації |
визначають |
поляриметричним |
та |
рефрактометричним методами, вимірюванням електричної провідності, |
|
||||
титруванням тощо. |
|
|
|
|
|
Класичний приклад гетерогенної реакції– це розчинення твердої |
|
||||
речовини |
в рідкому |
розчиннику. Кінетика таких |
гетерогенних реакцій |
||
найкраще вивчена. В цьому випадку процес розчинення складається з двох
стадій: самого розчинення і відведення розчиненої |
речовини в об’єм |
||||||
розчину за допомогою дифузії . Обидві стадії мають різні швидкості і |
|||||||
кінетика розчинення залежить від співвідношення |
цих швидкостей. У |
||||||
багатьох випадках швидкість розчинення твердих тіл визначається швидкістю |
|||||||
дифузійних процесів як найповільніших. |
|
||||||
Згідно з рівнянням Фіка, швидкість дифузії |
dn |
, моль/с: |
|||||
|
|||||||
|
dn |
|
D |
|
dt |
|
|
|
= |
× S × (Co - C), |
(6.15) |
||||
|
|
|
|||||
|
dt d |
|
|||||
де D – коефіцієнт дифузії; d – товщина шару концентрованого розчину, крізь який йде дифузія; S – площа поверхні тіла, що розчиняється; Со – концентрація насиченого розчину в шарі; С – концентрація в об’ємі розчину.
Шар насиченого розчину товщиноюd при перемішуванні прилипає до твердої поверхні, але при збільшенні швидкості перемішування товщина шару d зменшується і збільшується швидкість дифузії речовини з прилеглого шару товщиною d в об’єм розчину. Оскільки швидкість дифузії визначає швидкість всього процесу, швидкість розчинення зростає при збільшенні інтенсивності перемішування.
Лабораторна робота № 6.1 ВИЗНАЧЕННЯ КОНСТАНТИ ШВИДКОСТІ РЕАКЦІЇ
ГІДРОЛІЗУ САХАРОЗИ
Завдання на виконання роботи
1. |
Дослідити кінетику реакції гідролізу сахарози(зробити 6 замірів |
||||||
кута обертання через такі проміжки часу5, |
10, 15, 20, 30 та 50 |
хв |
від |
||||
початку досліду). |
|
|
|
|
|
|
|
2. |
Визначити |
середнє |
значення |
константи |
швидкості |
реакції |
|
гідролізу сахарози. |
|
|
|
|
|
|
|
3. |
Визначити |
константу |
швидкості |
гідролізу |
сахарози |
графічним |
|
методом. |
|
|
|
|
|
|
|
Прилади, лабораторний посуд та реактиви
44
Поляриметр універсальний, електроплитка, поляриметрична трубка, технічні ваги, склянка об’ємом 50 мл, скляна паличка, мірний циліндр, термометр, 2н розчин соляної кислоти, годинникове скло.
Порядок виконання роботи
1.Приготувати у склянці об’ємом50 мл 20 г розчину сахарози заданої концентрації.
2.До 20 мл розчину сахарози додати20 мл 2 н розчину соляної кислоти. Попередньо ополіскуючи поляриметричну трубку приготовленим
розчином сахарози з додаванням соляної кислоти(залишок розчину лишають у склянці), виміряти початковий кут обертання(α0) площини поляризації поляризованого світла, що відповідає часу τo та найбільшій концентрації сахарози. Перед наповненням чисту поляриметричну трубку обполіскують приготованою сумішшю. Заповнюючи трубку, необхідно стежити за тим, щоб в неї не потрапило повітря. Тримаючи трубку трохи похило, заповнюють її по вінця, щоб рідина утворила опуклий меніск, потім обережно збоку насувають покривне скельце і нагвинчують кільце, яке притискає скло до торця трубки. Наповнену трубку кладуть у жолобок поляриметра в крайнє положення, найближче до окуляра.
3.Зробити 6 вимірів кута обертання (ατ) через такі проміжки часу 5, 10, 15, 20, 30 та 50 хв після вимірювання початкового кута обертання. Результати вимірювань занести до табл. 6.1.
4.Вилити суміш з поляриметричної трубки у склянку з залишком
реакційної суміші, покрити годинниковим склом і нагріти її до температури 65 - 70o C . Потім негайно охолодити склянку під потоком холодної води.
5. |
Охолодженою сумішшю знову заповнити поляриметричну трубку, |
||
попередньо ополоснувши її |
реакційною сумішшю, |
виміряти кут |
|
обертання (a¥ ). |
|
|
|
6. |
Розрахувати константу |
швидкості реакції гідролізу сахарози. За |
|
даними |
табл. 6.1 знайти середнє значення константи швидкості реакції |
||||||||
гідролізу сахарози. |
|
|
|
|
|
|
|
||
7. |
Для |
графічного |
визначення |
константи |
швидкості |
гідролізу |
|||
сахарози побудувати графік |
в координатахln |
a0 |
- a¥ |
-t . |
Через одержані |
||||
at |
|
||||||||
|
|
|
|
|
- a¥ |
|
|
||
точки провести пряму. Графічне значення константи швидкості реакції буде дорівнювати тангенсу кута нахилу даної прямої до вісі абсцис.
8. Порівняти значення константи швидкості реакції одержані аналітичним та графічним способами.
Аналіз одержаних результатів, висновки
45

Сахароза і продукти її гідролізу оптично активні, тобто здатні обертати площину поляризації поляризованого світла: сахароза має праве обертання [a]20D = +65,55 , глюкоза також праве [a]20D = +52,56 , фруктоза має ліве обертання [a]20D = -91,90 . Кут обертання еквімолекулярної суміші дорівнює алгебраїчній сумі кутів обертання глюкози і фруктози [a]20D = -39,40 . Тому в ході реакції відбувається зменшення кута обертання площини поляризації світла реакційною сумішшю. Реакція проходить в присутності каталізатора
– розчину соляної кислоти. Концентрацію розчину можна розрахувати за рівнянням:
c t |
= |
100 |
× a t |
(6.16) |
|
20 |
|||
|
|
l × [a ]D |
|
|
Дане рівняння пов’язує концентрацію ct (г/100 мл) оптично активної речовини в розчині, обертання площини поляризації поляризованого світла (питоме обертання довжину l (дм) поляриметричної трубки (товщина шару розчину).
Оскільки концентрація сахарози прямо пропорційна куту обертання площини поляризації світла, тоді вираз для константи швидкості реакції матиме вигляд:
1 |
|
a0 |
-a |
¥ |
(6.17) |
|
K = |
|
ln |
|
|
|
|
t |
at |
-a |
¥ |
|||
де a0 – кут обертання на момент початку реакції; ατ – кут обертання на момент часу t ; a¥ – кут обертання, що відповідає закінченню реакції.
Таблиця 6.1
Час від початку |
ατ |
a0 -a¥ |
at -a¥ |
|
a 0 |
- a ¥ |
|
|
a 0 |
- a ¥ |
|
K |
|
досліду, хв. |
at |
- a ¥ |
ln at |
- a ¥ |
|||||||||
|
|
|
|
|
|
|
|||||||
Знайдене значення константи швидкості реакціїК порівнюють з середнім значенням константи швидкості гідролізу сахарози, одержаним аналітично.
Загальна похибка експерименту складає:
DK = Dt + Da ,
|
|
K t |
a |
|
де |
Dt |
– похибка вимірювання часу; |
Da |
– похибка вимірювання кута |
|
|
|||
|
t |
a |
||
обертання. |
|
|
||
Виміри кутів обертання фіксуються за допомогою секундоміру з точністю до 1 с, що дає похибку:
Dt ×100% = 0,1% . t
Похибка вимірювання кута обертання за допомогою поляриметра складає Da = 0,1o . Отже, загальна похибка буде дорівнювати:
46

Da ×100 % = 3% . a
Виходячи з вище сказаного студент робить висновок, що відносна похибка визначення константи швидкості реакції дорівнює 3,1 %.
Лабораторна робота №6.2 ВИЗНАЧЕННЯ КОНСТАНТИ ШВИДКОСТІ РОЗЧИНЕННЯ
БЕНЗОЙНОЇ КИСЛОТИ У ВОДІ
Завдання на виконання роботи
1. Дослідити кінетику розчинення бензойної кислоти у воді шляхом вимірювання зміни концентрації розчину у часі (через 5, 10, 15, 20, 30, 40, 60 хв).
2. Розрахувати константу швидкості реакції аналітичним методом та визначити середнє значення константи швидкості процесу.
3. Побудувати графік в координатах ln a -t . a - x
4.Розрахувати константу швидкості реакції графічним методом, як тангенс кута нахилу прямої.
5.Проаналізувати одержані результати.
Прилади, лабораторний посуд та реактиви
Магнітна мішалка, склянка об’ємом 500 мл, дві конічні колби, бюретка, піпетка на 10 мл, зразок з бензойної кислоти, насичений розчин бензойної кислоти, 0,01 н розчин NaOH , фенолфталеїн.
Порядок виконання роботи
1.У склянку налити 400 мл дистильованої води і поставити на столик магнітної мішалки.
2.Відрегулювати швидкість перемішування води у склянці(глибина повітряної воронки повинна не перевершувати 5–7 мм).
3.Опустити циліндр бензойної кислоти(закріплений на магнітній мішалці) у воду на глибину, яка дорівнює 1,5–2 см від дна склянки. Відібрати по 10 мл 7 проб розчину бензойної кислоти через такі проміжки часу5, 10, 15, 20, 30, 40, 60 хв. від початку досліду і відтитрувати їх0,01 н розчином NaOH (x, мл). Результати дослідів занотовують у табл. 6.2.
|
|
|
|
|
|
|
|
Таблиця 6.2 |
|
Час відбирання проби |
x |
|
a |
|
ln |
a |
|
K |
|
від початку досліду, хв. |
|
|
a - x |
|
a - x |
|
|
|
|
|
|
|
|
|
|
|
|||
4. Відтитрувати 10 мл насиченої бензойної кислоти0,01 н розчином NaOH (a, мл) мінімум три рази.
47
5. |
Розрахувати константу швидкості |
процесу розчинення в різні |
||
інтервали часу за рівнянням(6.18). Розрахувати середнє значення константи |
||||
швидкості реакції. |
a |
|
||
6. |
Побудувати графік в координатах ln |
-t і визначити середнє |
||
|
||||
|
|
a - x |
||
значення константи швидкості реакції графічним методом.
7. Порівняти значення константи швидкості реакціїK , одержані аналітичним та графічним шляхом.
Опрацювання результатів
Константу швидкості даної реакції розраховують за формулою:
K = |
1 |
ln |
a |
, |
(6.18) |
|
|
ta - x
де t – час відбирання проби від початку досліду, с; а – об’єм 0,01 н розчину NaOH , витраченого на титрування 10 мл насиченого розчину бензойної кислоти; х – об’єм 0,01 н розчину NaOH , витраченого на титрування 10 мл проби, що відповідає часу t .
За даними табл. 6.2 |
будують |
|
графік у координатахln |
a |
-t |
та |
||||||||||||||||||||
|
a - x |
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
визначають |
константу |
|
швидкості |
|
|
|
розчинення |
бензойної |
кислоти |
|||||||||||||||||
графічним методом, яка дорівнює тангенсу кута нахилу даної прямої до |
||||||||||||||||||||||||||
вісі абсцис. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
У загальну похибку проведення експерименту входить: |
|
|
|
|
||||||||||||||||||||||
|
|
|
|
DK |
= |
|
Dt |
+ |
DV |
|
|
|
+ |
DVбюрет |
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
піпет |
|
|
|
|
|
|
|
|||||||
|
|
|
|
K |
|
|
|
|
|
|
|
|
|
Vбюрет |
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
t |
Vпіпет |
|
|
|
|
|
||||||||||||
Вимірювання часу при відборі проби кислоти проводили за допомогою |
||||||||||||||||||||||||||
секундоміра з точністю до 1 с. |
|
|
Dt |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
×100% = 0,1% . |
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
t |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Відбирання проби за допомогою піпетки об’ємом 10 мл складає: |
|
|||||||||||||||||||||||||
|
|
|
DVпіпет |
×100% = |
0,3 |
×100% = 3% . |
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
Vпіпет |
|
|
|
|
|
|
|
|
|
10 |
|
|
|
|
|
|
|
|
|
|
|||
Похибка при титруванні проби кислоти лугом за допомогою бюретки |
||||||||||||||||||||||||||
складає: |
|
DVбюрет |
|
|
|
|
|
|
|
|
|
0,1 |
|
|
|
|
|
|
|
|
|
|
||||
|
|
×100% |
= |
×100% = 0,4% . |
|
|
|
|
||||||||||||||||||
|
|
|
Vбюрет |
25 |
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Отже, |
загальну похибку |
|
|
проведення |
|
експерименту |
можна |
прийняти |
||||||||||||||||||
рівною 3,5 %. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Питання для самоперевірки
1.Дайте визначення швидкості хімічної реакції?
2.Сформулюйте закон дії мас.
48
