- •Ерстенюк а.М., Сиротинська і.Д., Мельник м.В.,
- •На підготовчому факультеті іноземних громадян
- •1. Тематичний план лекцій з хімії
- •2. Тематичний план лабораторних занять з хімії
- •3. Тематичний план контрольних робіт з хімії
- •4. Тематичний план практичних і лабораторних занять з хімії
- •Частина і. Загальна хімія
- •§1.1. Класифікація речовин
- •Способи розділення сумішей
- •Фізичні
- •§1.2. Хімічні елементи
- •Символ позначає:
- •§1.3. Атомно-молекулярне вчення. Поняття «атом» і «молекула»
- •§1.4. Відносна атомна та молекулярна маса
- •Формула позначає:
- •§1.5. Моль. Молярна маса. Закон Авогадро
- •§1.6. Основні закони хімії
- •1. Закон збереження маси: маса речовин, які вступили в реакцію, дорівнює масі продуктів реакції. Тобто, атоми не змінюються в хімічних реакціях, а тільки переходять з одних молекул в інші.
- •2. Закон сталості складу: кожна чиста речовина молекулярної будови має постійний склад, який не залежить від місця і способу одержання речовини.
- •§1.7. Приклади розв’язування задач
- •Заняття №1 Тема: Предмет хімії. Значення хімії у сучасних технічних досягненнях, у медицині та фармації. Прості і складні речовини. Властивості речовин. Чисті речовини і суміші
- •Самостійна позааудиторна робота:
- •Контрольні питання:
- •Самостійна робота на занятті
- •Самостійна позаавдиторна робота
- •Контрольні питання:
- •Самостійна робота на занятті
- •Заняття №3 Тема: Закон збереження маси речовин. Хімічне рівняння. Кількість речовини. Моль – одиниця кількості речовини. Молярна маса. Закон Авогадро. Молярний об'єм газу.
- •Самостійна позааудиторна робота
- •Контрольні питання:
- •Самостійна робота на занятті
- •Заняття №4
- •Тема: Розв’язування задач на основі законів хімії.
- •Самостійна позааудиторна робота
- •Контрольні питання:
- •Самостійна робота на занятті
- •Розділ 2. Періодичний закон і періодична система
- •Структура періодичної системи д.І.Менделєєва
- •Номер групи співпадає з числом валентних електронів, які можуть брати участь в утворенні хімічних зв'язків.
- •Значення періодичного закону і системи елементів
- •§2.2. Зміна властивостей елементів у періодичній системі д.І.Менделєєва
- •Розглянемо основні закономірності зміни властивостей елементів
- •§2.3. Будова атома. Ядро. Ізотопи
- •§2.4. Будова електронних оболонок атомов
- •§2.5. Квантові числа електронів
- •§2.6. Електронні формули елементів
- •Кожен елемент має свою індивідуальну електронну формулу.
- •§2.7. Залежність властивостей елементів від періодичної зміни електронних структур атомів
- •Заняття №5 Тема: Будова атома. Склад атомних ядер. Ізотопи
- •Самостійна позааудиторна робота
- •Контрольні питання:
- •Самостійна робота на занятті
- •Заняття №6 Тема: Атоми як форма існування хімічних елементів. Будова електронних оболонок атомів хімічних елементів. Квантові числа. Електронні формули. Поняття про електронегативність
- •Самостійна позааудиторна робота
- •Контрольні питання:
- •Самостійна робота на занятті
- •Заняття №7 Тема: Періодичний закон. Періодична система хімічних
- •Самостійна позааудиторна робота
- •Контрольні питання:
- •Самостійна робота на занятті
- •Заняття №8 Тема: Залежність властивостей елементів від періодичної зміни електронних структур атомів. Характеристика хімічних елементів за положенням у періодичній системі та будовою атома
- •Самостійна позаудиторна робота
- •Контрольні питання:
- •Самостійна робота на занятті
- •Характеристика хімічних елементів за положенням в періодичній системі і будовою атома
- •Розділ 3. Хімічний зв'язок. Типи хімічних зв’язків,
- •1. Ковалентний зв'язок
- •2. Йонний зв'язок
- •3. Металічний зв'язок
- •4. Водневий зв'язок
- •§3.2. Ковалентний зв'язок та його види
- •Види ковалентного зв'язку:
- •Властивості речовин з ковалентним неполярним зв'язком:
- •Властивості речовин з ковалентним полярним зв'язком:
- •§3.3. Механізми утворення ковалентного зв’язку
- •§3.4. Властивості ковалентного зв'язку. Σ – та π - зв’язки
- •3.5. Гібридизація атомних орбіталей.
- •3.6. Йонний зв'язок. Механізм утворення йонного зв’язку
- •3.7. Валентність та ступінь окиснення елементів
- •Як складати формули сполук за валентністю
- •Як знайти валентність:
- •3.8. Металічний зв'язок
- •3.9. Водневий зв’язок
- •Заняття 9
- •Тема: Природа хімічного зв’язку. Види хімічного зв’язку.
- •Ковалентний зв'язок: полярний і неполярний.
- •Донорно-акцепторний механізм утворення хімічного зв’язку. Гібридизація. Типи гібридизації
- •Самостійна позавдиторна робота студентів.
- •Контрольні питання:
- •Самостійна робота на занятті
- •Заняття 10 Тема: Йонний зв’язок, як граничний випадок ковалентного зв’язку. Валентність і ступінь окиснення. Металічний та водневий зв'язок.
- •Самостійна позавдиторна робота
- •Контрольні питання:
- •Самостійна робота на занятті
- •Розділ 4. Кінетика хімічних реакцій
- •§4.2. Тепловий ефект реакцій
- •§4.3. Швидкість хімічних реакцій. Фактори, від яких залежить швидкість реакції
- •1) Вплив природи реагуючих речовин
- •2) Вплив концентрації реагуючих речовин
- •3) Вплив температури на швидкість реакції
- •4) Вплив каталізатора
- •§4.4. Рівновага хімічних реакцій
- •§4.5. Способи зсуву хімічної рівноваги. Закон Ле-Шательє
- •Самостійна позааудиторна робота:
- •Контрольні питання:
- •Самостійна робота на занятті
- •Заняття №12
- •Тема: Загальні уявлення про швидкість хімічних реакцій.
- •Залежність швидкості реакції від природи, концентрації,
- •Температури. Поняття про каталіз
- •Самостійна позааудиторна робота:
- •Контрольні питання:
- •Самостійна робота на занятті
- •Заняття №13 Тема: Оборотні та необоротні реакції. Хімічна рівновага. Принцип Ле-Шательє. Константа рівноваги. Вплив зовнішніх факторів на хімічну рівновагу.
- •Самостійна позааудиторна робота
- •7. Як вплине підвищення температури на вихід продуктів реакції
- •Контрольні питання:
- •Самостійна робота на занятті
- •Розділ 5. Окисно-відновні реакції
- •§5.2. Найважливіші окисники і відновники. Окисно-відновний дуалізм
- •§5.3. Типи окисно-відновних реакцій та вплив на них різних факторів
- •Фактори, що впливають на окисно-відновні
- •§5.4. Складання рівнянь окисно-відновних реакцій
- •§5.5. Реакції з участю перманганату калію (kMnO4) як окисника
- •Реакції в нейтральному середовищі (рН7)
- •Самостійна позаудиторна робота:
- •Контрольні питання
- •Самостійна робота на занятті
- •Розділ 6. Класи неорганічних сполук
- •§6.2. Оксиди, їх склад, назви оксидів, добування, хімічні властивості
- •Графічні формули
- • Коротко основні хімічні властивості оксидів
- •Одержання оксидів
- •6.3. Основи, їх назви, добування та властивості. Амфотерні гідроксиди
- •Графічні формули основ
- •Одержання гідроксидів
- •§6.4. Кислоти, їх класифікація та номенклатура. Добування та властивості кислот
- •Хімічні властивості кислот
- •2. Кислоти взаємодіють з металами:
- •3) Кислоти взаємодіють з основними оксидами.
- •4) Кислоти взаємодіють з основами:
- •5) Кислоти взаємодіють з солями, якщо утворюється осад () або газ ():
- •6 Деякі кислоти розкладаються при нагріванні:
- •Одержання кислот
- •§6.5. Солі, їх властивості, класифікація солей, назви і добування солей. Комплексні сполуки
- •Класифікація солей:
- •Одержання солей
- •Хімічні властивості
- •Кислі солі
- •Основні солі
- •§5.6. Генетичний зв’язок між різними класами неорганічних сполук
- •Кислота
- •Заняття №15 Тема: Класифікація неорганічних речовин. Оксиди, їх класифікація, хімічні властивості.
- •Самостійна позааудиторна робота
- •Контрольні питання:
- •Самостійна робота на занятті
- •Заняття №16 Тема: Основи. Номенклатура основ, графічне зображення формул. Луги та нерозчинні у воді основи. Методи одержання та основні хімічні властивості основ
- •Самостійна позаавдиторна робота студентів.
- •Контрольні питання:
- •Самостійна робота на занятті
- •Заняття №17 Тема: Кислоти, їх класифікація. Способи отримання та хімічні властивості кислот.
- •Самостійна позаааудиторна робота студентів.
- •Контрольні питання
- •Самостійна робота на занятті
- •Заняття №18
- •Тема: Солі. Одержання солей. Хімічні властивості.
- •Класифікація солей за хімічними властивостями
- •(Середні, кислі, основні).
- •Самостійна позааудиторна робота студентів.
- •Контрольні питання
- •Самостійна робота на занятті
- •Заняття №19
- •Контрольна робота №2
- •Самостійна позааудиторна робота студентів.
- •Контрольні питання
- •Самостійна робота на занятті Правила техніки безпеки в хімічній лабораторії.
- •Перша допомога при нещасних випадках.
- •Оформлення звітів лабораторних робіт Звіти оформляються в окремому зошиті об’ємом біля 50 листів.
- •Журнал для лабораторних робіт
- •Розділ 7. Розчини.
- •Класифікація розчинів
- •3. За кількістю розчиненої речовини розчини ділять на:
- •§7.2. Розчинність речовин у воді
- •Механізм розчинення
- •§7.3. Способи вираження концентрації розчинів
- •§7.4. Приклади розв’язування задач за темою «Розчини»
- •Розв’язок:
- •Самостійна позаавдиторна робота студентів.
- •Контрольні питання
- •Самостійна робота на занятті
- •Заняття №21 Тема: Способи вираження концентрації розчинів: масова частка та молярна концентрація розчиненої речовини. Розв’язування розрахункових задач.
- •Самостійна позаавдиторна робота студентів.
- •Контрольні питання
- •Самостійна робота на занятті
- •Заняття №22
- •Тема: Приготування розчинів з заданою масовою часткою та молярною концентрацією
- •Самостійна позааудиторна робота студентів.
- •Самостійна робота на занятті
- •Техніка приготування розчину з заданою концентрацією:
- •Розділ 8. Електролітична дисоціація. РН розчинів
- •Причини та умови електролітичної дисоціації.
- •Механізм дисоціації:
- •§8.2. Особливості розчинів кислот, основ та солей
- •§8.3. Ступінь дисоціації. Сильні та слабкі електроліти. Константа дисоціації.
- •§8.4. Йонні рівняння реакцій
- •Умови безповоротності реакцій іонного обміну
- •Скорочене йонне рівняння показує
- •§8.5. Дисоціація води. Водневий показник.
- •§8.6. Гідроліз солей. Ступінь та константа гідролізу
- •Заняття №23
- •Тема: Теорія електролітичної дисоціації.
- •Електролітична дисоціація кислот, основ і солей у водних розчинах. Сильні та слабкі електроліти.
- •Ступінь та константа електролітичної дисоціації
- •Самостійна позаавдиторна робота студентів.
- •Контрольні питання
- •Самостійна робота на занятті
- •Заняття №24 Тема: Електролітична дисоціація води. Іонний добуток води. Водневий показник – рН.
- •Самостійна позаавдиторна робота студентів.
- •Контрольні питання
- •Самостійна робота на занятті
- •Заняття №25 Тема: Реакції обміну між розчинами електролітів. Йонні реакції. Контрольна робота №3
- •Самостійна позаавдиторна робота студентів
- •Контрольні питання
- •Самостійна робота на занятті
- •Заняття 26.
- •Тема: Гідроліз солей
- •Самостійна позааудиторна робота студентів
- •Контрольні питання
- •Самостійна робота на занятті
- •§9.2. Загальні фізичні та хімічні властивості металів
- •Загальні хімічні властивості металів
- •§9.3. Лужні метали. Будова, фізичні та хімічні властивості.
- •Фізичні властивості. Низькі температури плавлення, мала густина, м'які, ріжуться ножем.
- •Найважливіші Сполуки лужних металів
- •Оксиди (r2o) і пероксиди (r2o2)
- •ГІдроксиди (roh)
- •§9.4. Властивості лужноземельних металів. Твердість води.
- •Хімічні властивості
- •Найважливіші Сполуки лужноземельних металів
- •Оксиди (ro)
- •ГІдроксиди r(oh)2
- •§9.5. Підгрупа алюмінію
- •Хімічні властивості
- •Алюміній (Al) Хімічні властивості
- •Найважливіші Сполуки алюмінію
- •Гідроксид алюмінію (Al(он)3)
- •§9.6. Перехідні метали.
- •Сполуки двОвалентного Феруму
- •Гідроксид Феруму (II) Fe(oн)2
- •Сполуки трЬОхвалентного Феруму
- •Оксид Феруму (iіi) Fe2o3
- •Гідроксид феруму (iіi) Fe(oн)3
- •Заняття №27 Тема: Загальна характеристика металів. Розміщення в періодичній системі. Фізична та хімічні властивості металів. Електрохімічний ряд напруг металів. Метали в природі
- •Самостійна позааудиторна робота студентів
- •Контрольні питання
- •Самостійна робота на занятті
- •Заняття №28 Тема: Лужні і лужноземельні метали. Їх будова, фізичні та хімічні властивості. Біологічна роль сполук натрію і калію. Характеристика кальцію та його сполук
- •Самостійна позааудиторна робота студентів
- •Контрольні питання
- •Самостійна робота на занятті
- •Заняття №29
- •Тема: Алюміній: будова атома та властивості.
- •Амфотерні властивості оксиду і гідроксиду алюмінію.
- •Ферум як представник d-елементів: будова атома та властивості. Добування і використання металів
- •Самостійна позааудиторна робота студентів
- •Контрольні питання
- •Самостійна робота на занятті
- •Заняття №30
- •Тема: Порівняння хімічної активності металів
- •Самостійна позаавдиторна робота студентів
- •Контрольні питання
- •Самостійна робота на занятті
- •Експериментальна частина
- •Розділ 10. Неметали
- •Здатність атомів елементів приєднувати до себе електрони знижується в ряді:
- •§10.2. Гідроген (Водень)
- •Одержання
- •§10.3. VII а група - галогени
- •Найважливіші Сполуки
- •§10.4. VI а група – Підгрупа Оксигену
- •Сірка (сульфур) s
- •Найважливіші Сполуки сірки
- •Хімічні властивості
- •Хімічні властивості
- •Хімічні властивості
- •Хімічні властивості
- •§10.5. VII а група – підгрупа Нітрогену (Азот)
- •Хімічні властивості
- •Азот і його сполуки азот (Нітроген) n2
- •Найважливіші Сполуки азоту
- •Солі амонію
- •Хімічні властивості
- •Оксиди нітрогену
- •Хімічні властивості
- •Хімічні властивості
- •Реакції розкладання нітратів при нагріванні
- •Фосфор. Будова атома, властивості фосфору та основних його сполук Алотропні модифікації
- •Хімічні властивості
- •Хімічні властивості
- •Хімічні властивості
- •Хімічні властивості
- •Хімічні властивості
- •§10.6. IV а група.
- •Алотропія в природі вуглець існує у вигляді кількох алотропних модифікацій:
- •Хімічні властивості
- •Найважливіші сполуки вуглецю
- •Карбонатна (вугільна) кислота h2co3
- •Найважливіші сполуки кремнію
- •Кремнієві кислоти
- •Поняття про твердість води
- •Заняття №31 Тема: Положення елементів-неметалів в періодичній системі. Гідроген: будова атома, поширення в природі та властивості. Сполуки гідрогену. Властивості води
- •Самостійна позааудиторна робота
- •Контрольні питання
- •Самостійна робота на занятті
- •Заняття №32 Тема: Будова і властивості неметалів VII групи. Хлор: будова атома, поширення в природі та властивості. Найважливіші сполуки хлору: хлороводень, хлоридна кислота.
- •Самостійна позаавдиторна робота студентів
- •Контрольні питання
- •Самостійна робота на занятті
- •Заняття №33
- •Тема: Властивості неметалів VI групи.
- •Оксиген: будова атома і поширення в природі. Поняття про алотропію. Озон. Хімічні властивості та застосування кисню.
- •Будова атома та властивості сульфуру і його сполук.
- •Самостійна позаавдиторна робота студентів
- •Контрольні питання
- •Самостійна робота на занятті
- •Самостійна позаавдиторна робота студентів
- •Контрольні питання
- •Самостійна робота на занятті
- •Самостійна позаавдиторна робота студентів
- •Контрольні питання
- •Самостійна робота на занятті
- •Заняття №36 Тема: Контрольна робота №4
- •Самостійна позааудиторна робота студентів.
- •Контрольні питання
- •Самостійна робота на занятті
- •Частина ііі. Органічна хімія Розділ 11. Теоретичні основи органічної хімії
- •§11.1. Предмет органічної хімії
- •§11.2. Теорія будови органічних речовин. Ізомери. Теорія будови органічних сполук а.М. Бутлерова:
- •§11.3. Класифікація органічних сполук
- •§11.5. Номенклатура органічних сполук
- •§11.6. Класифікація реакцій в органічній хімії
- •Розділ 12. Вуглеводні
- •§12.1. Насичені вуглеводні (алкани)
- •12.1.1. Гомологічний ряд алканів
- •12.1.2. Будова молекули Метану
- •12.1.3. Ізомерія
- •12.1.4. Одержання
- •3) Реакція Вюрца:
- •12.1.7. Застосування
- •§12.2. Ненасичені вуглеводні
- •12.2.1. Алкени. Гомологічний ряд алкенів.
- •Структурна формула етилену електронна формула етилену
- •12.2.2. Електронна будова подвійного зв’язку
- •12.2.3. Ізомерія
- •12.2.4. Одержання
- •12.2.5. Фізичні властивості
- •12.2.6. Хімічні властивості
- •12.2.7. Застосування
- •12.2.8. Дієнові вуглеводні (алкадієни). Типи алкадієнів.
- •12.2.9. Одержання алкадієнів
- •12.2.10. Хімічні властивості алкадієнів
- •Полімеризація дієнових сполук
- •12.2.11. Алкіни. Гомологічний ряд алкінів
- •12.2.12. Добування
- •12.2.13. Електронна будова потрійного зв’язку
- •12.2.14. Фізичні властивості алкінів
- •Застосування
- •§ 2.3. Ароматичні вуглеводні (арени)
- •12.3.1. Будова молекули бензолу (бензену)
- •12.3.2. Гомологи бензолу. Ізомерія. Гомологи бензолу можна розглядати як похідні бензолу, в яких один або декілька атомів вуглецю заміщені різними вуглеводневими радикалами.
- •12.3.3. Фізичні властивості
- •12.3.4. Хімічні властивості
- •І. Реакції заміщення:
- •1) Галогенування
- •1) Гідрування:
- •2) Галогенування
- •12.3.5. Правила орієнтації в бензольному ядрі
- •12.3.6. Застосування
- •13.1.1. Одноатомні спирти
- •Гомологічний ряд спиртів
- •Фізичні властивості
- •Одержання
- •4) Гідроліз галогенопохідних вуглеводнів:
- •13.1.2. Багатоатомні спирти
- •Застосування
- •13.3.1. Номенклатура альдегідів і кетонів
- •13.3.2. Одержання
- •13.3.3. Хімічні властивості
- •1) Реакції приєднання
- •2) Реакція відновлення:
- •3) Реакції полімеризації:
- •13.3.4. Застосування
- •§13.4. Карбоксильні сполуки
- •13.4.1. Карбонові кислоти
- •Класифікація карбонових кислот
- •Номенклатура
- •Ізомерія карбонових кислот
- •Одержання
- •3) Промисловий синтез оцтової кислоти:
- •Хімічні властивості
- •Застосування
- •13.4.2 Естери
- •Номенклатура
- •Види ізомерії
- •Фізичні властивості
- •Одержання
- •Хімічні властивості
- •Застосування
- •Генетичний зв’язок між вуглеводнями, спиртами, альдегідами і кислотами
- •13.4.3 Ліпіди (жири)
- •Класифікація
- •Номенклатура
- •Одержання
- •Перший синтез жиру здійснив Бертло (1854 р.) при нагріванні гліцерину і стеаринової кислоти:
- •Хімічні властивості
- •Застосування
- •Біологічна роль (функції) жирів у людському організмі
- •Розділ 14. Вуглеводи §14.1. Вуглеводи. Їх класифікація
- •Значення
- •§14.2. Моносахариди. Будова. Ізомерія Вуглеводи. Генетичний d- ряд моносахаридів
- •Класифікація
- •Номенклатура Генетичний d- ряд сахаридів
- •Формули Хеуорса
- •Фізичні властивості
- •II. Реакції по гідроксильних групах
- •2. Ацилювання (утворення складних ефірів).
- •III. Специфічні реакції
- •Застосування
- •Застосування
- •Знаходження в природі
- •Знаходження в природі
- •Застосування
- •Розділ 15. Нітрогенвмісні органічні сполуки §15.1. Нітросполуки
- •Класифікація і номенклатура
- •Одержання
- •Хімічні властивості
- •Застосування
- •Класифікація
- •Номенклатура
- •Ізомерія
- •Застосування
- •§15.3. Амінокислоти
- •Класифікація
- •Ізомерія
- •Хімічні властивості
- •Біполярний йон
- •Застосування
- •Поширення в природі
- •Хімічні властивості
- •Заняття №37 Тема: Поняття про органічні сполуки. Теорія хімічної будови органічних сполук о. М. Бутлерова. Електронна природа зв'язків. Класифікація і номенклатура органічних сполук
- •Самостійна позааудиторна робота студентів.
- •Контрольні питання
- •Самостійна робота на занятті
- •Заняття №38 Тема: Насичені вуглеводні. Алкани. Будова, хімічні властивості, застосування насичених вуглеводнів
- •Самостійна позааудиторна робота студентів.
- •Контрольні питання
- •Самостійна робота на занятті
- •Заняття №39 Тема: Ненасичені вуглеводні. Π-зв’язок. Алкени. Алкадієни. Алкіни. Хімічні властивості та застосування. Реакція полімеризації. Полімери. Одержання, властивості і застосування пластмас
- •Самостійна позааудиторна робота студентів.
- •Контрольні питання
- •Самостійна робота на занятті
- •Заняття №40 Тема: Ароматичні вуглеводні. Системи спряження. Правила орієнтації в ароматичному ядрі.
- •Самостійна позааудиторна робота студентів.
- •Контрольні питання
- •Самостійна робота на занятті
- •Заняття №41 Тема: Контрольна робота №5
- •Самостійна позааудиторна робота студентів.
- •Контрольні питання
- •Самостійна робота на занятті
- •Заняття №42 Тема: Кисневмісні сполуки. Спирти. Будова, властивості, застосування насичених одноатомних спиртів. Багатоатомні спирти
- •Самостійна позааудиторна робота студентів.
- •Контрольні питання
- •Самостійна робота на занятті
- •Заняття №43 Тема: Ароматичні спирти і феноли. Структура, властивості, застосування. Генетичний зв'язок між спиртами і вуглеводами
- •Самостійна позааудиторна робота студентів.
- •Контрольні питання
- •Самостійна робота на занятті
- •Контрольні питання
- •Самостійна робота на занятті
- •Заняття №45
- •Тема: Карбонові кислоти.
- •Гомологічний ряд одноосновних насичених кислот.
- •Двохосновні карбонові кислоти. Ненасичені карбонові кислоти
- •Самостійна позааудиторна робота студентів:
- •Контрольні питання:
- •Самостійна робота на занятті
- •Заняття №46 Тема: Зв’язок між вуглеводнями, спиртами, кислотами. Взаємозв’язок між класами органічних сполук.
- •Самостійна позааудиторна робота студентів:
- •Контрольні питання:
- •Самостійна робота на занятті
- •Заняття №47 Тема: Контрольна робота №6
- •Самостійна позааудиторна робота студентів.
- •Контрольні питання
- •Самостійна робота на занятті
- •Заняття №48. Лабораторна робота №6. Тема: Ароматичні вуглеводні. Властивості бензолу та його гомологів
- •Самостійна позааудиторна робота студентів.
- •Контрольні питання
- •Самостійна робота на занятті
- •Експериментальна частина
- •Дослід 2. Дія бромної води і калій перманганату на бензен.
- •Заняття №49 Лабораторна робота №7. Тема: Спирти і альдегіди
- •Самостійна позааудиторна робота студентів.
- •Контрольні питання
- •Самостійна робота на занятті
- •Експериментальна частина
- •Заняття №50 Лабораторна робота №8. Тема: Карбонові кислоти
- •Самостійна позааудиторна робота студентів.
- •Контрольні питання
- •Самостійна робота на занятті
- •Експериментальна частина
- •Заняття №51 Лабораторна робота №9. Тема: Взаємозв’язок між класами органічних сполук
- •Самостійна позааудиторна робота студентів.
- •Контрольні питання
- •Самостійна робота на занятті
- •Експериментальна частина
- •Заняття №52 Тема: Складні ефіри. Жири як естери. Хімічні властивості жирів.
- •Самостійна позаавдиторна робота студентів
- •Контрольні питання:
- •Самостійна робота на занятті
- •Заняття №53 Тема: Вуглеводи. Класифікація вуглеводів. Моносахариди.
- •Самостійна позааудиторна робота студентів.
- •Контрольні питання
- •Самостійна робота на занятті
- •Заняття №54 Тема: Ди- і полісахариди.
- •Самостійна позааудиторна робота студентів.
- •Контрольні питання
- •Самостійна робота на занятті
- •Заняття №55 Тема: Азотовмісні сполуки. Аміни
- •Самостійна позааудиторна робота студентів.
- •Контрольні питання
- •Самостійна робота на занятті
- •Заняття №56 Тема: Амінокислоти. Пептиди. Білки. Контрольна робота №7
- •Самостійна позааудиторна робота студентів.
- •Контрольні питання
- •Самостійна робота на занятті
- •Класифікація оксидів
Контрольні питання
Яке застосування етанової кислоти?
Яка реакція називається реакцією нейтралізації?
Пояснити умови реакції естерифікації. Яка роль сульфатної кислоти?
Пояснити, чому оцтова кислота має вищу температуру кипіння, ніж етиловий спирт.
Етиловий естер мурашиної кислоти використовується як ароматизатор у виробництві мила. Скласти рівняння реакції утворення цього естеру.
Самостійна робота на занятті
1. Виконання лабораторних робіт, описаних в даних методичних вказівках.
2. Обговорення результатів та оформлення висновків.
3. Оформлення протоколу лабораторної роботи.
4. Здійснити хімічні перетворення:
а) СН4 А С2Н4О С2Н4О2
б) С2Н5ОН СН3СОН А (СН3СОО)2Са
в) С2Н2 СН3СОН А СН3СООС2Н5
5. Піддали естерифікації етанол масою 11,5 г та пропанову кислоту масою 22 г. Яка маса утвореного продукту?
6*. Відважити на терезах і покласти у пробірку порошок магнію масою 1,2 г. Долити етанової (оцтової) кислоти до повного розчинення металу. Які продукти реакції утворилися? Обчислити об’єм газу, що виділиться при цьому.
7*. Налити у пробірку метанової кислоти об’ємом 1-1,5 мл і долити концентрованої сульфатної кислоти об’ємом 3,5-4 мл. Закрити пробірку корком з газовідвідною трубкою, кінець якої помістіть у пробірку, наповнену водою. Нагріти суміш у пробірці. Що відбувається з водою у пробірці-збирачі? Написати рівняння реакції та обчисліть об’єм газу, якщо для реакції взяли метанову кислоту кількістю речовини 0,4 моль. Який це газ?
Експериментальна частина
Дослід 1. Реакція карбонових кислот з натрію гідрокарбонатом – якісна реакція на карбоксильну групу.
В пробірку вміщують 5 крапель карбонової (оцтової) кислоти, додають по 2 краплі 5%-вого розчину натрію гідрокарбонату. Спостерігають бурхливе виділення бульбашок газу – карбону (ІV) оксиду:
R-COOH + NaHCO3 RCOONa + CO2↑ + Н2О
При пропусканні газу, що виділяється, через баритову воду утворюється білий осад барію карбонату:
CO2↑ + Ba(OH)2 BaCO3↓ + H2O
Дослід 2. Відкриття оцтової і бензойної кислот реакцією з феруму (ІІІ) хлоридом.
У двох пробірках окремо в 5 краплях води розчиняють по декілька кристалів натрієвих солей оцтової і бензойної кислот. При подальшому додаванні 2 крапель 1%-вого розчину феруму (ІІІ) хлориду в пробірці з натрію ацетатом спостерігать появу коричневого забарвлення розчину, а в пробірці з натрію бензоатом виділяється рожево-жовтий осад:
9 СН3СОО- + 3 Fe3+ + 2 H2O
[Fe3(OH)2(CH3COO)6]+ + СН3СОО- + 2 СН3СООH
6 С6Н5СОО- + 2 Fe3+ + 10 H2O
(С6Н5СОО)3Fe ∙ Fe(OH)3 ∙ 7 H2O + 3 С6Н5СООH
Дослід 3. Розпад мурашиної кислоти.
У пробірку вміщують кілька крупинок натрію форміату, 3 краплі 10%-вого розчину сульфатної кислоти і 2 краплі 2%-вого розчину калію перманганату. Вміст пробірки струшують і щільно закривають пробкою з газовідвідною трубкою, кінець якої опускають в іншу пробірку з 6 краплями баритової води. При нагріванні реакційної суміші рожево-фіолетове забарвлення калію перманганату зникає, а карбону (ІV) оксид, що виділяється, утворює в пробірці з баритовою водою білий осад барію карбонату:
СО2 + Ва(ОН)2 ВаСО3 + Н2О
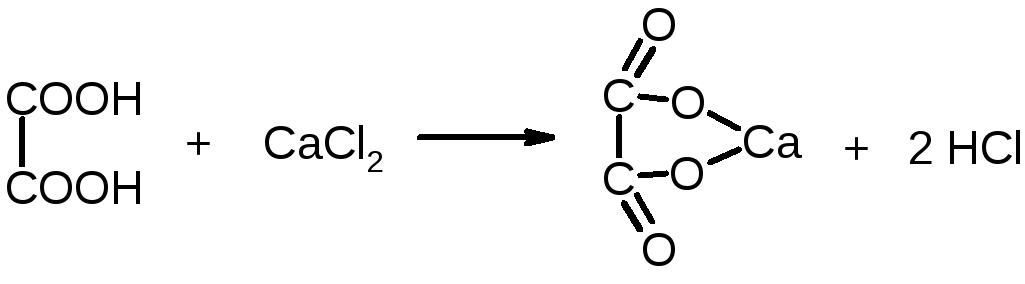
Дослід 4. Відкриття щавелевої кислоти.
У пробірку з натрію оксалатом додають 5-10 крапель води. Краплю прозорого розчину наносять на предметне скло і додають 1 краплю 5%-вого розчину кальцію хлориду. Спостерігають утворення безбарвних кристалів кальцію оксалату (під мікроскопом кристали за формою нагадують поштові конверти).