
- •1. Терминология,
- •2. Энергетика процессов
- •3. Критерии направленности процессов и равновесия
- •4. Химическое равновесие
- •1. Терминология, основные понятия и определения
- •1.1. Термодинамическая система
- •1.2. Термодинамические параметры
- •1.3. Термодинамический процесс и термодинамическое равновесие
- •1.4. Функции пути осуществления процесса и функции состояния
- •1.5. Химический процесс и химическая переменная
- •1.6. Модели идеальных систем в химической термодинамике. Реальные системы
- •2. Энергетика процессов
- •2.1. Первое начало термодинамики (постулат о существовании внутренней энергии)
- •2.2. Термодинамическая работа
- •2.3. Внутренняя энергия и теплота
- •2.4. Энтальпия
- •2.5. Взаимосвязь работы и теплоты с изменениями внутренней энергии и энтальпии в изопроцессах с участием идеального газа
- •2.6. Теплоёмкость
- •2.7. Фазовые переходы I рода
- •2.8. Зависимость теплоёмкости от температуры
- •Простых веществ
- •2.9. Зависимость внутренней энергии и энтальпии от температуры
- •2.10. Зависимость внутренней энергии, энтальпии и теплоемкости от давления
- •2.11. Изменение внутренней энергии и энтальпии в химических реакциях
- •2.12. Экспериментальные методы определения тепловых эффектов химических реакций
- •2.13. Стандартные тепловые эффекты
- •2.14. Зависимость теплового эффекта от температуры. Уравнение Кирхгофа
- •Температуры:
- •2.15. Интегрирование уравнения Кирхгофа
- •2.16. Зависимость энтальпии реакции от давления
- •3. Критерии направленности процессов и равновесия в системах постоянного и переменного составов
- •3.1. Второе начало термодинамики (постулат о существовании энтропии)
- •3 .1.1.С в о и ств а энтропии. Энтропия как критерий направленности самопроизвольных процессов и равновесия в изолированных системах
- •3.1.2. Связь энтропии с параметрами
- •3.1.4. Изменение энтропии при обратимых фазовых переходах I рода
- •3.1.5. Статистическое толкование энтропии. Уравнение б ольцма иа -Пл анка
- •3.1.7. Расчет абсолютных значений энтропии
- •Абсолютной энтропии
- •3.1.8. Изменение энтропии в химических
- •3.2. Критерии направленности процессов и равновесия в неизолированных системах
- •3.2.1. Объединенное уравнение первого и второго начал термодинамики
- •3.2.4. Зависимости энергии Гиббса и энергии Гельмгольца от основных параметров состояния
- •Веществ
- •Веществ
- •Веществ
- •Веществ
- •При наличии фазовых превращений
- •3.2.7. Уравнения г и б б с а-г е л ь м г о л ь ц а
- •3.2.8. Вывод уравнений для зависимостей термодинамических функций от давления и объема
- •3.2.9. О "сложности" преобразований при выводе уравнений химической термодинамики
- •Функций по параметрам состояния
- •3.3. Критерии направленности процессов и равновесия в системах переменного состава
- •3.3.1. Химический потенциал
- •3.3.2. Свойства химического потенциала
- •3.3.3. Химический потенциал моля идеального газа
- •3.3.4. Химический потенциал компонента смеси идеальных газов
- •4. Химическое равновесие
- •4.1. Химическое равновесие в смеси идеальных
- •4.2. Расчет стандартного химического сродства
- •4.3. Стандартное химическое сродство и термодинамическая константа равновесия как характеристики равновесного состояния
- •4.4. Химическое сродство как критерий направленности процесса
- •4.5. Зависимость константы равновесия от температуры
- •4.5.1. Дифференциальная форма уравнений изобары и изохоры химической реакции
- •4.6. Расчет термодинамической константы равновесия
- •4.6.1. Общая характеристика фонда справочных данных
- •4.6.2. Способы расчета термодинамической константы равновесия
- •4 . 7 . 1.Реа к ц и и в смесях газов.
- •Связь термодинамической константы равновесия с
- •Эмпирическими (концентрационными) константами
- •Равновесия:Кр', кх,кп,кс
- •4.7.2.Реакции в гомогенной конденсированной фазе (реакции в растворах)
- •4.7.3. Реакции в гетерогенных системах
- •4.8. Расчет состава равновесной смеси по величине термодинамической константы равновесия
- •4.8.1.Химическое превращение представлено единственным уравнением
- •4.8.2.Химическое превращение представлено двумя уравнениями
- •4.8.3. Множественные реакции
- •4.9. Влияние различных факторов на состав
3.2.8. Вывод уравнений для зависимостей термодинамических функций от давления и объема
S = f(p)T
•
Ранее было установлено,что
3. Критерии (Си Н) 101
[p# 103]
![]()
Учитывая это, продифференцируем первое уравнение по давлению, а второе - по температуре. В результате получаем:

Так как вторая смешанная производная функции, являющейся полным дифференциалом, не зависит от порядка дифференцирования, то:
![]()
В случае индивидуальных веществ объем всегда возрастает с температурой и следовательно сжатие должно приводить к уменьшению

то зависимость S^f(p) будет иметь вид
выпуклой кривой.
Влияние давления на энтропию индивидуальных веществ выражено тем
сильнее,
тем больше будет величина![]() .
В справочной литературе
.
В справочной литературе
температурный коэффициент объемного расширения характеризуют с помощью коэффициента (Р, К"1), равного величине относительного изменения объема при нагревании тела на один Кельвин:
![]()
Для жидкостей величина р мала и изменяется в сравнительно узком диапазоне от 10 до 1,5 1(Г3 К"1 (табл.4 ).
[p# 104]
102
[p# 105]
Температурные коэффициенты объемного расширения некоторых жидкостей*'
Таблица 4
|
Вещество |
Т, К |
р • ю3, к"1 |
|
Бром |
293 |
1,132 |
|
Висмут |
544-903 |
0,122 |
|
Галлий |
373-673 |
ОД15 |
|
Цинк |
693-816 |
0,147 |
|
Вода |
293 373 |
0,182 0,752 |
|
Серная кислота |
293 |
0,576 |
|
Анилин |
293 |
0,858 |
|
Бензол |
293 |
1,237 |
|
Бутиловый спирт |
293 |
0,950 |
|
Глицерин |
293 |
0,560 |
|
Диэтилкетон |
293 |
1.233 |
|
Изогексан |
293 |
1,445 |
|
Этиловый спирт |
293 |
1,120 |
|
Метиловый спирт |
293 |
1.199 |
|
Муравьиная кислота |
293 |
1.025 |
|
Хлороформ |
293 |
1,273 |
Для кристаллов, являющихся анизотропными средами, температурные коэффициенты объемного расширения представляют как сумму коэффициентов линейного расширения по главным осям симметрии. Значения р для кристаллических тел имеют тот же порядок величины, что и у жидкостей.
Следовательно, для конденсированных фаз влиянием давления на величину энтропии можно пренебречь. Например, уменьшение энтропии воды при сжатии от 1 до 100 атм при 373 К составляет:
![]()
*' Физические величины: Справочник/Под ред. И.С. Григорьева и Е.З. Мейяихова.-М. Энергоатомиздат, 1991.-1232 с.: с. 251 (Табл.10.12)
3. Критерии (G иН)
103
[p# 106]
В случае идеальных
газов:
Интегрирование
этого уравнения приводит к выражению:
![]()
![]()
![]()
Отсюда следует, что для моля идеального газа стократное сжатие приведет к уменьшению энтропии на 38,24 Дж/(моль К).
В случае реальных газов влияние давления по порядку величины будет приблизительно таким же, однако для количественного предсказания изменения энтропии необходимо располагать информацией об уравнении состояния рассматриваемого реального газа.
S = f(V)T
Известно, что
![]()
Проводя операции преобразования этих уравнений по процедуре, аналогичной выполненной в предыдущем разделе, приходим к уравнению:
![]()
Поскольку давление фиксированном объеме всегда возрастает с повышением температуры, то изотермическое сжатие в случае индивидуальных веществ будет сопровождаться уменьшением энтропии.
Для идеальных газов:
104
[p# 107]
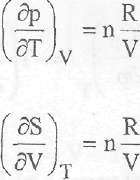
Интегрирование этого уравнения приводит к выражению:
![]()
Для реальных газов провести интегрирование можно при наличии данных об уравнении состояния.
![]()
мала и
вследствие этого влиянием сжатия на энтропию жидкостей и твердых тел можно пренебречь при условии, что воздействие давления не приводит к изменению фазового состояния вещества.
Cp = f(p)T
Как уже было показано,
![]()
Дифференцирование этого уравнения по давлению при постоянстве температуры дает:

Если учесть, что
![]()
то

[p# 108]
3. Критерии (G и Н)
105
[p# 109]
или

![]()
то теплоемкость
должна либо не зависеть от давления (если объем прямо пропорционален температуре), либо уменьшаться с повышением давления.
Нетрудно убедиться в том, что теплоемкость идеального газа не зависит от давления:

Для газов, поведение которых отличается от идеального, эта зависимость выражена весьма слабо.
В случае конденсированных фаз производная по температуре температурного коэффициента объемного расширения мало отличается от нуля^ и вследствие этого давление также практически не влияет на теплоёмкость, если в рассматриваемом интервале давлений не происходят фазовые превращения I рода.
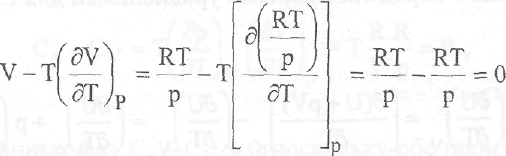
H = f(p)T
Дифференцирование по давлению уравнения для энергии Гиббса приводит при Т - const к выражению:
![]()
откуда следует, что
![]()
Принимая во внимание уравнения;
106
[p# 110]
![]()
получаем
![]()
Для идеального газа это выражение обращается в нуль:
![]()
мала и может быть
экспериментально найдена по изменению температуры газа при расширении его в пустоту в адиабатических условиях (эффект Джоуля-Томсона). Для большинства газов, кроме водорода и гелия, отмечают эффект охлаждения газа,
т.е. >0. В случае водорода газ нагревается, но если начальная
(др}т
температура ниже 195 К, то и водород будет охлаждаться.
Влияние давления на энтальпию твердых тел и жидкостей выражено слабо. В разделе 3.2.4.2. было вычислено изменение энергия Гиббса у воды при увеличении давления от 1 до 100 атм, составившее 182 Дж/моль. Для энтальпии это изменение будет еще меньше. Действительно, поскольку произведение
![]()
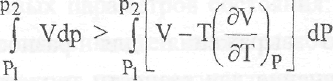
U = f(V)
Поскольку A-U-TS, то при постоянной температуре
![]()
[p# 111]
Учитывая, что
3. Критерии (G и Н)
107
[p# 112]
![]()
получаем
![]()
В з а и м о с в я з ь С р и С
В соответствии с определительными уравнениями для Ср и Cv можно записать:
![]()
При постоянстве давления
Это выражение включает производные внутренней энергии по температуре, взятые в условиях постоянства давления и объема. Поскольку для однозначной характеристики состояния индивидуального вещества достаточно задать значения только двух независимых параметров из трех, т.е. либо V и Т, либо Р и Т, то полные дифференциалы внутренней энергии по паре указанных параметров должны быть одинаковы:
![]()
![]()
Учитывая выведенное ранее уравнение:
108
Подстановка полученного выражения для разности двух производных внутренней энергии в уравнение для разности теплоемкостей при постоянных давлении и температуре дает:
![]()
[p# 113]
получаем
Нетрудно
убедиться в том, что разность молярных
теплоемкостей в случае идеальных
газов равна универсальной газовой
постоянной:
![]()
![]()
![]()
а для конденсированных фаз Ср -Cv « 0, поскольку обе производные, входящие в записанное уравнение, весьма малы.
