
- •1. Терминология,
- •2. Энергетика процессов
- •3. Критерии направленности процессов и равновесия
- •4. Химическое равновесие
- •1. Терминология, основные понятия и определения
- •1.1. Термодинамическая система
- •1.2. Термодинамические параметры
- •1.3. Термодинамический процесс и термодинамическое равновесие
- •1.4. Функции пути осуществления процесса и функции состояния
- •1.5. Химический процесс и химическая переменная
- •1.6. Модели идеальных систем в химической термодинамике. Реальные системы
- •2. Энергетика процессов
- •2.1. Первое начало термодинамики (постулат о существовании внутренней энергии)
- •2.2. Термодинамическая работа
- •2.3. Внутренняя энергия и теплота
- •2.4. Энтальпия
- •2.5. Взаимосвязь работы и теплоты с изменениями внутренней энергии и энтальпии в изопроцессах с участием идеального газа
- •2.6. Теплоёмкость
- •2.7. Фазовые переходы I рода
- •2.8. Зависимость теплоёмкости от температуры
- •Простых веществ
- •2.9. Зависимость внутренней энергии и энтальпии от температуры
- •2.10. Зависимость внутренней энергии, энтальпии и теплоемкости от давления
- •2.11. Изменение внутренней энергии и энтальпии в химических реакциях
- •2.12. Экспериментальные методы определения тепловых эффектов химических реакций
- •2.13. Стандартные тепловые эффекты
- •2.14. Зависимость теплового эффекта от температуры. Уравнение Кирхгофа
- •Температуры:
- •2.15. Интегрирование уравнения Кирхгофа
- •2.16. Зависимость энтальпии реакции от давления
- •3. Критерии направленности процессов и равновесия в системах постоянного и переменного составов
- •3.1. Второе начало термодинамики (постулат о существовании энтропии)
- •3 .1.1.С в о и ств а энтропии. Энтропия как критерий направленности самопроизвольных процессов и равновесия в изолированных системах
- •3.1.2. Связь энтропии с параметрами
- •3.1.4. Изменение энтропии при обратимых фазовых переходах I рода
- •3.1.5. Статистическое толкование энтропии. Уравнение б ольцма иа -Пл анка
- •3.1.7. Расчет абсолютных значений энтропии
- •Абсолютной энтропии
- •3.1.8. Изменение энтропии в химических
- •3.2. Критерии направленности процессов и равновесия в неизолированных системах
- •3.2.1. Объединенное уравнение первого и второго начал термодинамики
- •3.2.4. Зависимости энергии Гиббса и энергии Гельмгольца от основных параметров состояния
- •Веществ
- •Веществ
- •Веществ
- •Веществ
- •При наличии фазовых превращений
- •3.2.7. Уравнения г и б б с а-г е л ь м г о л ь ц а
- •3.2.8. Вывод уравнений для зависимостей термодинамических функций от давления и объема
- •3.2.9. О "сложности" преобразований при выводе уравнений химической термодинамики
- •Функций по параметрам состояния
- •3.3. Критерии направленности процессов и равновесия в системах переменного состава
- •3.3.1. Химический потенциал
- •3.3.2. Свойства химического потенциала
- •3.3.3. Химический потенциал моля идеального газа
- •3.3.4. Химический потенциал компонента смеси идеальных газов
- •4. Химическое равновесие
- •4.1. Химическое равновесие в смеси идеальных
- •4.2. Расчет стандартного химического сродства
- •4.3. Стандартное химическое сродство и термодинамическая константа равновесия как характеристики равновесного состояния
- •4.4. Химическое сродство как критерий направленности процесса
- •4.5. Зависимость константы равновесия от температуры
- •4.5.1. Дифференциальная форма уравнений изобары и изохоры химической реакции
- •4.6. Расчет термодинамической константы равновесия
- •4.6.1. Общая характеристика фонда справочных данных
- •4.6.2. Способы расчета термодинамической константы равновесия
- •4 . 7 . 1.Реа к ц и и в смесях газов.
- •Связь термодинамической константы равновесия с
- •Эмпирическими (концентрационными) константами
- •Равновесия:Кр', кх,кп,кс
- •4.7.2.Реакции в гомогенной конденсированной фазе (реакции в растворах)
- •4.7.3. Реакции в гетерогенных системах
- •4.8. Расчет состава равновесной смеси по величине термодинамической константы равновесия
- •4.8.1.Химическое превращение представлено единственным уравнением
- •4.8.2.Химическое превращение представлено двумя уравнениями
- •4.8.3. Множественные реакции
- •4.9. Влияние различных факторов на состав
4.5. Зависимость константы равновесия от температуры
Эта зависимость выражается уравнениями, которые могут быть представлены в дифференциальной и интегральной формах.
4.5.1. Дифференциальная форма уравнений изобары и изохоры химической реакции
Запишем уравнение Гиббса-Гельмгольца для химической реакции:

![]()
![]()
Это уравнение называют уравнением изобары химической реакции или уравнением изобары Вант-Гоффа. Оно показывает, что в случае эндотермических реакций, когда ДГН° >0, константа равновесия возрастает с повышением температуры. В экзотермических, реакциях ДГН° < 0 и, следовательно, константа уменьшается с возрастанием температуры.
В узком интервале температур можно считать, что АГН° не зависит от температуры и, следовательно, логарифм константы равновесия должен быть линейной функцией обратной температуры. Если же АГН° является функцией температуры, то в указанных координатах зависимость нелинейна.
Возможный набор вариантов, иллюстрирующй рассмотренные случаи для экзо- и эндотермических реакций показан на рис. 24 и 25.
130
[p# 134]


Рис. 24 Температурная зависимость
константы равновесия эндотермической реакции:
a-d, d-f: ЛГН j = const; b-d: ДгНт возрастает с повышением . температуры: ДгСр > 0;
c-d: ЛгНт уменьшается с повышение] температуры: АгСр < 0 ;
d - фазовый переход в одном из продуктов.
Рис, 25 Температурная зависимость
константы равновесия экзотермической реакции:
a-d, d-f: ArH^ = const;
b-d: ArHj возрастает (с учётом знака) с
повышением температуры: ДГС° >0;
c-d: АГН^ уменьшается (с учётом знака) с повышением температуры: АгСр < О ;
d фазовый переход в одном из продуктов.
Отметим, что каждый фазовый переход, если он происходит в рассматриваемом интервале температур, сопровождается изломом зависимости, а не скачкообразным изменением константы. Это обусловлено тем, что изменение энергии Гиббса при фазовых превращениях I рода равно нулю.
Уравнение изохоры химической реакции выводится аналогично и имеет вид:
![]()
4.5.2. Интегральная форма уравнения изобары химической реакции
После разделения переменных в уравнении изобары Вант-Гоффа и интегрирования полученного уравнения приходим к:
4. Химическое равновесие
131
[p# 135]

В качестве нижнего предела интегрирования может быть выбрана любая температура. Например, абсолютный нуль или 298.15 К. Использовать первый вариант не очень удобно по двум причинам. Во-первых, вследствие того, что массив данных, характеризующих температурную зависимость теплоемкости в области низких температур, ограничен, и во-вторых, по той причине, что в этом случае вид функциональной зависимости С° = f(T) исключает возможность
аналитического решения задачи. Поэтому более предпочтительным является второй вариант. В этом случае будем иметь:

После перегруппировки
всех слагаемых, включающих константы,
имеем
![]()
![]()
![]()
Подстановка выражения АгНт = f (Т) под интеграл
где
![]()
![]()
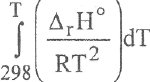
132
[p# 136]
с последующим интегрированием в пределах 298,15-Т и объединением величин, несодержащих температуру, приводит к уравнению
![]()
в
котором![]()
Это уравнение редко используется в развернутой форме. Более известны его упрощенные версии, а именно:
*![]()
что справедливо для случая линейной зависимости энтальпии реакции от температуры:
что соответствует случаю независимости энтальпии реакции от температуры (АгСр = 0) и эквивалентно записи уравнения в виде:
![]()
![]()
![]()
![]()
что отвечает нелинейной зависимости энтальпии реакции от температуры:
![]()
Каждое из записанных выше уравнений для логарифма константы равновесия позволяет определить значение энтальпии при любой температуре
[p# 137]
4, Химическое равновесие 133
[p# 138]
внутри
интервала, где оно справедливо. Для
расчета следует воспользоваться
дифференциальной
формой уравнения изобары, записав его
в виде:
![]()
Напомним, что определение энтальпии реакции по температурной зависимости термодинамической константы равновесия является единственной возможностью для характеристики энергетики процесса (и определения стандартных энтальпий образования веществ) в тех случаях, когда традиционные термохимические методы (калориметрия растворения и сжигания) не могут привести к получению необходимой информации.
