
- •1. Кинематическое описание движения. Перемещение, скорость.
- •2. Ускорение при криволинейном движении: нормальное и тангенциальное ускорение. Плоское вращение. Угловая скорость, ускорение.
- •3. Связь между векторами скорости и угловой скорости материальной точки. Нормальное, тангенциальное и полное ускорение.
- •4. Степени свободы и обобщенные координаты. Число степеней свободы абсолютно твердого тела.
- •5. Основная задача динамики. Понятие состояния в механике. Законы Ньютона.
- •6. Система единиц си. Границы применимости классической механики.
- •7. Импульс, закон сохранения импульса. Применение закона сохранения импульса к абсолютно неупругому удару. Движение тел с переменной массой.
- •Движение тел с переменной массой.
- •8. Момент импульса. Закон сохранения момента импульса.
- •9. Момент силы. Основное уравнение динамики вращательного движения.
- •10. Силы в природе. Силы сухого и вязкого трения.
- •11. Упругая сила, закон Гука.
- •12. Консервативные и неконсервативные силы в механике. Потенциальная энергия.
- •13. Кинетическая энергия. Закон сохранения энергии в механике.
- •14. Закон всемирного тяготения. Движение в центральном поле. Космические скорости. Законы Кеплера.
- •15. Уравнение движения абсолютно твердого тела. Центр масс, примеры вычисления центра масс.
- •16. Плоское вращение абсолютно твердого тела и его кинетическая энергия.
- •17. Момент инерции тела и его физический смысл. Примеры вычисления момента инерции твердых тел. Теорема Штейнера.
- •19. Идеальная и вязкая жидкость. Гидростатика несжимаемой жидкости. Стационарное движение идеальной жидкости. Уравнение Бернулли.
- •20. Гидродинамика вязкой жидкости, коэффициент вязкости. Течение по трубе. Формула Пуазейля. Закон подобия. Формула Стокса. Турбулентность.Движение вязких жидкостей и газов
- •21. Основное уравнение молекулярно - кинетической теории идеального газа. Средняя кинетическая энергия поступательного движения молекулы.
- •22. Молекулярно - кинетический смысл температуры.
- •23. Внутренняя энергия идеального газа.
- •24. Теплоёмкость идеального газа при постоянном объеме и давлении.
- •25. Статистические распределения. Вероятность и флуктуации.
- •26. Распределение Максвелла.
- •27. Средняя, среднеквадратичная и наиболее вероятная скорости газовых молекул.
- •28. Барометрическая формула. Распределение Больцмана.
- •29. Понятие о физической кинетике. Средняя длина свободного пробега, эффективный диаметр молекул и сечение рассеяния.
- •30. Вязкость, теплопроводность и диффузия в газах.
- •31. Обратимые и необратимые термодинамические процессы.
- •32.Первое начало термодинамики. Простейшие термодинамические процессы.
- •33. Кпд идеальной тепловой машины. Цикл Карно. Понятие термодинамической температуры.
- •34.Энтропия и ее термодинамический смысл. Второе начало термодинамики.
- •35. Уравнение Ван-дер-Вальса и его анализ. Экспериментальные изотермы.
- •36. Перегретая жидкость и перенасыщенный пар. Внутренняя энергия реального газа.
- •37.Эффект Джоуля - Томпсона. Сжижение газов.
- •38.Строение жидкостей. Силы поверхностного натяжения. Коэффициент поверхностного натяжения.
- •39. Давление под изогнутой поверхностью жидкости. Формула Лапласа.
- •40. Явление на границе жидкости и твердого тела. Краевой угол. Капиллярные явления.
- •41. Твердые тела. Аморфные и кристаллические тела.
- •42. Анизотропия кристаллов. Дефекты кристаллов.
- •43. Фазовые переходы первого и второго рода. Кривая фазового равновесия.
- •44. Фазовая диаграмма состояния вещества. Тройная точка. Уравнение Клайперона - Клаузиуса.
- •45. Уравнение гармонического колебания и его основные параметры.
- •48. Физический и математический маятники. Приведенная длина и центр качания физического маятника.
- •49. Уравнение затухающих колебаний. Декремент затухания.
- •50. Действие периодической силы на затухающий гармонический осциллятор. Резонанс.
- •51. Сложение гармонических колебаний одинаковой частоты и направления. Векторная даграмма.
- •5°. Если одновременно совершаются два гармонических колебания одинаковой частоты и разных амплитуд:
- •52. Сложение гармонических колебаний разной частоты. Биения.
- •53. Сложение взаимно перпендикулярных колебаний. Фигуры Лиссажу.
- •54. Уравнение плоской гармонической волны и ее основные параметры: длина волны, волновое число, фазовая скорость волны. Продольные и поперечные волны.
- •55. Волновое уравнение. Фазовая скорость волны в твердых телах и жидкостях.
- •56.Скорость звука в газах.
- •57. Передача информации с помощью волн.
- •58. Групповая скорость волны. Дисперсия.
- •59.Стоячие волны. Колебания струны.
- •60. Громкость и высота тона звука.
- •61. Эффект Доплера.
- •62. Физические измерения. Погрешности измерений.
22. Молекулярно - кинетический смысл температуры.
Определения температуры.
В термодинамике температура определяется степень нагретости тела. Для того. Чтобы измерить температуру прибор(термометр) приводят в контакт с системой и ожидают наступление состояния термодинамического равновесия т.е. состояния когда прибор приобретает ту же температуру, что и определённая система.
В молекулярной
физике температура определяется как
мера средне кинетической энергии
молекул. В соответствии с теорией Гиббса
в состоянии термодинамического равновесия
на каждую степень свободы приходится
в среднем
 энергии, т.е.
энергии, т.е.

Е1— энергия 1 свободы одной молекулы
К— постоянная Больцмана
K=1.38۠*10-23 дж/н
Т— абсолютная температура, измеряется в К
Т=t+273 0C
Энергия молекулы(кинетическая)
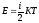
i— число степеней свободы;
i=3 для поступательных степеней свободы.
Если молекула двухатомная, то i=5.
Для многоатомных i=6;
Расчёт проводят без учёта колебательных степеней свободы, т.к. эти степени свободы включаются только при высоких температурах, далёких от 273 К
На каждую колебательную степень свободы приходится kT энергии. Тогда поступательного движения
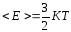

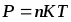
23. Внутренняя энергия идеального газа.
Внутренняя энергия— сумма все кинетических и потенциальных энергии молекул составляющих тело.
К>П следовательно U>0
Для идеального газа потенциальной энергией можно пренебречь, тогда:

Вывод: изменение внутренней энергии зависит только от изменения температуры:

і— число степеней свободы.
і=3 для одноатомной молекулы;
і=5 для двухатомной молекулы;
і=6 для многоатомной молекулы;
Замечание: количество степеней свободы зависит также от темперотуры. При низких темперотурах только поступательные, при нормальных условиях — поступательные и вращательные, при высоких темперотурах— включаются и колебательные степени свободы.
Замечание 2: колебательные степени свободы несут kT энергию.
24. Теплоёмкость идеального газа при постоянном объеме и давлении.
Теплота, получаемая системой от внешней среды, определяется как ми ргия, передаваемая системе внешними телами путем теплообмена. Пе- |и дача макросистеме тепла Q осуществляется как передача внутренней чк-ргии макросистеме от внешних тел при контакте с ними (может проис- Мдить и через излучение) без совершения работы.
Удельная
теплоемкость вещества
- это величина, характеризующая «"мкретное
вещество, равная количеству теплоты,
необходимому для на- | рсвания 1 кг
вещества на 1 К: где
m
-
масса вещества; 8Q
-
элементарное значение теплоты.
где
m
-
масса вещества; 8Q
-
элементарное значение теплоты.
Тогда теплота Q, поглощенная (выделенная) системой при изменении 1 температуры, пропорциональна массе системы и изменению температуры:
Q = j cmdT.
Если удельная теплоемкость вещества не зависит от температуры, то
Q = ст(Т2 – 71).
Единица теплоты в СИ - джоуль (Дж). Часто используется такая единица измерения теплоты, как калория: 4,19 Дж =1 кал, 4Д9Т03 Дж ~ I ккал.
Единица удельной теплоемкости в СИ- джоуль на килограмм- Кельвин (Дж/(кгК)).
Для воды при Т = 15 °С и постоянном давлении 1 атм.
1,00 ккал/(кг-°С), т.е. для повышения температуры 1 кг воды на 1°С требуется 1 ккал теплоты.
Молярная теплоемкость вещества - это величина, равная количеству теплоты, необходимому для нагревания 1 моль вещества на 1 К: С = сМ , где v = m/M - число молей, т.е. количество вещества; М- молярная масс» газа.Единица молярной теплоемкости в СИ- Джоуль на моль-кельвин (Дж/(моль К)).Теплоемкость С является функцией процесса и зависит от того, каким образом происходит процесс нагревания: при постоянном давлении ((',,) или при постоянном объеме (Су). Тогда для v молей газа теплота будет выражаться как
Q = v CpAT, p = const, Q = v CVAT , V = const. Важная характеристика газов - показатель (постоянная) адиабиты у:
y = Cp/Cv.
Опытным путем получено, что значения безразмерной величины у дли разных газов лежат в пределах 1,30-1,67.
