
- •I. Основные понятия и законы химии
- •1. Если числа молекул разных газов одинаковы, то при одних и тех же внешних условиях эти газы занимают одинаковые объёмы.
- •2. Плотность газа (ρ) – величина, численно равная отношению его молярной массы к молярному объёму при н. У.:
- •3. Относительная плотность газа х по газу y () – величина, численно равная отношению молярных масс этих газов:
- •4. Стехиометрические коэффициенты в уравнениях реакций между газами пропорциональны объёмам данных газов.
- •II. Строение атома
- •1. Ядерная модель строения атома. Состав атомных ядер. Атомный номер. Массовое число. Нуклиды. Изотопы. Явление радиоактивности. Воздействие радиоактивного излучения на живую материю.
- •III. Периодический закон и периодическая система элементов д. И. Менделеева
- •IV. Химическая связь и строение веществ
- •H─Cl (степень окисления хлора равна –1, валентность – I),
- •6. Ионная и металлическая связь. Механизм образования ионной связи. Степень ионности связи. Ионные кристаллические решетки. Координационное число иона.
- •9. Молекулярное и немолекулярное строение веществ. Молекулярные, атомные и ионные соединения. Графические и структурные формулы веществ. Газообразное и конденсированное состояния веществ.
- •Алгоритм анализа строения молекулярных частиц
- •Сокращённый вариант записи алгоритма
- •V. Химическая кинетика и термодинамика
- •VI. Растворы
- •VII. Окислительно-восстановительные реакции
- •2. Овр внутримолекулярного типа.
- •1. Оценить окислительно-восстановительные свойства веществ.
- •2. Предсказать принципиальную возможность осуществления реакции в указанном направлении.
- •4. Выбрать наиболее вероятную реакцию из нескольких возможных.
- •5. Рассчитать значение константы химического равновесия данной реакции.
- •6. Оценить влияние различных факторов на направление протекания окислительно-восстановительных реакций
- •4. Коррозия металлов. Основные виды коррозии металлов. Методы защиты металлов от коррозии.
- •VIII. Комплексные соединения
- •IX. Водород и элементы группы viia
- •Простые вещества
- •Водород
- •Галогены и их соединения
- •Бинарные соединения галогенов
- •X. Элементы группы via
- •Простые вещества
- •Взаимосвязь важнейших соединений серы:
- •XI. Элементы группы va
- •Простые вещества
- •4. Получение простых веществ. Получение азота в лабораторных условиях и в промышленности. Общие принципы получения фосфора, мышьяка, сурьмы и висмута.
- •Взаимосвязь важнейших соединений азота:
- •Взаимосвязь важнейших соединений фосфора:
- •Хii. Элементы группы IV а
- •Простые вещества
- •Взаимосвязь важнейших соединений углерода:
- •XIII. Металлы
- •Металлы главных подгрупп
- •Взаимосвязь важнейших соединений натрия:
- •Взаимосвязь важнейших соединений кальция:
- •Взаимосвязь важнейших соединений алюминия:
- •4. Подгруппа германия. Общая характеристика элементов. Сопоставление их физических и химических свойств со свойствами углерода и кремния.
- •Взаимосвязь важнейших соединений марганца:
- •Взаимосвязь важнейших соединений железа:
- •Взаимосвязь важнейших соединений меди:
Взаимосвязь важнейших соединений серы:

S + O2 → SO2;
SO2 + H2S → S + H2O;
SO2 + O2 ↔ SO3;
SO3
 SO2
+ O2;
SO2
+ O2;SO2 + KMnO4 +H2O → H2SO4 + MnSO4 + K2SO4;
H2SO4(конц.) + Сu
 SO2
+ CuSO4
+ H2O;
SO2
+ CuSO4
+ H2O;SO2 + H2O(охл.) ↔ H2SO3;
H2SO3
 SO2
+ H2O;
SO2
+ H2O;H2SO3 + H2O2 → H2SO4 + H2O;
H2SO4(разб.) + Na2SO3(охл. р-р) → H2SO3 + Na2SO4;
S + HNO3(конц.)
 H2SO4
+ NO2
+ H2O;
H2SO4
+ NO2
+ H2O;S + H2
 H2S;
H2S;H2S
 S + H2;
S + H2;H2S + HNO3(конц.)
 H2SO4
+ NO2
+ H2O;
H2SO4
+ NO2
+ H2O;H2SO4 + Na2S → H2S + Na2SO4;
SO3 + H2O → H2SO4;
H2SO4(конц.) + P2O5
 SO3↑
+ HPO3;
SO3↑
+ HPO3;SO3 + H2SO4(конц.) → H2S2O7;
H2S2O7 + P2O5
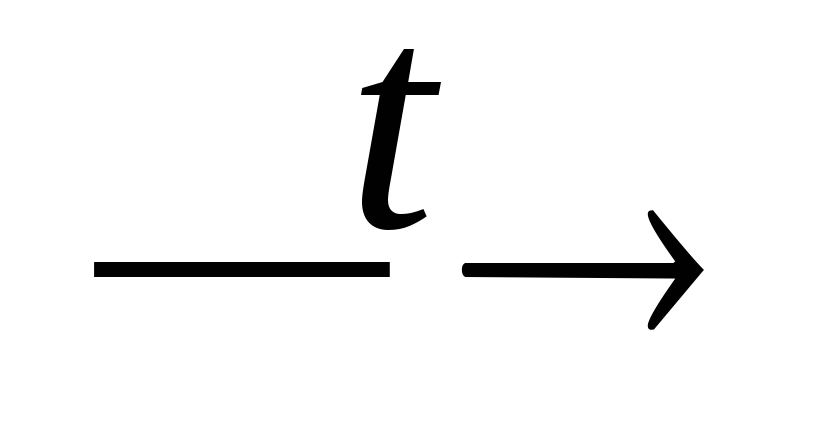 SO3↑
+ HPO3;
SO3↑
+ HPO3;См. № 18;
H2S2O7 + H2O → H2SO4;
H2S2O7 + Na2CO3 → Na2S2O7 + CO2 + H2O;
Na2S2O7 + NaOH → Na2SO4 + H2O;
Na2SO4 + SO3 → Na2S2O7;
Na2SO4 + P2O5
 SO3↑
+ NaPO3;
SO3↑
+ NaPO3;SO3 + NaOH → Na2SO4 + H2O;
Na2SO4 + C → Na2S + CO;
Na2S + O2
 Na2SO4;
Na2SO4;Na2SO3
 Na2SO4
+ Na2S;
Na2SO4
+ Na2S;Na2SO3 + H2SO4(конц.) → NaHSO4 + SO2 + H2O;
SO2 + NaOH → Na2SO3 + H2O;
Cм. № 29;
Na2SO3 + S
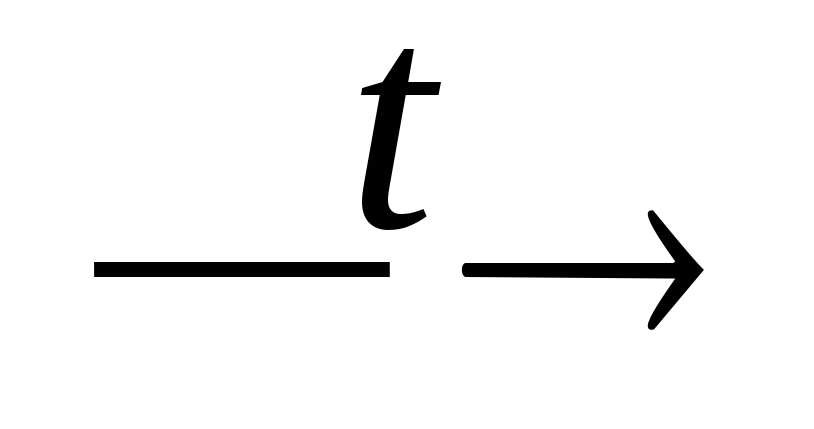 Na2S2O3;
Na2S2O3;Na2S2O3 + Cl2 + H2O → Na2SO4 + H2SO4 + HCl;
Na2S + I2 → S + NaI;
S + NaOH → Na2S + Na2SO3 + H2O;
Na2S2O3 + I2 → Na2S4O6 + NaI;
H2SO4 (50-% p-p)
 H2S2O8
+ H2↑;
H2S2O8
+ H2↑;H2S2O8 + H2O
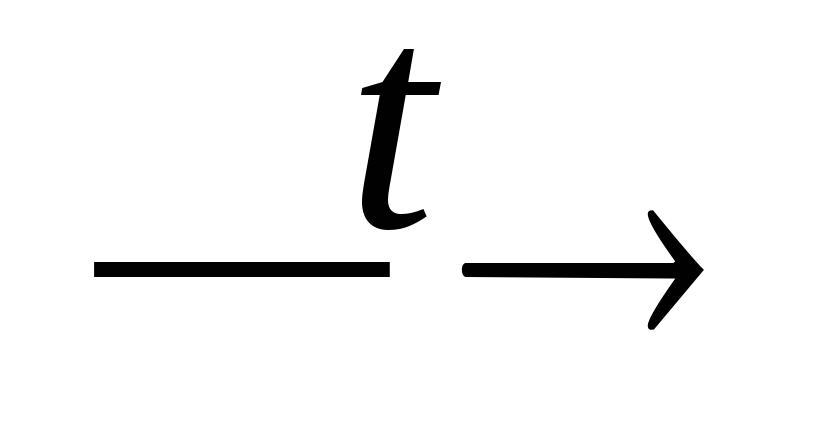 H2SO4
+ H2O2;
H2SO4
+ H2O2;H2S2O8 + NaOH → Na2S2O8 + H2O;
Na2S2O8 + NaI → Na2SO4 + I2;
См. № 36.
Na2SO3 + Na2S + HCl → S + NaCl + H2O;
XI. Элементы группы va
|
Символ элемента |
N |
P |
As |
Sb |
Bi |
|
Название элемента |
Азот |
Фосфор |
Мышьяк |
Сурьма |
Висмут |
|
Атомный номер |
7 |
15 |
33 |
51 |
83 |
|
Относительная атомная масса |
14,00674 |
30,97376 |
74,9216 |
121,75 |
208,9804 |
|
Электронная конфигурация атомов |
[He]2s22p3 |
[Ne]3s23p3 |
[Ar]4s24p3 |
[Kr]5s25p3 |
[Xe]6s26p3 |
|
Электроотри-цательность |
3,07 |
2,10 |
2,20 |
1,82 |
1,67 |
|
Основные степени окисления в соединениях |
–3, –2, –1, +1, +2, +3, +4, +5 |
–3, +1, +3, +4, +5 |
–3, +3, +5 |
–3, +3, +5 |
–3, +3, +5 |
Простые вещества
|
Состав молекулы |
N2 |
P |
As |
Sb |
Bi |
|
Агрегатное состояние (при ст. усл.) |
газ |
твёрдое вещество |
твёрдое вещество |
твёрдое вещество |
твёрдое вещество |
|
Плотность, г/см3 (при 293 K) |
1,2506* |
2,20** |
5,78 |
6,691 |
9,747 |
|
Температура плавления, toпл, оС |
–209,71 |
410*** |
817*** |
630,89 |
271,5 |
|
Температура кипения, toкип, оС |
–195,6 |
280 (Р4) |
616 (субл.) |
1635 |
1560 |
* Данные приведены в г/дм3;
** Данные приведены для красного фосфора;
***Под давлением.
1. Общая характеристика элементов. Строение атомов и проявляемые степени окисления. Валентность халькогенов. Изменение атомных радиусов, энергий ионизации, сродства к электрону и электроотрицательности в ряду N – Bi. Особенности азота. Характер химических связей с металлами и неметаллами. Устойчивость высших валентных состояний элементов.
1. с. 317-319; 2. с. 383-384; 4. с. 328; 8. с. 287-289, с. 379; 10. с. 29-30; 11. с. 435-436.
2. Строение и физические свойства простых веществ. Молекулярное и немолекулярное строение простых веществ. Характер химической связи в молекулах простых веществ. Строение молекулы азота по методам ВС и МО. Жидкий азот. Аллотропия фосфора: белый, красный и чёрный, различие в их строении. Причины устойчивости двухатомных молекул азота и склонности к образованию полимерных форм фосфора и других элементов группы. Физические свойства простых веществ. Металлические свойства висмута.
1. с. 319-323; 2. с. 142, с. 384-385, с. 404-406, с. 410-411, с. 414-416; 4. с. 329-348; 6. с.346-353; 8. с. 290-291, с. 322-323; 11. с. 436, с. 445-446.
3. Химические свойства простых веществ. Причины низкой активности азота и высокой реакционной способности белого фосфора. Окислительно-восстановительные свойства простых веществ: отношение к металлам и неметаллам, к воде, кислотам и щелочам. Химическая инертность азота. Проблема фиксации азота. Сравнение химической активности аллотропных модификаций фосфора.
1. с. 319-323; 2. с. 385, с. 404; 4. с. 329-348; 8. с. 292-294; 11. с. 445-446.
