
- •I. Основные понятия и законы химии
- •1. Если числа молекул разных газов одинаковы, то при одних и тех же внешних условиях эти газы занимают одинаковые объёмы.
- •2. Плотность газа (ρ) – величина, численно равная отношению его молярной массы к молярному объёму при н. У.:
- •3. Относительная плотность газа х по газу y () – величина, численно равная отношению молярных масс этих газов:
- •4. Стехиометрические коэффициенты в уравнениях реакций между газами пропорциональны объёмам данных газов.
- •II. Строение атома
- •1. Ядерная модель строения атома. Состав атомных ядер. Атомный номер. Массовое число. Нуклиды. Изотопы. Явление радиоактивности. Воздействие радиоактивного излучения на живую материю.
- •III. Периодический закон и периодическая система элементов д. И. Менделеева
- •IV. Химическая связь и строение веществ
- •H─Cl (степень окисления хлора равна –1, валентность – I),
- •6. Ионная и металлическая связь. Механизм образования ионной связи. Степень ионности связи. Ионные кристаллические решетки. Координационное число иона.
- •9. Молекулярное и немолекулярное строение веществ. Молекулярные, атомные и ионные соединения. Графические и структурные формулы веществ. Газообразное и конденсированное состояния веществ.
- •Алгоритм анализа строения молекулярных частиц
- •Сокращённый вариант записи алгоритма
- •V. Химическая кинетика и термодинамика
- •VI. Растворы
- •VII. Окислительно-восстановительные реакции
- •2. Овр внутримолекулярного типа.
- •1. Оценить окислительно-восстановительные свойства веществ.
- •2. Предсказать принципиальную возможность осуществления реакции в указанном направлении.
- •4. Выбрать наиболее вероятную реакцию из нескольких возможных.
- •5. Рассчитать значение константы химического равновесия данной реакции.
- •6. Оценить влияние различных факторов на направление протекания окислительно-восстановительных реакций
- •4. Коррозия металлов. Основные виды коррозии металлов. Методы защиты металлов от коррозии.
- •VIII. Комплексные соединения
- •IX. Водород и элементы группы viia
- •Простые вещества
- •Водород
- •Галогены и их соединения
- •Бинарные соединения галогенов
- •X. Элементы группы via
- •Простые вещества
- •Взаимосвязь важнейших соединений серы:
- •XI. Элементы группы va
- •Простые вещества
- •4. Получение простых веществ. Получение азота в лабораторных условиях и в промышленности. Общие принципы получения фосфора, мышьяка, сурьмы и висмута.
- •Взаимосвязь важнейших соединений азота:
- •Взаимосвязь важнейших соединений фосфора:
- •Хii. Элементы группы IV а
- •Простые вещества
- •Взаимосвязь важнейших соединений углерода:
- •XIII. Металлы
- •Металлы главных подгрупп
- •Взаимосвязь важнейших соединений натрия:
- •Взаимосвязь важнейших соединений кальция:
- •Взаимосвязь важнейших соединений алюминия:
- •4. Подгруппа германия. Общая характеристика элементов. Сопоставление их физических и химических свойств со свойствами углерода и кремния.
- •Взаимосвязь важнейших соединений марганца:
- •Взаимосвязь важнейших соединений железа:
- •Взаимосвязь важнейших соединений меди:
Сокращённый вариант записи алгоритма
ПРИМЕР V. Анализ строения молекулы серной кислоты H2SO4.
|
Элемент |
H |
S |
O |
|
Число электронов |
1 |
6 |
6 |
|
Электроотрицательность (c) |
2,1 |
2,6 |
3,5 |
N1(
 )
= 2· 1
)
= 2· 1 +1 ·
6
+1 ·
6 +4 ·
6
+4 ·
6 =32
=32
 .
.
В молекуле отсутствуют неспаренные электроны.
N2(
 )
= 2
· 2
)
= 2
· 2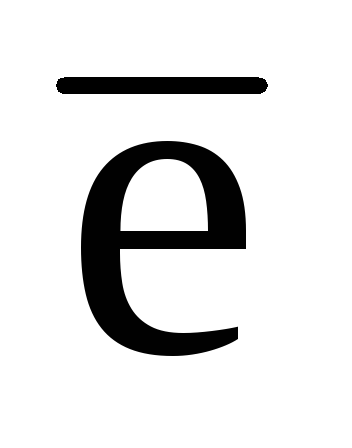 +1 ·
8
+1 ·
8 +4 ·
8
+4 ·
8 =44
=44
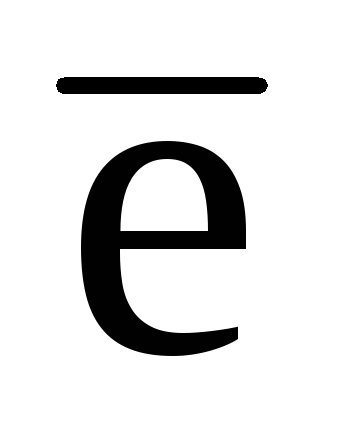 .
.ΔN(
 )
= N2(
)
= N2( )
– N1(
)
– N1( )
= 44
– 32
= 12
)
= 44
– 32
= 12
 .
.N(св.) =
 = 6.
= 6.N(s) = N(ат.) – 1 = 7 – 1 = 6; N(p) = N(св.) – N(s) = 6 – 6 = 0.

а) s-связи:
б) p-связи: – отсутствуют
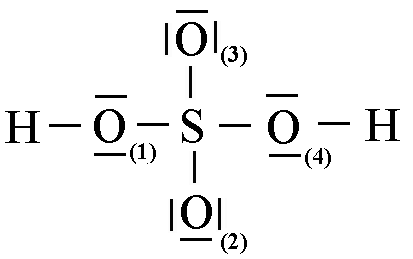
в) НЭП атомов:
Из-за отсутствия p-связей резонансные структуры невозможны.
Д
 ля
структуры7в:
ля
структуры7в:
С вязиS─О(2)
и S─О(3)
образованы по донорно-акцепторному
механизму.
вязиS─О(2)
и S─О(3)
образованы по донорно-акцепторному
механизму.
Атом S: N(гибр. орб.) = N(σ) + N(НЭП) = 4 + 0 = 4, поэтому тип гибридизации орбиталей – sp3.
Атомы О(1) и О(4): N(гибр. орб.) = N(σ) + N(НЭП) = 2 + 2 = 4, следовательно, у них тип гибридизации орбиталей также sp3.
Фрагмент молекулы – [SO4] – тетраэдр с атомом S в центре и атомами кислорода в вершинах. Валентные углы S─O─S и H─O─S близки к 109º 28′:

Молекула H2SO4 полярна:

![]()
-
Атом
Валентность
Степень окисления
H
1
+1
S
4
+6
O(1), O(4)
2
–2
O(2), О(3)
1
–2
V. Химическая кинетика и термодинамика
1. Скорость химических реакций. Определение понятия. Факторы, влияющие на скорость химической реакции: концентрация реагента, давление, температура, присутствие катализатора. Закон действующих масс (ЗДМ) как основной закон химической кинетики. Константа скорости, ее физический смысл. Влияние на константу скорости реакции природы реагирующих веществ, температуры и присутствия катализатора.
1. с. 102–105; 2. с. 163–166; 4. с. 185–188; 5. с. 48–50; 6. с. 198–201; 8. с. 14–19; 11. с. 196–207, с. 210–213.
Скорость гомогенной
реакции(![]() )
–это величина, численно равная
изменению молярной концентрации любого
участника реакции в единицу времени.
)
–это величина, численно равная
изменению молярной концентрации любого
участника реакции в единицу времени.
Средняя скорость гомогенной реакции vср.гом. в интервале времени от t1 до t2 определяется соотношением:
![]() .
.
Основные факторы, влияющие на скорость гомогенной химической реакции:
– природа реагирующих веществ;
– молярные концентрации реагентов;
– давление (если в реакции участвуют газы);
– температура;
– наличие катализатора.
Скорость гетерогенной
реакции(![]() )
–это величина, численно равная
изменению химического количества любого
участника реакции в единицу времени на
единице площади поверхности раздела
фаз:
)
–это величина, численно равная
изменению химического количества любого
участника реакции в единицу времени на
единице площади поверхности раздела
фаз:
![]() .
.
По стадийности химические реакции подразделяются на простые (одностадийные) исложные (многостадийные). Большинство химических реакций представляют собой сложные процессы, протекающие в несколько стадий, т .е. состоящие из нескольких элементарных процессов.
Для одностадийных реакций справедлив закон действующих масс: «Скорость одностадийной химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях, равных стехиометрическим коэффициентам в уравнении реакции».
Скорость одностадийной реакции аА + bB → ... согласно закону действующих масс, выражается соотношением:
![]() ,
,
где с(А) и с(В) – молярные концентрации реагирующих веществ А и В; a и b – соответствующие стехиометрические коэффициенты; k – константа скорости данной реакции.
Для гетерогенных реакций в уравнение закона действующих масс входят концентрации не всех реагентов, а только газообразных или растворенных. Так, для реакции горения углерода:
С(к) + О2 (г) → СО2 (г)
уравнение
скорости имеет вид:
![]() .
.
Физический смысл константы скорости: она численно равна скорости химической реакции при концентрациях реагирующих веществ, равных 1 моль/дм3.
Величина константы скорости гомогенной реакции зависит от природы реагирующих веществ, температуры и катализатора.
2. Влияние температуры на скорость химической реакции. Температурный коэффициент скорости химической реакции. Активные молекулы. Кривая распределения молекул по их кинетической энергии. Энергия активации. Соотношение величин энергии активации и энергии химической связи в исходных молекулах. Переходное состояние, или активированный комплекс. Энергия активации и тепловой эффект реакции (энергетическая схема). Зависимость температурного коэффициента скорости реакции от величины энергии активации.
1. с. 106-108; 2. с. 166-170; 4. с. 188-191; 5. с. 50-51; 6. с. 202-207; 8. с. 19-21; 11. с. 210-217.
При увеличении температуры скорость химической реакции обычно возрастает. Зависимость скорости реакции от температуры приближенно определяется эмпирическим правилом Вант-Гоффа: «При повышении температуры на каждые 10 градусов скорость большинства химических реакций увеличивается в 2 – 4 раза»:

где
![]() –
значения скорости реакции соответственно
при температурахТ2
и Т1;
γ –
температурный
коэффициент скорости реакции.
–
значения скорости реакции соответственно
при температурахТ2
и Т1;
γ –
температурный
коэффициент скорости реакции.
Физический смысл γ: он показывает, во сколько раз увеличивается скорость реакции при увеличении температуры на каждые 10 градусов (или, что то же самое, на 10 K).
Правило Вант-Гоффа, к сожалению, выполнимо для небольшого числа реакций и в достаточно узком температурном интервале.
Более точно зависимость скорости реакции от температуры определяется в рамках теории активации С. Аррениуса. Согласно этой теории, химическая реакция происходит при столкновении только активных частиц. Активными называются частицы, которые обладают определенной, характерной для данной реакции, энергией, необходимой для преодоления сил отталкивания между электронными оболочками реагирующих частиц. Доля активных частиц возрастает при увеличении температуры.
Активированный комплекс – это промежуточная неустойчивая группировка, образующаяся при столкновении активных частиц и находящаяся в состоянии перераспределения связей. При распаде активированного комплекса образуются продукты реакции.
Энергия активации Еа реакции равна разности между средней энергией реагирующих частиц и энергией активированного комплекса.
Для большинства химических реакций энергия активации меньше энергии наименее прочных связей в молекулах реагирующих веществ.
В теории активации влияние температуры на скорость химической реакции описывается уравнением Аррениуса для константы скорости химической реакции:
![]() ,
,
где А – постоянный множитель, не зависящий от температуры, определяющийся природой реагирующих веществ; е – основание натуральных логарифмов; Еа – энергия активации; R – молярная газовая постоянная.
Как следует из уравнения Аррениуса, константа скорости реакции тем больше, чем меньше энергия активации реакции. Даже небольшое снижение энергии активации (например, при внесении катализатора) приводит к заметному возрастанию скорости реакции.
Из уравнения Аррениуса видно, что увеличение температуры приводит к увеличению константы скорости химической реакции. Чем меньше величина Еа, тем заметнее влияние температуры на скорость реакции и, значит, тем больше температурный коэффициент скорости реакции.
3. Влияние катализатора на скорость химической реакции. Гомогенный и гетерогенный катализ. Элементы теории гомогенного катализа. Теория промежуточных соединений. Элементы теории гетерогенного катализа. Активные центры и их роль в гетерогенном катализе. Понятие об адсорбции. Влияние катализатора на энергию активации химической реакции. Катализ в природе, промышленности, технике. Биохимический катализ. Ферменты.
1. с. 108–109; 2. с. 170–173; 4. с. 197–199; 6. с. 213–222; 7. с. 197–202.; 8. с. 21–22; 11. с. 218–223.
Катализ – изменение скорости химической реакции под действием веществ, количество и природа которых в ходе этой реакции не изменяяются.
Катализатор – это вещество, изменяющее скорость химической реакции, но остающееся химически неизменным.
Положительный катализатор ускоряет реакцию; отрицательный катализатор, или ингибитор, замедляет реакцию.
В большинстве случаев действие катализатора объясняется тем, что он снижает энергию активации реакции. Каждый из промежуточных процессов с участием катализатора протекает с меньшей энергией активации, чем некатализируемая реакция.
При гомогенном катализе катализатор и реагирующие вещества образуют одну фазу (раствор). При гетерогенном катализе катализатор (обычно твердое вещество) и реагирующие вещества находятся в разных фазах.
В ходе гомогенного катализа катализатор образует с реагентом промежуточное соединение, с большой скоростью реагирующее со вторым реагентом или быстро разлагающееся с выделением продукта реакции.
Пример гомогенного катализа: окисление оксида серы(IV) до оксида серы(VI) кислородом при нитрозном способе получения серной кислоты (здесь катализатором является оксид азота(II), легко реагирующий с кислородом).
При гетерогенном катализе реакция протекает на поверхности катализатора. Начальными стадиями являются диффузия частиц реагентов к катализатору и их адсорбция (т. е. поглощение) поверхностью катализатора. Молекулы реагента взаимодействуют с атомами или группами атомов, находящимися на поверхности катализатора, образуя промежуточные поверхностные соединения. Перераспределение электронной плотности, происходящее в таких промежуточных соединениях, приводит к образованию новых веществ, которые десорбируются, т. е. удаляются с поверхности.
Процесс образования промежуточных поверхностных соединений происходит на активных центрах катализатора.
Пример гетерогенного катализа – увеличение скорости окисления оксида серы(IV) до оксида серы(VI) кислородом в присутствии оксида ванадия(V).
Примеры каталитических процессов в промышленности и технике: синтез аммиака, синтез азотной и серной кислот, крекинг и риформинг нефти, дожиг продуктов неполного сгорания бензина в автомобилях и т. д.
Примеры каталитических процессов в природе многочисленны, поскольку большинство биохимических реакций, протекающих в живых организмах, относятся к числу каталитических реакций. Катализаторами таких реакций являются белковые вещества, называемые ферментами. В организме человека находится около 30 000 ферментов, каждый из которых катализирует процессы только одного типа (например, птиалин слюны катализирует только превращение крахмала в глюкозу).
4. Химическое равновесие. Обратимые и необратимые химические реакции. Состояние химического равновесия. Константа химического равновесия. Факторы, определяющие величину константы равновесия: природа реагирующих веществ и температура. Сдвиг химического равновесия. Влияние изменения концентрации, давления и температуры на положение химического равновесия.
1. с. 109–115; 2. с. 176–182; 4. с.172–176, с. 187–188; 5. с. 51–54; 8. с. 24–31; 11. с. 184–195, с. 207–209.
Химические реакции, в результате которых исходные вещества полностью превращаются в продукты реакции, называются необратимыми.
Реакции, идущие одновременно в двух противоположных направлениях (прямом и обратном), называются обратимыми.
Состояние
системы, при котором скорости прямой и
обратной реакции равны (![]() ),
называетсясостоянием
химического равновесия.
),
называетсясостоянием
химического равновесия.
Химическое равновесие является динамическим, т. е. его установление не означает прекращение реакций. В общем случае для любой обратимой реакции аА + bB ↔ dD + eE, независимо от ее механизма, выполняется соотношение:
![]() .
.
При установившемся равновесии произведение концентраций продуктов, отнесенное к произведению концентраций исходных веществ, каждая из которых возведена в степень, равную соответствующему стехиометрическому коэффициенту, при данной температуре для данной реакции есть величина постоянная, называемая константой химического равновесия (K).
Величина константы равновесия зависит от природы реагирующих веществ и температуры, но не зависит от величины концентраций компонентов равновесной смеси.
Изменение
условий (температуры, давления,
концентраций), при которых система
находится в состоянии химического
равновесия (![]() ),
вызывает его нарушение. В результате
неодинакового изменения скоростей
прямой и обратной реакций (
),
вызывает его нарушение. В результате
неодинакового изменения скоростей
прямой и обратной реакций (![]() )
c течением времени в системе устанавливается
новое химическое равновесие (
)
c течением времени в системе устанавливается
новое химическое равновесие (![]() ),
соответствующее новым условиям.Переход
системы из одного равновесного состояния
в другое называется смещением химического
равновесия.
),
соответствующее новым условиям.Переход
системы из одного равновесного состояния
в другое называется смещением химического
равновесия.
Если при переходе из одного равновесного состояние в другое увеличиваются концентрации веществ, записанных в правой части уравнения реакции, говорят, что равновесие смещается вправо. Если же при переходе из одного равновесного состояние в другое увеличиваются концентрации веществ, записанных в левой части уравнения реакции, говорят, что равновесие смещается влево.
Направление смещения химического равновесия в результате изменения внешних условий определяется принципом Ле Шателье: «Если на систему, находящуюся в состоянии химического равновесия, оказать внешнее воздействие (изменить температуру, давление или концентрации веществ), то равновесие будет смещаться в сторону того из двух противоположных процессов, который ослабляет это воздействие».
Согласно принципу Ле Шателье:
– Увеличение концентрации компонента, записанного в левой части уравнения, приводит к смещению равновесия вправо; увеличение концентрации компонента, записанного в правой части уравнения, приводит к смещению равновесия влево;
– При увеличении температуры равновесие смещается в сторону протекания эндотермической реакции, а при уменьшении температуры – в сторону протекания экзотермической реакции;
– При увеличении давления равновесие смещается в сторону реакции, уменьшающей число молекул газообразных веществ в системе, а при уменьшении давления – в сторону реакции, увеличивающей число молекул газообразных веществ.
5. Фотохимические и цепные реакции. Особенности протекания фотохимических реакций. Фотохимические реакции и живая природа. Неразветвленные и разветвленные химические реакции (на примере реакций образования хлороводорода и воды из простых веществ). Условия зарождения и обрыва цепей.
2. с. 173–176; 4. 193–196; 6. с. 207–210; 8. с. 49–50; 11. с. 224–226.
Фотохимические реакции – это реакции, проходящие под действием квантов света. Фотохимическая реакция протекает лишь в том случае, если реагент поглощает кванты с определенной для данной реакции энергией.
Если эта энергия невелика, то молекулы реагента переходят в возбужденное состояние (становятся активными) и вступают в химическое взаимодействие. Если же поглощенная энергия велика, происходит разрыв химических связей в молекулах реагентов и образование молекул продуктов.
Скорость фотохимической реакции тем больше, чем больше интенсивность излучения.
Пример фотохимической реакции в живой природе – фотосинтез, т.е. образование органических веществ в клетках растений благодаря энергии Солнца. У большинства организмов фотосинтез проходит при участии хлорофилла и в случае высших растений суммарно выражается уравнением:
CO2
+ H2O
![]() органическое вещество + О2.
органическое вещество + О2.
В основе функционирования процессов зрения тоже лежат фотохимические процессы.
Цепная реакция – реакция, представляющая собой цепь элементарных актов взаимодействия, в которой каждый предыдущий акт инициирует осуществление последующего акта.
Стадии цепной реакции – зарождение цепи, развитие цепи и обрыв цепи.
Зарождение цепи происходит, когда за счет внешнего источника энергии (кванта электромагнитного излучения, нагревания, электрического разряда) образуются активные частицы с неспаренными электронами (атомы, свободные радикалы).
В стадии развития цепи радикалы взаимодействуют с исходными молекулами, причем в каждом акте взаимодействия образуются новые радикалы.
Обрыв цепи наступает, если два радикала сталкиваются и передают выделяющуюся при этом энергию третьему телу (молекуле, устойчивой к распаду, или стенке сосуда). Цепь также может оборваться, если образуется малоактивный радикал.
Два типа цепных реакций – неразветвленные и разветвленные.
В неразветвленных реакциях на стадии развития цепи из каждого реагирующего радикала образуется один новый радикал.
В разветвленных реакциях на стадии развития цепи из одного реагирующего радикала образуется 2 или больше новых радикалов.
6. Факторы, определяющие направление протекания химической реакции. Элементы химической термодинамики. Понятия: фаза, система, среда, макро- и микросостояния. Основные термодинамические характеристики. Внутренняя энергия системы и ее изменение в ходе химических превращений. Энтальпия. Соотношение энтальпии и внутренней энергии системы. Стандартная энтальпия вещества. Изменение энтальпии в системах в ходе химических превращений. Тепловой эффект (энтальпия) химической реакции. Экзо- и эндотермические процессы. Термохимия. Закон Гесса. Термохимические расчеты.
1. с. 89–97; 2. с. 158–163, с. 187–194; 4. с. 156–165; 5. с. 39–41; 6. с. 174–185; 8. с. 32–37; 11. с. 162–170.
Термодинамика изучает закономерности обмена энергией между системой и внешней средой, возможность, направление и пределы самопроизвольного протекания химических процессов.
Термодинамическая система (или просто система) – тело или группа взаимодействующих тел, мысленно выделяемых в пространстве. Остальная часть пространства за пределами системы называется окружающей средой (или просто средой). Система отделена от среды реальной или воображаемой границей.
Гомогенная система состоит из одной фазы, гетерогенная система – из двух или более фаз.
Фаза – это часть системы, однородная во всех ее точках по химическому составу и свойствам и отделенная от других частей системы поверхностью раздела.
Состояние системы характеризуется всей совокупностью ее физических и химических свойств. Макросостояние определяется усредненными параметрами всей совокупности частиц системы, а микросостояние – параметрами каждой отдельной частицы.
Независимые переменные, определяющие макросостояние системы, называются термодинамическими переменными, или параметрами состояния. В качестве параметров состояния обычно выбирают температуру Т, давление р, объем V, химическое количество n, концентрацию с и т. д.
Физическая величина, значение которой зависит только от параметров состояния и не зависит от пути перехода к данному состоянию, называется функцией состояния. Функциями состояния являются, в частности:
U – внутренняя энергия; Н – энтальпия; S – энтропия; G – энергия Гиббса (свободная энергия или изобарно-изотермический потенциал).
Внутренняя энергия системы U – это ее полная энергия, состоящая из кинетической и потенциальной энергии всех частиц системы (молекул, атомов, ядер, электронов) без учета кинетической и потенциальной энергии системы как целого. Поскольку полный учет всех этих составляющих невозможен, то при термодинамическом изучении системы рассматривают изменение ее внутренней энергии при переходе из одного состояния (U1) в другое (U2):
U

 1U2U = U2– U1.
1U2U = U2– U1.
Изменение внутренней энергии системы может быть определено экспериментально.
Система может обмениваться энергией (теплотой Q) с окружающей средой и совершать работу А, или, наоборот, над системой может быть совершена работа. Согласно первому закону термодинамики, являющемуся следствием закона сохранения энергии, теплота, полученная системой, может быть использована только на увеличение внутренней энергии системы и на совершение системой работы:
Q = U + A
В дальнейшем будем рассматривать свойства таких систем, на которые не воздействуют никакие иные силы, кроме сил внешнего давления.
Если в системе процесс идет при постоянном объеме (т. е. отсутствует работа против сил внешнего давления), то А = 0. Тогда тепловой эффект процесса, идущего при постоянном объеме, Qv равен изменению внутренней энергии системы:
Qv = ΔU.
Большинство химических реакций, с которыми приходится сталкиваться в обыденной жизни, идет при постоянном давлении (изобарные процессы). Если на систему не действуют иные силы, кроме постоянного внешнего давления, то:
A = p(V2 – V1) = pV
Поэтому в нашем случае (р = const):
Qp =U + pV
Qр = U2 – U1 + p(V2 – V1), откуда
Qp = (U2+ pV2) – (U1+ pV1).
Функция U + pV называется энтальпией; ее обозначают буквой Н. Энтальпия есть функция состояния и имеет размерность энергии (Дж).
Qp = H2 – H1 = H,
т. е. тепловой эффект реакции при постоянном давлении и температуре Т равен изменению энтальпии системы в ходе реакции. Он зависит от природы реагентов и продуктов, их физического состояния, условий (Т, р) проведения реакции, а также от количества веществ, участвующих в реакции.
Энтальпией реакции называют изменение энтальпии системы, в которой реагенты взаимодействуют в количествах, равных стехиометрическим коэффициентам в уравнении реакции.
Энтальпия реакции называется стандартной, если реагенты и продукты реакции находятся в стандартных состояниях.
Стандартное состояние вещества – агрегатное состояние или кристаллическая форма вещества, в которой оно термодинамически наиболее устойчиво при стандартных условиях (T = 25 oC или 298 K; р = 101,325 кПа).
Стандартным состоянием вещества, существующего при 298 K в твердом виде, считают его чистый кристалл под давлением 101,325 кПа; в жидком виде – чистую жидкость под давлением 101,325 кПа; в газообразном виде – газ с собственным давлением 101,325 кПа.
Для растворенного вещества стандартным считают его состояние в растворе при моляльности 1 моль/кг, причем предполагается, что раствор обладает свойствами бесконечно разбавленного раствора.
Стандартная энтальпия реакции образования 1 моль данного вещества из простых веществ, находящихся в своих стандартных состояниях, называется стандартной энтальпией образования этого вещества.
Пример
записи:
![]() (CO2)
= – 393,5 кДж/моль.
(CO2)
= – 393,5 кДж/моль.
Стандартная энтальпия образования простого вещества, находящегося в наиболее устойчивом (при данных р и Т) агрегатном состоянии, принимается равной 0. Если элемент образует несколько аллотропных модификаций, то нулевую стандартную энтальпию образования имеет только самая устойчивая (при данных р и Т) модификация.
Обычно термодинамические величины определяют при стандартных условиях:
р = 101,325 кПа и Т = 298 K (25 оС).
Химические уравнения, в которых указаны изменения энтальпии (тепловые эффекты реакций), называются термохимическими уравнениями. В литературе можно встретить две формы записи термохимических уравнений.
Термодинамическая форма записи термохимического уравнения:
С
(графит)
+ О2 (г)
СО2 (г);
![]() = – 393,5 кДж.
= – 393,5 кДж.
Термохимическая форма записи термохимического уравнения этого же процесса:
С (графит) + О2 (г) СО2 (г) + 393,5 кДж.
В термодинамике тепловые эффекты процессов рассматривают с позиций системы. Поэтому, если система выделяет теплоту, то Q < 0 и энтальпия системы уменьшается (ΔH < 0).
В классической термохимии тепловые эффекты рассматриваются с позиций окружающей среды. Поэтому, если система выделяет теплоту, то принимается, что Q > 0.
Экзотермическим называется процесс, протекающий с выделением теплоты (ΔH < 0).
Эндотермическим называется процесс, протекающий с поглощением теплоты (ΔH > 0).
Основным законом термохимии является закон Гесса: «Тепловой эффект реакции определяется только начальным и конечным состоянием системы и не зависит от пути перехода системы из одного состояния в другое».
Следствие из закона Гесса: Стандартный тепловой эффект реакции равен сумме стандартных теплот образования продуктов реакции за вычетом суммы стандартных теплот образования исходных веществ с учетом стехиометрических коэффициентов:
![]() (реакции)
=
(реакции)
=
![]() (прод.)
–
(прод.)
–![]() (исх.).
(исх.).
7. Понятие об энтропии. Изменение энтропии в ходе фазовых превращений и химических процессов. Понятие об изобарно-изотермическом потенциале системы (энергии Гиббса, свободной энергии). Соотношение между величиной изменения энергии Гиббса и величинами изменения энтальпии и энтропии реакции (основное термодинамическое соотношение). Термодинамический анализ возможности и условий протекания химических реакций. Особенности протекания химических процессов в живых организмах.
1. с. 97–102; 2. с. 189–196; 4. с. 165–171; 5. с. 42–44; 6. с. 186–197; 8. с. 37–46; 11. с. 170–183.
Энтропия S – это величина, пропорциональная логарифму числа равновероятных микросостояний (W), через которые может быть реализовано данное макросостояние:
S = R·ln W.
Единица энтропии – Дж/моль · K.
Энтропия является мерой степени неупорядоченности системы. Она возрастает при переходе вещества из кристаллического состояния в жидкое и из жидкого в газообразное, при растворении кристаллов, при расширении газов, при химических взаимодействиях, приводящих к увеличению числа частиц, и прежде всего частиц в газообразном состоянии. Напротив, все процессы, в результате которых упорядоченность системы возрастает (конденсация, полимеризация, сжатие, уменьшение числа частиц), сопровождаются уменьшением энтропии.
Существуют методы расчета абсолютного значения энтропии веществ, поэтому в таблицах термодинамических характеристик индивидуальных веществ приведены данные для Sо, а не для ΔSо.
Стандартная энтропия простого вещества, в отличие от энтальпии образования простого вещества, не равна нулю.
Для энтропии справедливо утверждение, аналогичное рассмотренному выше для Н: изменение энтропии системы в результате химической реакции (S) равно сумме энтропий продуктов реакции за вычетом суммы энтропий исходных веществ с учётом стехиометрических коэффициентов из уравнения реакции.
Направление, в котором в изолированной системе самопроизвольно протекает химическая реакция, определяется совместным действием двух факторов:
1) Тенденцией к переходу системы в состояние с наименьшей внутренней энергией (в случае изобарных процессов – с наименьшей энтальпией);
2) Тенденцией к достижению наиболее вероятного состояния, которое может быть реализовано наибольшим числом равновероятных способов, т. е. тенденцией к увеличению энтропии:
H → min, S → max.
Функцией состояния, одновременно отражающей влияние обеих упомянутых выше тенденций на направление протекания химических процессов, служит энергия Гиббса (свободная энергия, или изобарно-изотермический потенциал), связанная с энтальпией и энтропией соотношением
G = H – TS,
где Т – абсолютная температура.
Как видно, энергия Гиббса имеет ту же размерность, что и энтальпия, и поэтому обычно выражается в Дж или кДж.
Для изобарно-изотермических процессов (т. е. процессов, протекающих при постоянных температуре и давлении) изменение энергии Гиббса равно:
G =H – TS.
Как и в случае H и S, изменение энергии Гиббса G в результате химической реакции (энергия Гиббса реакции) равно сумме энергий Гиббса образования продуктов реакции за вычетом суммы энергий Гиббса образования исходных веществ с учётом соответствующих стехиометрических коэффициентов.
Энергию Гиббса образования вещества относят к 1 моль этого вещества и обычно выражают в кДж/моль; при этом G0 образования наиболее устойчивой модификации простого вещества принимают равной нулю.
При постоянстве температуры и давления химические реакции могут самопроизвольно протекать только в таком направлении, при котором энергия Гиббса системы уменьшается(G 0). Это есть условие принципиальной возможности осуществления данного процесса.
В приведенной таблице показана возможность и условия протекания реакции при различных сочетаниях знаков Н и S:
|
Знак изменения функции |
Принципиальная возможность и условия протекания реакции | ||
|
Н |
S |
G | |
|
– |
+ |
– |
Возможна при любой температуре |
|
+ |
– |
+ |
Принципиально невозможна |
|
– |
– |
± |
Возможна при низких температурах |
|
+ |
+ |
± |
Возможна при высоких температурах |
По знаку G можно судить о возможности (невозможности) самопроизвольного протекания отдельно взятого процесса.
Если требуется осуществить реакцию, для которой G > 0, то на систему нужно оказать определенное воздействие. Например, в клетках живых организмов протекают реакции образования сложных органических соединений, несмотря на то, что они сопровождаются увеличением энергии Гиббса. Движущей силой таких процессов являются излучение Солнца и энергетические эффекты реакций окисления в клетке.
