
- •I. Основные понятия и законы химии
- •1. Если числа молекул разных газов одинаковы, то при одних и тех же внешних условиях эти газы занимают одинаковые объёмы.
- •2. Плотность газа (ρ) – величина, численно равная отношению его молярной массы к молярному объёму при н. У.:
- •3. Относительная плотность газа х по газу y () – величина, численно равная отношению молярных масс этих газов:
- •4. Стехиометрические коэффициенты в уравнениях реакций между газами пропорциональны объёмам данных газов.
- •II. Строение атома
- •1. Ядерная модель строения атома. Состав атомных ядер. Атомный номер. Массовое число. Нуклиды. Изотопы. Явление радиоактивности. Воздействие радиоактивного излучения на живую материю.
- •III. Периодический закон и периодическая система элементов д. И. Менделеева
- •IV. Химическая связь и строение веществ
- •H─Cl (степень окисления хлора равна –1, валентность – I),
- •6. Ионная и металлическая связь. Механизм образования ионной связи. Степень ионности связи. Ионные кристаллические решетки. Координационное число иона.
- •9. Молекулярное и немолекулярное строение веществ. Молекулярные, атомные и ионные соединения. Графические и структурные формулы веществ. Газообразное и конденсированное состояния веществ.
- •Алгоритм анализа строения молекулярных частиц
- •Сокращённый вариант записи алгоритма
- •V. Химическая кинетика и термодинамика
- •VI. Растворы
- •VII. Окислительно-восстановительные реакции
- •2. Овр внутримолекулярного типа.
- •1. Оценить окислительно-восстановительные свойства веществ.
- •2. Предсказать принципиальную возможность осуществления реакции в указанном направлении.
- •4. Выбрать наиболее вероятную реакцию из нескольких возможных.
- •5. Рассчитать значение константы химического равновесия данной реакции.
- •6. Оценить влияние различных факторов на направление протекания окислительно-восстановительных реакций
- •4. Коррозия металлов. Основные виды коррозии металлов. Методы защиты металлов от коррозии.
- •VIII. Комплексные соединения
- •IX. Водород и элементы группы viia
- •Простые вещества
- •Водород
- •Галогены и их соединения
- •Бинарные соединения галогенов
- •X. Элементы группы via
- •Простые вещества
- •Взаимосвязь важнейших соединений серы:
- •XI. Элементы группы va
- •Простые вещества
- •4. Получение простых веществ. Получение азота в лабораторных условиях и в промышленности. Общие принципы получения фосфора, мышьяка, сурьмы и висмута.
- •Взаимосвязь важнейших соединений азота:
- •Взаимосвязь важнейших соединений фосфора:
- •Хii. Элементы группы IV а
- •Простые вещества
- •Взаимосвязь важнейших соединений углерода:
- •XIII. Металлы
- •Металлы главных подгрупп
- •Взаимосвязь важнейших соединений натрия:
- •Взаимосвязь важнейших соединений кальция:
- •Взаимосвязь важнейших соединений алюминия:
- •4. Подгруппа германия. Общая характеристика элементов. Сопоставление их физических и химических свойств со свойствами углерода и кремния.
- •Взаимосвязь важнейших соединений марганца:
- •Взаимосвязь важнейших соединений железа:
- •Взаимосвязь важнейших соединений меди:
Хii. Элементы группы IV а
|
Символ элемента |
C |
Si |
Ge |
Sn |
Pb |
|
Название элемента |
Углерод |
Кремний |
Германий |
Олово |
Свинец |
|
Атомный номер |
6 |
14 |
32 |
50 |
82 |
|
Относительная атомная масса |
12,011 |
28,0855 |
72,61 |
118,69 |
207,2 |
|
Электронная конфигурация атомов |
[He]2s22p2 |
[Ne]3s23p2 |
[Ar]4s24p2 |
[Kr]5s25p2 |
[Xe]6s26p2 |
|
Электроотрицательность |
2,50 |
1,74 |
2,02 |
1,72 |
1,55 |
|
Основные степени окисления в соединениях |
–4, +2, +4 |
–4, +2, +4 |
+2, +4 |
+2, +4 |
+2, +4 |
Простые вещества
|
Простое вещество |
C |
Si |
Ge |
Sn |
Pb |
|
Агрегатное состояние (при ст. усл.) |
твёрдое вещество |
твёрдое вещество |
твёрдое вещество |
твёрдое вещество |
твёрдое вещество |
|
Плотность, г/см3 (при 293 K ) |
2,265* |
2,328 |
5,323 |
7,295** |
11,336 |
|
Температура плавления, toпл, оС |
3547* |
1410 |
937 |
231,9 |
327,4 |
|
Температура кипения, toкип, оС |
4827 |
2355 |
2830 |
2270 |
1740 |
* Данные приведены для графита;
**Данные приведены для β-олова.
1. Общая характеристика элементов. Строение атомов и проявляемые степени окисления. Изменение атомных радиусов, энергий ионизации, сродства к электрону и электроотрицательности в ряду С – Pb. Характер химических связей с металлами и неметаллами. Способность углерода к образованию гомоатомных цепей С-С и кратных связей. Понятие о координационной насыщенности углерода. Устойчивость высших валентных состояний элементов.
1. с. 215-219; 2. с. 417-418, с.440-442; 4. с. 371-372, с. 389; 8. с. 248-252; 11. с. 453-456.
2. Строение и физические свойства простых веществ. Аллотропия (полиморфизм) углерода и олова. Строение и физические свойства их аллотропных модификаций. Фуллерены и фуллереноподобные структуры. Адсорбция на активированных углях. Строение и физические свойства кремния, германия и свинца. Изменение температур плавления и кипения простых веществ в ряду С – Pb. Полупроводниковые свойства кремния и германия.
1. с. 218-222; 2. с. 418-423, с.491-493, с. 504-506; 4. с. 373-378, с. 389-391; 6. с.384-390; 8. с. 250-252; 11. с. 456-458.
3. Химические свойства простых веществ. Реакционная способность простых веществ. Восстановительные свойства углерода. Усиление металлических свойств в ряду C – Pb. Взаимодействие с металлами, неметаллами, водой, кислотами, щелочами, солями. Карбиды и силициды металлов.
1. с. 220-222; 2. с. 418-423, с.432-435; 4. с. 373-388, с. 391-399; 6. с.384-390; 8. с. 250-252, с. 253-254; 11. с. 456-458.
4. Получение простых веществ. Получение углерода из природных объектов. Общие принципы получения простых веществ кремния, германия, олова и свинца.
1. с. 220-222; 2. с. 418-423, с.504-506; 4. с. 373-378, с. 390-391; 6. с.384-390; 11. с. 456-458.
5. Биологическая роль. Углерод как органогенный элемент. Роль соединений углерода в процессах жизнедеятельности. Токсичность соединений олова и свинца.
1. с. 228-229; 8. с. 263-270, 9. с. 60-64, с. 101-107.
6. Водородные соединения ЭН4. Строение молекул и характер химической связи в них. Изменение энергии связи Э – Н и устойчивости молекул в ряду СН4 – PbH4. Изменение энергии связи Э – Э и устойчивости молекул в ряду С2Н6 – Sn2H6. Физические и химические свойства. Восстановительная активность, реакции с кислородом, галогенами, щелочами. Причины химической инертности метана и высокой реакционной способности силана.
1. с. 222-225; 2. с. 439-440, с.494, с. 508; 4. с. 377-379; 8. с. 255-257, с. 271-272.
7. Оксид углерода(II). Строение молекулы и физические свойства оксида углерода(II). Химические свойства: взаимодействие с оксидами металлов, водой, щелочами, кислотами. Реакции присоединения. Фосген. Понятие о карбонилах металлов. Получение оксида углерода(II) в лаборатории и в промышленности. Токсичность «угарного газа».
1. с. 223-224; 2. с. 422-423, с.428-430; 4. с. 385-386; 8. с. 257-259; 11. с. 460-463.
8. Оксид углерода(IV). Строение молекулы CO2 и характер химической связи в ней. Физические свойства. «Сухой лёд». Химические свойства. Кислотный характер: взаимодействие с водой, щелочами, основными оксидами. Окислительные свойства CO2: взаимодействие с углем и магнием. Взаимодействие с аммиаком – синтез мочевины. Получение в лаборатории и в промышленности. Применение СО2. Роль СО2 в процессах жизнедеятельности.
1. с. 223-224; 2. с. 423-424; 4. с. 380-382; 8. с. 260-261; 11. с. 460-463.
9. Оксид кремния(IV). Полимерное строение и его причины. Особенность силоксановой связи Si—O—Si. Тип кристаллической решётки и характер химической связи в кристалле. Физические свойства. Кварцевое стекло. Кислотные свойства: отношение к воде, к щелочам и основным оксидам. Реакция с плавиковой кислотой. Окислительные свойства: реакции с углеродом и магнием. Способы перевода оксида кремния(IV) в раствор. Получение и применение.
1. с. 223-224; 2. с. 495-498; 4. с. 391-398; 8. с. 273-274; 11. с. 467-468.
10. Оксиды германия, олова и свинца. Зависимость химического характера оксидов от степени окисления элементов в них. Сравнительная характеристика кислотно-основных и окислительно-восстановительных свойств в рядах однотипных оксидов германия, олова и свинца. Амфотерность оксидов ЭО и соответствующих им гидроксидов.
1. с. 223-224; 2. с. с.510-512; 4. с. 403-405, с. 407-408; 11. с. 468-472.
11. Угольная кислота и её соли. Строение молекулы угольной кислоты и карбонат-аниона. Равновесия в водных растворах оксида углерода(IV). Особенности электролитической диссоциации угольной кислоты. Неустойчивость молекулы H2CO3. Карбонаты и гидрокарбонаты, их термическая устойчивость и взаимопревращение, гидролиз. Оснóвные карбонаты. Временная жёсткость воды и способы её устранения. Получение и применение солей угольной кислоты. Сода и поташ. Карбонатное равновесие в природе.
1. с. 225-226; 2. с. 424-428; 4. с. 382; 8. с. 260-262; 11. с. 462.
12. Кремниевые кислоты и их соли. Ортокремниевая кислота, строение её молекулы и условия существования. Поликонденсация орто-кремниевой кислоты и образование полимерных кремниевых кислот. Полиметакремниевая кислота. Строение макромолекулы и физические свойства. Строение аниона. Понятие о коллоидных растворах. Силикагель. Химические свойства: термическое разложение, реакции с щелочами и плавиковой кислотой. Получение. Соли кремниевых кислот. Метасиликаты, их свойства. «Растворимые стёкла». Природные силикаты. Алюмосиликаты. Искусственные силикаты. Стекло, керамика, цемент.
1. с. 226-227; 2. с. 496-502; 4. с. 393-398; 8. с. 274-279; 11. с. 467-468.
В заимосвязь
важнейших соединений кремния:
заимосвязь
важнейших соединений кремния:
Si + O2
 SiO2;
SiO2;SiO2 + C
 Si + CO;
Si + CO;SiO2 + NaOH → Na2SiO3 + H2O;
Na2SiO3 + HCl → H2SiO3 + NaCl;
H2SiO3 + NaOH → Na2SiO3 + H2O;
H2SiO3
 SiO2
+ H2O;
SiO2
+ H2O;SiO2 + Mg
 Mg2Si
+ MgO;
Mg2Si
+ MgO;Mg2Si + O2
 SiO2
+ MgO;
SiO2
+ MgO;Mg2Si + HCl(р-р) → SiH4↑ + MgCl2;
SiH4 + H2O(гор.)
 H2SiO3
+ H2↑;
H2SiO3
+ H2↑;SiH4 + NaOH + H2O → Na2SiO3 + H2↑;
Na2SiO3(крист.) + HF(газ) → SiF4 + NaF+ H2O;
SiF4 + NaOH →Na2SiO3 +
NaF + 3H2O;
SiF4 + H2O(пар)
 SiO2
+ HF;
SiO2
+ HF;SiO2 + HF(газ)
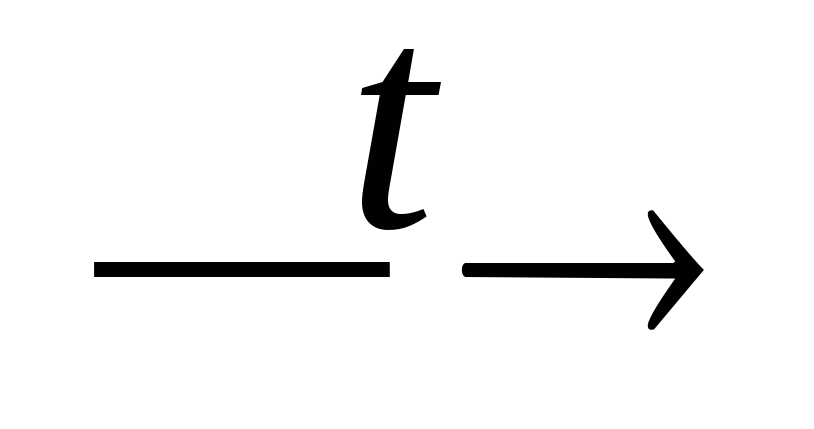 SiF4
+ H2O;
SiF4
+ H2O;SiF4 + Mg
 Si + MgF2;
Si + MgF2;Si + F2 → SiF4;
Si + NaOH + H2O → Na2SiO3 + H2↑;
Si + Cl2
 SiCl4;
SiCl4;SiCl4 + Zn
 Si + ZnCl2;
Si + ZnCl2;SiCl4 + Na[AlH4](р-р в эфире) → SiH4↑ + NaCl + AlCl3;
SiH4 + Cl2 → SiCl4 + HCl;
SiCl4 + NaOH(р-р) → Na2SiO3 + NaCl+ +H2O;
SiO2 + C + Cl2
 SiCl4
+ CO;
SiCl4
+ CO;SiCl4 + H2O(пар)
 SiO2
+ HCl;
SiO2
+ HCl;SiCl4 + H2O(охл) →H2SiO3↓ + HCl;
SiH4 + O2 → SiO2 + H2O;
SiH4
 Si + H2.
Si + H2.
