
- •I. Основные понятия и законы химии
- •1. Если числа молекул разных газов одинаковы, то при одних и тех же внешних условиях эти газы занимают одинаковые объёмы.
- •2. Плотность газа (ρ) – величина, численно равная отношению его молярной массы к молярному объёму при н. У.:
- •3. Относительная плотность газа х по газу y () – величина, численно равная отношению молярных масс этих газов:
- •4. Стехиометрические коэффициенты в уравнениях реакций между газами пропорциональны объёмам данных газов.
- •II. Строение атома
- •1. Ядерная модель строения атома. Состав атомных ядер. Атомный номер. Массовое число. Нуклиды. Изотопы. Явление радиоактивности. Воздействие радиоактивного излучения на живую материю.
- •III. Периодический закон и периодическая система элементов д. И. Менделеева
- •IV. Химическая связь и строение веществ
- •H─Cl (степень окисления хлора равна –1, валентность – I),
- •6. Ионная и металлическая связь. Механизм образования ионной связи. Степень ионности связи. Ионные кристаллические решетки. Координационное число иона.
- •9. Молекулярное и немолекулярное строение веществ. Молекулярные, атомные и ионные соединения. Графические и структурные формулы веществ. Газообразное и конденсированное состояния веществ.
- •Алгоритм анализа строения молекулярных частиц
- •Сокращённый вариант записи алгоритма
- •V. Химическая кинетика и термодинамика
- •VI. Растворы
- •VII. Окислительно-восстановительные реакции
- •2. Овр внутримолекулярного типа.
- •1. Оценить окислительно-восстановительные свойства веществ.
- •2. Предсказать принципиальную возможность осуществления реакции в указанном направлении.
- •4. Выбрать наиболее вероятную реакцию из нескольких возможных.
- •5. Рассчитать значение константы химического равновесия данной реакции.
- •6. Оценить влияние различных факторов на направление протекания окислительно-восстановительных реакций
- •4. Коррозия металлов. Основные виды коррозии металлов. Методы защиты металлов от коррозии.
- •VIII. Комплексные соединения
- •IX. Водород и элементы группы viia
- •Простые вещества
- •Водород
- •Галогены и их соединения
- •Бинарные соединения галогенов
- •X. Элементы группы via
- •Простые вещества
- •Взаимосвязь важнейших соединений серы:
- •XI. Элементы группы va
- •Простые вещества
- •4. Получение простых веществ. Получение азота в лабораторных условиях и в промышленности. Общие принципы получения фосфора, мышьяка, сурьмы и висмута.
- •Взаимосвязь важнейших соединений азота:
- •Взаимосвязь важнейших соединений фосфора:
- •Хii. Элементы группы IV а
- •Простые вещества
- •Взаимосвязь важнейших соединений углерода:
- •XIII. Металлы
- •Металлы главных подгрупп
- •Взаимосвязь важнейших соединений натрия:
- •Взаимосвязь важнейших соединений кальция:
- •Взаимосвязь важнейших соединений алюминия:
- •4. Подгруппа германия. Общая характеристика элементов. Сопоставление их физических и химических свойств со свойствами углерода и кремния.
- •Взаимосвязь важнейших соединений марганца:
- •Взаимосвязь важнейших соединений железа:
- •Взаимосвязь важнейших соединений меди:
9. Молекулярное и немолекулярное строение веществ. Молекулярные, атомные и ионные соединения. Графические и структурные формулы веществ. Газообразное и конденсированное состояния веществ.
1. с.77–88; 2. с. 151–158; 8. с. 138–146; 11. с. 138–140, с. 143–161.
Различают твердое, жидкое и газообразное агрегатные состояния вещества. Твердое и жидкое состояния объединяются общим названием «конденсирвоанное состояние».
Агрегатное состояние вещества в общем случае определяется температурой и давлением. Обычно при характеристике агрегатного состояния вещества имеются в виду стандартные условия: температура 298,15 K, давление 101,325 кПа.
При очень высокой температуре устойчиво газообразное состояние, при низкой, наоборот, все вещества находятся в конденсированном состоянии. Повышение давления способствует переходу вещества в конденсированное состояние.
Твердое вещество может находиться в кристаллическом и аморфном состоянии. Кристаллическое состояние является наиболее устойчивым.
Алгоритм анализа строения молекулярных частиц
Алгоритм анализа строения молекулярных частиц основывается на простых концепциях теории валентных связей:
Геометрическая форма частицы определяется пространственной направленностью ковалентных связей между входящими в её состав атомами. Эти связи образуются за счет электронов только внешних энергетических уровней, что характерно для атомов s-и р-элементов.
При образовании молекулярной частицы каждый из связывающихся атомов приобретает устойчивую (завершённую) внешнюю электронную оболочку (восьмиэлектронная оболочка – «октет», двухэлектронная (для атомов водорода) – «дублет»).
Алгоритм состоит из тринадцати этапов, проиллюстрированных на следующих примерах:
Пример I. Анализ строения молекулы азотной кислоты HNO3.
Запись числа электронов (
 )
на внешнем энергетическом уровне атома
каждого элемента и величины его
электроотрицательности (c):
)
на внешнем энергетическом уровне атома
каждого элемента и величины его
электроотрицательности (c):
|
Элемент |
H |
N |
O |
|
Число электронов |
1 |
5 |
6 |
|
Электроотрицательность (c) |
2,1 |
3,07 |
3,5 |
Подсчет общего числа электронов N1(
 )
на внешних
энергетических уровнях всех атомов до
образования молекулы:
)
на внешних
энергетических уровнях всех атомов до
образования молекулы:
N1(![]() )
= 1·
1
)
= 1·
1![]() +1·
5
+1·
5![]() +3 ·
6
+3 ·
6![]() =24
=24
![]() .
.
В случае отрицательно заряженных ионов с молекулярной структурой к числу электронов, имеющихся у всех атомов, прибавляют число электронов, равное заряду иона. В случае положительно заряженных ионов из общего числа электронов, имеющихся у всех атомов, вычитают число электронов, равное заряду иона.
Подсчет общего числа электронов N2(
 )
на внешних энергетических уровнях всех
атомов в молекуле при достижении каждым
из них устойчивой электронной конфигурации
из 8
)
на внешних энергетических уровнях всех
атомов в молекуле при достижении каждым
из них устойчивой электронной конфигурации
из 8 (атом Н – из двух
(атом Н – из двух ):
):
N2(![]() )
= 1·
2
)
= 1·
2![]() +1·
8
+1·
8![]() +3 ·
8
+3 ·
8![]() =34
=34
![]() .
.
Подсчёт общего дефицита электронов ΔN(
 ):
):
ΔN(![]() )
= N2(
)
= N2(![]() )
– N1(
)
– N1(![]() )
= 34 – 24 = 10
)
= 34 – 24 = 10
![]() .
.
Подсчёт общего числа ковалентных связей N(св.) в молекуле.
Поскольку
образование одной ковалентной связи
компенсирует дефицит двух
![]() ,
то общее
число связей в молекуле равно:
,
то общее
число связей в молекуле равно:
N(св.)
=
![]()
В
соответствии с этим для молекулы HNO3
N(св.)
=
![]() = 5.
= 5.
Подсчёт числа s- и p-связей в молекуле.
Число s-связей N(s) в нециклической молекуле на 1 меньше общего числа атомов N(ат.) в ней:
N(s) = N (ат.) – 1.
Поэтому в молекуле HNO3 число s-связей равно:
N(s) = N(ат.) – 1 = 5 – 1 = 4.
Число p-связей N(p) в молекуле равно разности между общим числом связей N(св.) и числом s-связей N(s):
N(p) = N(св.) – N(s).
Поэтому в молекуле HNO3 число p-связей равно:
N(p) = N(св.) – N(s) = 5 – 4 = 1.
Распределение химических связей и неподеленных электронных пар (НЭП) в молекулярной частице.
Каждая связь (пара электронов) обозначается черточкой. Распределение проводится в последовательности:

а) Электронные пары s-связей:

б) Электронные пары p-связей:

в) НЭП атомов:
Г
 рафическое
изображение возможных резонансных
структур:
рафическое
изображение возможных резонансных
структур:
П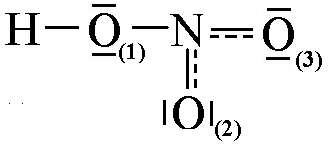 оскольку
резонансные структуры равнозначны,
можно нарисовать одну «усреднённую»
графическую формулу молекулы с
делокализованнойp-связью:
оскольку
резонансные структуры равнозначны,
можно нарисовать одну «усреднённую»
графическую формулу молекулы с
делокализованнойp-связью:
Графическое изображение и анализ электронной формулы.
В таких формулах каждая пара электронов изображается в виде или двух точек, или двух кружков, или точки и кружка.
Э лектронная
формула для резонансной структуры,
приведенной в п. 8 слева, имеет вид:
лектронная
формула для резонансной структуры,
приведенной в п. 8 слева, имеет вид:
(В этой формуле электроны атомов азота и водорода обозначены точками, кислорода – кружками).
И з
приведенной электронной формулы видно,
что одна из связей между атомом азота
и кислорода образована по донорно-акцепторному
механизму. Такая ковалентная связь
изображается стрелкой, направленной
от донора электронной пары (атомаN)
к её акцептору (атому O(2)):
з
приведенной электронной формулы видно,
что одна из связей между атомом азота
и кислорода образована по донорно-акцепторному
механизму. Такая ковалентная связь
изображается стрелкой, направленной
от донора электронной пары (атомаN)
к её акцептору (атому O(2)):
Определение типа гибридизации орбиталей центральных атомов.
Общее количество гибридных орбиталей в атоме равно сумме числа образованных им σ-связей и числа имеющихся у него неподеленных электронных пар (НЭП):
N(гибр. орб.) = N(σ) + N(НЭП).
Поэтому в молекуле HNO3 (п. 8, резонансная формула слева), у атома азота тип гибридизации орбиталей – sp2 (3 s-связи и отсутствует НЭП); у атома кислорода О(1) – sp3 (две s-связи и 2 НЭП).
Анализ геометрической формы молекулы.
Поскольку атом азота находится в sp2-гибридном состоянии и у него отсутствует НЭП, фрагмент (NO3) плоский – все 4 атома лежат в одной плоскости. Из-за наличия делокализованной p-связи угол О(2)─N─О(3) несколько больше 120 о (120 о – угол между sp2-гибридными орбиталями), а длина связей N─O(2) и N─O(3) меньше по сравнению с длиной связи N─O(1):

Определение полярности молекулы на основе её пространственного строения и полярности связей.
Молекула HNO3 полярна, т. к. она имеет несимметричное строение и сумма векторов дипольных моментов всех связей в ней не равна нулю (электрический момент диполя m молекулы не равен нулю):

![]()
Определение значений валентности и степени окисления атомов.
Количественной мерой валентности атома является число образованных им ковалентных связей. При этом учитываются связи, образованные как по обменному, так и по донорно-акцепторному механизмам.
Степень окисления определяется, как правило, числом валентных электронов, частично или полностью смещенных от атома данного элемента в химическом соединении (положительная степень окисления) или к нему (отрицательная степень окисления).
Для резонансной формулы, приведенной в п. 8 слева:
|
Атом |
Валентность |
Степень окисления |
|
N |
4 |
+5 |
|
O(1), (3) |
2 |
–2 |
|
O(2) |
1 |
–2 |
|
H |
1 |
+1 |
Пример II. Анализ строения молекулы оксида азота(IV) NO2.
Запись числа электронов (
 )
на внешнем энергетическом уровне атома
каждого элемента и величины его
электроотрицательности (c):
)
на внешнем энергетическом уровне атома
каждого элемента и величины его
электроотрицательности (c):
|
Элемент |
N |
O |
|
Число электронов |
5 |
6 |
|
Электроотрицательность (c) |
3,07 |
3,5 |
Подсчет общего числа электронов N1(
 )
на внешних
энергетических уровнях всех атомов до
образования молекулы:
)
на внешних
энергетических уровнях всех атомов до
образования молекулы:
N1(![]() )
= 1· 5
)
= 1· 5![]() +2 ·
6
+2 ·
6![]() =17
=17
![]() .
.
Обратите
внимание !!!
Поскольку общее число электронов N1(![]() )
на внешних энергетических уровнях всех
атомовнечётное,
то в образованной ими молекуле должен
быть 1
неспаренный электрон
!
)
на внешних энергетических уровнях всех
атомовнечётное,
то в образованной ими молекуле должен
быть 1
неспаренный электрон
!
Подсчет общего числа электронов N2(
 )
на внешних энергетических уровнях всех
атомов в молекуле при достижении каждым
из них устойчивой электронной конфигурации
из 8
)
на внешних энергетических уровнях всех
атомов в молекуле при достижении каждым
из них устойчивой электронной конфигурации
из 8 :
:
N2(![]() )
= 1·
8
)
= 1·
8![]() +2 ·
8
+2 ·
8![]() =24
=24
![]() .
.
Подсчёт общего дефицита электронов ΔN(
 ):
):
ΔN(![]() )
= N2(
)
= N2(![]() )
– N1(
)
– N1(![]() )
= 24
– 17
= 7
)
= 24
– 17
= 7
![]() .
.
Подсчёт общего числа ковалентных связей N (св.) в молекуле.
Поскольку
образование одной ковалентной связи
компенсирует дефицит двух
![]() ,
а в молекуле
NO2
он составляет 7
,
а в молекуле
NO2
он составляет 7
![]() ,
то общее число связей в ней равно:
,
то общее число связей в ней равно:
N(св.)
=
![]() = 3,5 (т. е. 3 связи + 1 неспар.
= 3,5 (т. е. 3 связи + 1 неспар.
![]() ).
).
Таким образом, в данной молекуле имеются 3 ковалентные связи и 1 неспаренный электрон.
Подсчёт числа s- и p-связей в молекуле.
Число s-связей N(s) в молекуле NO2 равно:
N(s) = N(ат.) – 1 = 3 – 1 = 2.
Число p-связей N(p) в этой молекуле составляет:
N(p) = N(св.) – N(s) = 3 – 2 = 1.
Распределение химических связей и неподеленных электронных пар (НЭП) в молекуле:
![]() а)
Электронные пары s-связей:
а)
Электронные пары s-связей:
![]()
б) Электронные пары p-связей:
![]() в)
НЭП атомов:
в)
НЭП атомов:
Графическое изображение возможных резонансных структур:
![]()
П![]() оскольку
резонансные структуры равнозначны,
можно нарисовать одну «усреднённую»
графическую формулу молекулы с
делокализованнойp-связью:
оскольку
резонансные структуры равнозначны,
можно нарисовать одну «усреднённую»
графическую формулу молекулы с
делокализованнойp-связью:
Графическое изображение и анализ электронной формулы.
В таких формулах каждая пара электронов изображается в виде или двух точек, или двух кружков, или точки и кружка.
Э![]() лектронная
формула для резонансной структуры,
приведенной в п. 8 слева, имеет вид:
лектронная
формула для резонансной структуры,
приведенной в п. 8 слева, имеет вид:
(Электроны атома азота обозначены точками).
И![]() з
приведенной электронной формулы видно,
что одна из связей между атомом азота
и кислорода образована по донорно-акцепторному
механизму. Такая ковалентная связь
изображается стрелкой, направленной
от донора электронной пары (атомаN)
к её акцептору (атому O):
з
приведенной электронной формулы видно,
что одна из связей между атомом азота
и кислорода образована по донорно-акцепторному
механизму. Такая ковалентная связь
изображается стрелкой, направленной
от донора электронной пары (атомаN)
к её акцептору (атому O):
Определение типа гибридизации орбиталей центрального атома.
Общее количество гибридных орбиталей в атоме равно сумме числа образованных им σ-связей и числа имеющихся у него неподеленных электронных пар (НЭП):
N(гибр. орб.) = N(σ) + N(НЭП).
Неспаренный электрон при этом считается как одна НЭП. Поэтому в молекуле NO2 (п. 8, резонансная формула слева) у атома азота тип гибридизации орбиталей – sp2 (2 s-связи и 1 НЭП).
Анализ геометрической формы молекулы.
Поскольку атом азота находится в sp2-гибридном состоянии, три его гибридные орбитали лежат в одной плоскости под углами, близкими к 120º. Две из них перекрываются с орбиталями атомов кислорода, а третья – несвязывающая гибридная орбиталь – занята неспаренным электроном. Молекула угловая. Из-за наличия делокализованной p-связи угол О(1)─N─О(2) несколько больше 120о. Длины связей N─O(1) и N─O(2) одинаковы:

Определение полярности молекулы на основе её пространственного строения и полярности связей.
 Молекула
NO2
полярна,
т. к. сумма векторов дипольных моментов
всех связей в ней не равна нулю
(электрический момент диполя m
молекулы не равен нулю):
Молекула
NO2
полярна,
т. к. сумма векторов дипольных моментов
всех связей в ней не равна нулю
(электрический момент диполя m
молекулы не равен нулю):
![]()
Определение значений валентности и степени окисления атомов.
Количественной мерой валентности атома является число образованных им ковалентных связей. При этом учитываются связи, образованные как по обменному, так и по донорно-акцепторному механизмам.
Степень окисления определяется, как правило, числом валентных электронов, частично или полностью смещенных от атома данного элемента в химическом соединении (положительная степень окисления) или к нему (отрицательная степень окисления).
Для резонансной формулы, приведенной в пункте 8 слева:
|
Атом |
Валентность |
Степень окисления |
|
N |
3 |
+4 |
|
O(1) |
1 |
–2 |
|
O(2) |
2 |
–2 |
ПРИМЕР
III.
Анализ строения молекулярного иона
![]() .
.
Запись числа электронов (
 )
на внешнем энергетическом уровне атома
каждого элемента и величины его
электроотрицательности (c):
)
на внешнем энергетическом уровне атома
каждого элемента и величины его
электроотрицательности (c):
|
Элемент |
С |
О |
|
Число электронов |
4 |
6 |
|
Электроотрицательность (c) |
2,5 |
3,5 |
Подсчет общего числа электронов N1(
 )
на внешних
энергетических уровнях всех атомов до
образования молекулярного иона:
)
на внешних
энергетических уровнях всех атомов до
образования молекулярного иона:
N1(![]() )
= 1· 4
)
= 1· 4![]() +3 ·
6
+3 ·
6![]() +2
+2![]() =24
=24
![]() .
.
Поскольку
общее число электронов N1(![]() )
в молекулярной частицечётное,
в ней нет
неспаренных электронов !
)
в молекулярной частицечётное,
в ней нет
неспаренных электронов !
Подсчет общего числа электронов N2(
 )
на внешних энергетических уровнях всех
атомов в частице при достижении каждым
из них устойчивой электронной конфигурации
из 8
)
на внешних энергетических уровнях всех
атомов в частице при достижении каждым
из них устойчивой электронной конфигурации
из 8 :
:
N2(![]() )
= 1·
8
)
= 1·
8![]() +3 ·
8
+3 ·
8![]() =32
=32
![]() .
.
Подсчёт общего дефицита электронов ΔN(
 ):
):
ΔN(![]() )
= N2(
)
= N2(![]() )
– N1(
)
– N1(![]() )
= 32
– 24
= 8
)
= 32
– 24
= 8
![]() .
.
Подсчёт общего числа ковалентных связей N(св.) в частице.
Поскольку
образование одной ковалентной связи
обусловливает дефицит двух
![]() ,
а в ионе
,
а в ионе
![]() он
составляет 8
он
составляет 8
![]() ,
то общее число связей в нём равно:
,
то общее число связей в нём равно:
N(св.)
=
![]() = 4.
= 4.
Таким образом, в данном ионе имеются 4 ковалентные связи.
Подсчёт числа s- и p-связей в ионе.
Число
s-связей
N(s)
в ионе
![]() равно:
равно:
N(s) = N(ат.) – 1 = 4 – 1 = 3.
Число p-связей N(p) в этой частице составляет:
N(p) = N(св.) – N(s) = 4 – 3 = 1.
Распределение химических связей и неподеленных электронных пар (НЭП) в молекулярном ионе:
![]()
а) Электронные пары s-связей:
![]() б)
Электронные
пары p-связей:
б)
Электронные
пары p-связей:

в) НЭП атомов:
Г
 рафическое
изображение возможных резонансных
структур:
рафическое
изображение возможных резонансных
структур:
П оскольку
резонансные структуры равнозначны,
можно нарисовать одну «усреднённую»
графическую формулу иона с делокализованнойp-связью:
оскольку
резонансные структуры равнозначны,
можно нарисовать одну «усреднённую»
графическую формулу иона с делокализованнойp-связью:
Графическое изображение и анализ электронной формулы.
В таких формулах каждая пара электронов изображается в виде или двух точек, или двух кружков, или точки и кружка. «Зарядовые» электроны (перешедшие от атомов, не входящих в состав данного иона, например, от атомов натрия) обозначаются квадратиками.
Э лектронная
формула для резонансной структуры,
приведенной в п. 8 слева, имеет вид:
лектронная
формула для резонансной структуры,
приведенной в п. 8 слева, имеет вид:
(Электроны атома углерода обозначены точками).
Из электронной формулы видно, что все связи в ионе образованы по обменному механизму.
Определение типа гибридизации орбиталей центрального атома.
Общее количество гибридных орбиталей в атоме равно сумме числа образованных им σ-связей и числа имеющихся у него неподеленных электронных пар (НЭП):
N(гибр. орб.) = N(σ) + N(НЭП).
В
соответствии с этим в ионе
![]() у
атома
углерода тип гибридизации орбиталей –
sp2
(3 s-связи
и нет НЭП).
у
атома
углерода тип гибридизации орбиталей –
sp2
(3 s-связи
и нет НЭП).
Анализ геометрической формы частицы.
 Поскольку
атом углерода
находится
в sp2-гибридном
состоянии, три его гибридные орбитали
лежат в одной плоскости под углами 120º.
Они участвуют в образовании связей с
тремя атомами кислорода. Ион
Поскольку
атом углерода
находится
в sp2-гибридном
состоянии, три его гибридные орбитали
лежат в одной плоскости под углами 120º.
Они участвуют в образовании связей с
тремя атомами кислорода. Ион
![]() строго
симметричен
и
представляет
собой равносторонний треугольник, в
центре которого находится атом углерода.
Длины всех связей С─О
одинаковы:
строго
симметричен
и
представляет
собой равносторонний треугольник, в
центре которого находится атом углерода.
Длины всех связей С─О
одинаковы:
Определение полярности частицы на основе её пространственного строения и полярности связей.
Ион
![]() неполярен,
поскольку сумма векторов дипольных
моментов всех связей в нём равна нулю
(электрический момент диполя иона равен
нулю:
неполярен,
поскольку сумма векторов дипольных
моментов всех связей в нём равна нулю
(электрический момент диполя иона равен
нулю:

![]()
Определение значений валентности и степени окисления атомов.
Количественной мерой валентности атома является число образованных им ковалентных связей. При этом учитываются связи, образованные как по обменному, так и по донорно-акцепторному механизмам.
Степень окисления определяется, как правило, числом валентных электронов, частично или полностью смещенных от атома данного элемента в химическом соединении (положительная степень окисления) или к нему (отрицательная степень окисления).
Для резонансной формулы, приведенной в пункте 8 слева:
-
Атом
Валентность
Степень окисления
С
4
+4
O(1)
2
– 2
O(2)
1
– 2
О(3)
1
– 2
ПРИМЕР IV. Анализ строения молекулярного иона (NH4)+.
Запись числа электронов (
 )
на внешнем энергетическом уровне атома
каждого элемента и величины его
электроотрицательности (c):
)
на внешнем энергетическом уровне атома
каждого элемента и величины его
электроотрицательности (c):
-
Элемент
N
H
Число электронов
5

1

Электроотрицательность (c)
3,07
2,1
Подсчет общего числа электронов N1(
 )
на внешних
энергетических уровнях всех атомов до
образования молекулярного иона:
)
на внешних
энергетических уровнях всех атомов до
образования молекулярного иона:
N1(![]() )
= 1· 5
)
= 1· 5![]() +4 ·
1
+4 ·
1![]() –
1
–
1![]() =8
=8
![]() .
.
Поскольку
общее число электронов N1(![]() )
в молекулярной частицечётное,
в ней нет
неспаренных электронов !
)
в молекулярной частицечётное,
в ней нет
неспаренных электронов !
Подсчет общего числа электронов N2(
 )
на внешних энергетических уровнях всех
атомов в частице при достижении каждым
из них устойчивой электронной
конфигурации:
)
на внешних энергетических уровнях всех
атомов в частице при достижении каждым
из них устойчивой электронной
конфигурации:
N2(![]() )
= 1·
8
)
= 1·
8![]() +4
·
2
+4
·
2![]() =16
=16
![]() .
.
Подсчёт общего дефицита электронов ΔN(
 ):
):
ΔN(![]() )
= N2(
)
= N2(![]() )
– N1(
)
– N1(![]() )
= 16 – 8 = 8
)
= 16 – 8 = 8
![]() .
.
Подсчёт общего числа ковалентных связей N(св.) в частице.
Поскольку
образование одной ковалентной связи
обусловливает дефицит двух
![]() ,
а в ионе
(NH4)+
он составляет 8
,
а в ионе
(NH4)+
он составляет 8
![]() ,
то общее число связей в нём равно:
,
то общее число связей в нём равно:
N(св.)
=
![]() = 4.
= 4.
Таким образом, в данном ионе имеются 4 ковалентные связи.
Подсчёт числа s- и p-связей в ионе.
Число s-связей N(s) в ионе (NH4)+ равно:
N(s) = N(ат.) – 1 = 5 – 1 = 4.
Число p-связей N(p) в этой частице составляет:
N(p) = N(св.) – N(s) = 4 – 4 = 0.
Таким образом, в катионе аммония p-связей нет.
Распределение химических связей и неподеленных электронных пар (НЭП) в молекулярном ионе:

а) Электронные пары s-связей:
б) Электронные пары π-связей: нет
в) НЭП атомов: нет.
Графическое изображение возможных резонансных структур:
Поскольку в катионе аммония отсутствуют p-связи, резонансные структуры для него невозможны.
Графическое изображение и анализ электронной формулы.
В таких формулах каждая пара электронов изображается в виде или двух точек, или двух кружков, или точки и кружка.
Э лектронная
формула для структуры, приведенной в
п. 7а,
имеет вид:
лектронная
формула для структуры, приведенной в
п. 7а,
имеет вид:
( Электроны
атомов азота обозначены точками). Из
приведенной электронной формулы видно,
что одна из связей между атомом азота
и водорода образована по донорно-акцепторному
механизму. Такая ковалентная связь
изображается стрелкой, направленной
от донора электронной пары (атомаN)
к её акцептору (атому Н(3)):
Электроны
атомов азота обозначены точками). Из
приведенной электронной формулы видно,
что одна из связей между атомом азота
и водорода образована по донорно-акцепторному
механизму. Такая ковалентная связь
изображается стрелкой, направленной
от донора электронной пары (атомаN)
к её акцептору (атому Н(3)):
Определение типа гибридизации орбиталей центрального атома.
Общее количество гибридных орбиталей в атоме равно сумме числа образованных им σ-связей и числа имеющихся у него неподеленных электронных пар (НЭП):
N(гибр. орб.) = N(σ) + N(НЭП).
В соответствии с этим в ионе (NH4)+ атом азота находится в sp3-гибридном состоянии (4 s-связи и нет НЭП).
Анализ геометрической формы частицы.
Поскольку атом азота находится в sp3-гибридном состоянии, четыре его гибридные орбитали расположены в пространстве тетраэдрически под углами 109º 28′ . Они перекрываются с орбиталями атомов водорода, образуя 4σ-связи, направленные от атома азота к вершинам тетраэдра:

Катион (NH4)+ строго симметричен. Длины всех связей N─H одинаковы.
Определение полярности частицы на основе её пространственного строения и полярности связей.
 Ион
(NH4)+
неполярен,
поскольку сумма векторов дипольных
моментов всех связей в нём равна нулю
(электрический момент диполя иона равен
нулю)
Ион
(NH4)+
неполярен,
поскольку сумма векторов дипольных
моментов всех связей в нём равна нулю
(электрический момент диполя иона равен
нулю)
![]()
Определение значений валентности и степени окисления атомов.
Количественной мерой валентности атома является число образованных им ковалентных связей. При этом учитываются связи, образованные как по обменному, так и по донорно-акцепторному механизмам.
Степень окисления определяется, как правило, числом валентных электронов, частично или полностью смещенных от атома данного элемента в химическом соединении (положительная степень окисления) или к нему (отрицательная степень окисления).
-
Атом
Валентность
Степень окисления
N
4
–3
H(1), (2), (3), (4)
1
+1
