
- •Министерство образования и науки Российской Федерации
- •Научный редактор
- •Введение
- •1. Основные термические параметры состояния
- •Удельный объем
- •Давление
- •Соотношения единиц измерения давления
- •Температура
- •1.1. Задачи
- •1.2. Контрольные вопросы
- •2. Законы и уравнения состояния идеальных газов. Смеси идеальных газов
- •2.1. Задачи
- •2.2. Контрольные вопросы
- •3. Теплоемкости газов и газовых смесей
- •3.1. Задачи
- •3.2. Контрольные вопросы
- •4. Первый закон термодинамики для закрытой системы
- •4.1. Задачи
- •4.2. Контрольные вопросы
- •5. Политропные процессы изменения состояния идеальных газов
- •5.1. Задачи
- •5.2. Особенности расчета процессов идеальных газов при учете влияния температуры на их изобарную и изохорную теплоемкости
- •5.3. Задачи
- •5.4. Контрольные вопросы
- •6. Термодинамические свойства воды и водяного пара. Процессы водяного пара
- •6.1. Задачи
- •6.2. Контрольные вопросы
- •7. Влажный воздух
- •Основные характеристики влажного воздуха
- •Характеристики атмосферного влажного воздуха
- •Область влажного ненасыщенного воздуха h,d- диаграммы
- •Область перенасыщенного влажного воздуха h,d- диаграммы
- •Пример пользования h,d- диаграммой
- •7.1. Задачи
- •7.2. Контрольные вопросы
- •8. Второй закон термодинамики
- •8.1. Задачи
- •8.2. Контрольные вопросы
- •9. Первый закон термодинамики для потока. Работа изменения давления в потоке. Эксергия в потоке
- •Работа изменения давления в потоке для адиабатных процессов
- •Эксергия в потоке
- •9.1. Задачи
- •9.2. Контрольные вопросы
- •10. Истечение газа и пара через сопловые каналы
- •Особенности расчета процесса истечения через сопло реальных веществ
- •Необратимое истечение газов и паров через сопло
- •Процессы торможения. Параметры заторможенного потока
- •Методика расчета соплового канала при истечении через него газа или пара с начальной скоростью больше нуля
- •10.1. Задачи
- •10.2. Контрольные вопросы
- •11. Дросселирование газов, паров и жидкостей
- •11.1. Задачи
- •11.2. Контрольные вопросы
- •12. Процессы смешения газов и паров
- •Смешение в объёме
- •Смешение в потоке
- •Смешение при заполнении объёма
- •12.1. Задачи
- •12.2. Контрольные вопросы
- •13. Циклы двигателей внутреннего сгорания
- •Цикл двс с подводом теплоты к рабочему телу при постоянном объеме
- •Цикл двс с подводом теплоты к рабочему телу при постоянном давлении
- •Цикл двс со смешанным подводом теплоты к рабочему телу
- •13.1. Задачи
- •13.2. Контрольные вопросы
- •14. Циклы воздушных реактивных двигателей
- •Цикл прямоточного врд
- •Цикл турбокомпрессорного врд
- •14.1. Задачи
- •14.2. Контрольные вопросы
- •15. Циклы газотурбинных установок
- •Методика расчета тепловой экономичности обратимого цикла гту
- •Тепловая экономичность реального цикла гту
- •Регенеративный цикл гту
- •Регенеративный цикл гту с двухступенчатым сжатием и расширением рабочего тела
- •15.1. Задачи
- •15.2. Контрольные вопросы
- •16. Циклы паротурбинных установок
- •16.1. Базовый цикл пту – цикл Ренкина
- •Расчет простого обратимого цикла пту
- •Расчет необратимого цикла простой пту
- •Система кпд цикла пту
- •16.2. Цикл пту с вторичным перегревом пара
- •16.3. Регенеративный цикл пту
- •Выбор оптимальных давлений отборов пара турбины на регенеративные подогреватели пту
- •Особенности расчета регенеративных пту с подогревателями поверхностного типа
- •16.4. Теплофикационные циклы пту
- •Теплофикационные пту с отборами пара на тепловые потребители
- •16.5. Термодинамические особенности расчета циклов аэс на насыщенном водяном паре
- •16.6. Задачи
- •16.7. Контрольные вопросы
- •17. Циклы парогазовых установок
- •17.1. Цикл пгу с котлом-утилизатором
- •17.2. Циклы пгу со сжиганием топлива в паровом котле
- •Цикл пгу с низконапорным парогенератором
- •Цикл пгу с высоконапорным парогенератором
- •Полузависимая пгу
- •17.3. Задачи
- •17.4. Контрольные вопросы
- •18. Циклы холодильных установок и тепловых насосов
- •18.1. Цикл воздушной холодильной установки (вху)
- •Методика расчета вху
- •18.2. Цикл парокомпрессорной холодильной установки
- •Методика расчета цикла пкху
- •18.3. Парокомпрессорный цикл теплового насоса
- •Методика расчета цикла парокомпрессорного теплового насоса
- •18.4. Задачи
- •18.5. Контрольные вопросы
- •Заключение
- •Библиографический список
- •Приложения
- •Оглавление
- •Чухин Иван Михайлович
- •Редактор н.Б. Михалева
- •153003, Г. Иваново, ул. Рабфаковская, 34.
5.2. Особенности расчета процессов идеальных газов при учете влияния температуры на их изобарную и изохорную теплоемкости
В отличие от кинетической теории газов квантовая теория позволяет учесть колебательное движение атомов внутри молекул двух - и многоатомных газов. В соответствии с этой теорией мольная изохорная теплоемкость газа представляет функциональную зависимость от температуры. Уравнения изохорной и изобарной теплоемкостей идеальных газов с учетом влияния температуры на их значения имеют весьма сложный вид, поэтому значения этих теплоемкостей и производных от них энергетических функций состояния u, h, полученные расчетным путем, сводятся в специальные справочные таблицы [12].
В этих таблицах кроме u, h для идеальных газов приводятся значения относительных давлений o=р/po, объемов o=v/vo, которые используются только для адиабатных процессов при нахождении параметров второй точки процесса без использования коэффициента Пуассона по соотношениям
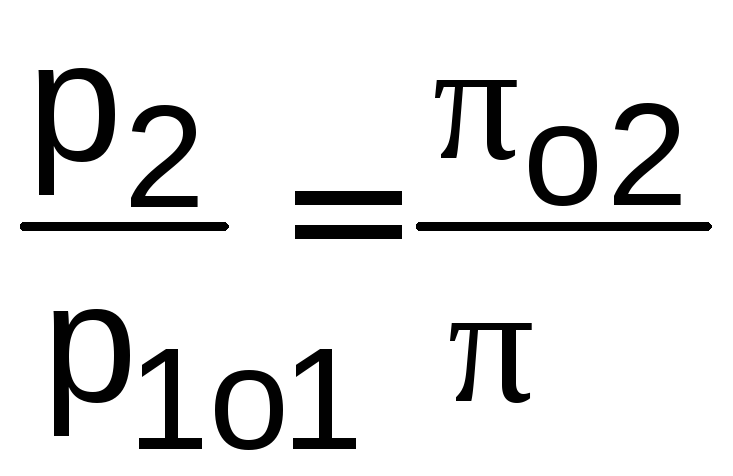 ,
или
,
или
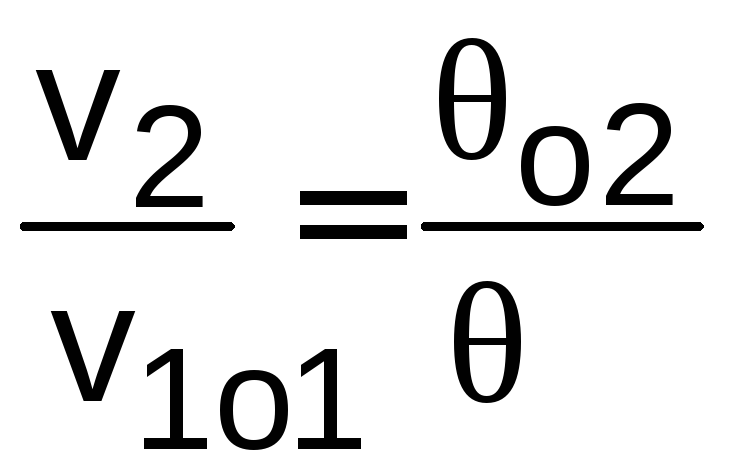 . (5.8)
. (5.8)
Также в этих таблицах дается та часть удельной энтропии идеальных газов, которая зависит от температуры:
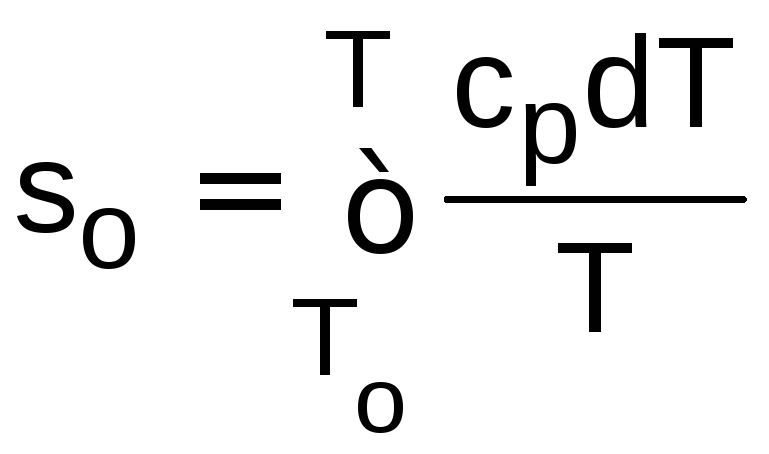 ,
(5.9)
,
(5.9)
где То=0 К .
Вся абсолютная величина удельной энтропии газа рассчитывается по выражению
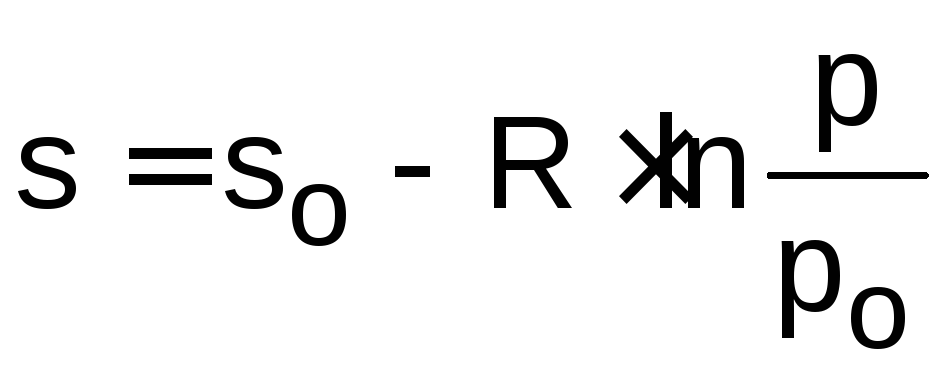 ,
(5.10)
,
(5.10)
где ро принимается произвольно.
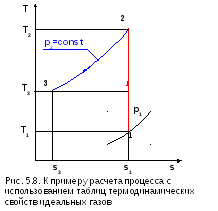
Пример расчета процесса идеальных газов с использованием таблиц [12, 15].
Рассчитать в обратимом процессе 1-2-3 (рис. 5.8) идеального воздуха удельные теплоту и изменение энтропии, считая сv и сp зависящими от температуры. Процесс 1-2 – адиабатное сжатие воздуха от р1=1 бар и t1=17 оС до р2=10 бар, 2-3 – при р2=const от t2 до t3=20 оС.
Решение
Используя таблицы термодинамических свойств воздуха [15], находим 01 по известной температуре t1=17 oC. Определив 01=1,2339, рассчитываем 02 по известному отношению давлений адиабатного процесса:
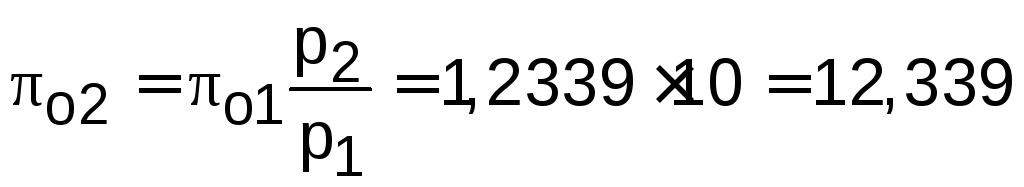 .
.
Используя 02, определяем по таблицам [15] температуру в конце адиабатного процесса t2=283 oC (взято с точностью до 1о).
Зная температуры во всех трех точках сложного процесса, определим по ним из таблиц необходимые для расчета энергетические параметры:
h1=290,28 кДж/кг, u1=207,01 кДж/кг, h2=561,13 кДж/кг,
 u2=401,52
кДж/кг, h3=293,29
кДж/кг, u3=209,16
кДж/кг.
u2=401,52
кДж/кг, h3=293,29
кДж/кг, u3=209,16
кДж/кг.
Для адиабатного процесса 1-2 определим:
![]() кДж/кг,
кДж/кг,
![]() кДж/кг.
кДж/кг.
В изобарном процессе 2-3 количество удельной теплоты рассчитывается как разница его удельных энтальпий:
![]() кДж/кг.
кДж/кг.
Расчет изменения удельной энтропии в процессе 2-3 выполняется с использованием sо2=7,3298 кДж/(кг·К) и sо3=6,6789 кДж/(кг·К), которые определяются по t2 и t3 [15] :
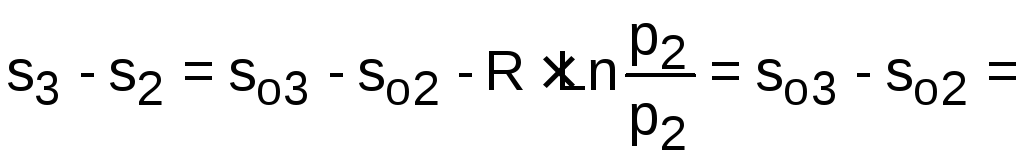
![]()
![]() .
.
Изменение энтропии происходит только за счет изменения температуры, т.к. процесс 2-3 изобарный.
Для определения абсолютных значений энтропий необходимо задаться величиной ро. Приняв ро=1 бар, рассчитаем s1, s2 и s3:

![]() ;
;

![]() .
.
Так как в пределах погрешности расчетов s1=s2, то это подтверждает, что процесс 1-2 адиабатный.

![]() .
.
Проверим ранее полученное значение разности энтропий s3-s2 по разности абсолютных энтропий в этих точках:
![]()
![]() .
.
В этом случае сходимость результатов тоже очевидна.
