
- •Министерство образования и науки Российской Федерации
- •Научный редактор
- •Введение
- •1. Основные термические параметры состояния
- •Удельный объем
- •Давление
- •Соотношения единиц измерения давления
- •Температура
- •1.1. Задачи
- •1.2. Контрольные вопросы
- •2. Законы и уравнения состояния идеальных газов. Смеси идеальных газов
- •2.1. Задачи
- •2.2. Контрольные вопросы
- •3. Теплоемкости газов и газовых смесей
- •3.1. Задачи
- •3.2. Контрольные вопросы
- •4. Первый закон термодинамики для закрытой системы
- •4.1. Задачи
- •4.2. Контрольные вопросы
- •5. Политропные процессы изменения состояния идеальных газов
- •5.1. Задачи
- •5.2. Особенности расчета процессов идеальных газов при учете влияния температуры на их изобарную и изохорную теплоемкости
- •5.3. Задачи
- •5.4. Контрольные вопросы
- •6. Термодинамические свойства воды и водяного пара. Процессы водяного пара
- •6.1. Задачи
- •6.2. Контрольные вопросы
- •7. Влажный воздух
- •Основные характеристики влажного воздуха
- •Характеристики атмосферного влажного воздуха
- •Область влажного ненасыщенного воздуха h,d- диаграммы
- •Область перенасыщенного влажного воздуха h,d- диаграммы
- •Пример пользования h,d- диаграммой
- •7.1. Задачи
- •7.2. Контрольные вопросы
- •8. Второй закон термодинамики
- •8.1. Задачи
- •8.2. Контрольные вопросы
- •9. Первый закон термодинамики для потока. Работа изменения давления в потоке. Эксергия в потоке
- •Работа изменения давления в потоке для адиабатных процессов
- •Эксергия в потоке
- •9.1. Задачи
- •9.2. Контрольные вопросы
- •10. Истечение газа и пара через сопловые каналы
- •Особенности расчета процесса истечения через сопло реальных веществ
- •Необратимое истечение газов и паров через сопло
- •Процессы торможения. Параметры заторможенного потока
- •Методика расчета соплового канала при истечении через него газа или пара с начальной скоростью больше нуля
- •10.1. Задачи
- •10.2. Контрольные вопросы
- •11. Дросселирование газов, паров и жидкостей
- •11.1. Задачи
- •11.2. Контрольные вопросы
- •12. Процессы смешения газов и паров
- •Смешение в объёме
- •Смешение в потоке
- •Смешение при заполнении объёма
- •12.1. Задачи
- •12.2. Контрольные вопросы
- •13. Циклы двигателей внутреннего сгорания
- •Цикл двс с подводом теплоты к рабочему телу при постоянном объеме
- •Цикл двс с подводом теплоты к рабочему телу при постоянном давлении
- •Цикл двс со смешанным подводом теплоты к рабочему телу
- •13.1. Задачи
- •13.2. Контрольные вопросы
- •14. Циклы воздушных реактивных двигателей
- •Цикл прямоточного врд
- •Цикл турбокомпрессорного врд
- •14.1. Задачи
- •14.2. Контрольные вопросы
- •15. Циклы газотурбинных установок
- •Методика расчета тепловой экономичности обратимого цикла гту
- •Тепловая экономичность реального цикла гту
- •Регенеративный цикл гту
- •Регенеративный цикл гту с двухступенчатым сжатием и расширением рабочего тела
- •15.1. Задачи
- •15.2. Контрольные вопросы
- •16. Циклы паротурбинных установок
- •16.1. Базовый цикл пту – цикл Ренкина
- •Расчет простого обратимого цикла пту
- •Расчет необратимого цикла простой пту
- •Система кпд цикла пту
- •16.2. Цикл пту с вторичным перегревом пара
- •16.3. Регенеративный цикл пту
- •Выбор оптимальных давлений отборов пара турбины на регенеративные подогреватели пту
- •Особенности расчета регенеративных пту с подогревателями поверхностного типа
- •16.4. Теплофикационные циклы пту
- •Теплофикационные пту с отборами пара на тепловые потребители
- •16.5. Термодинамические особенности расчета циклов аэс на насыщенном водяном паре
- •16.6. Задачи
- •16.7. Контрольные вопросы
- •17. Циклы парогазовых установок
- •17.1. Цикл пгу с котлом-утилизатором
- •17.2. Циклы пгу со сжиганием топлива в паровом котле
- •Цикл пгу с низконапорным парогенератором
- •Цикл пгу с высоконапорным парогенератором
- •Полузависимая пгу
- •17.3. Задачи
- •17.4. Контрольные вопросы
- •18. Циклы холодильных установок и тепловых насосов
- •18.1. Цикл воздушной холодильной установки (вху)
- •Методика расчета вху
- •18.2. Цикл парокомпрессорной холодильной установки
- •Методика расчета цикла пкху
- •18.3. Парокомпрессорный цикл теплового насоса
- •Методика расчета цикла парокомпрессорного теплового насоса
- •18.4. Задачи
- •18.5. Контрольные вопросы
- •Заключение
- •Библиографический список
- •Приложения
- •Оглавление
- •Чухин Иван Михайлович
- •Редактор н.Б. Михалева
- •153003, Г. Иваново, ул. Рабфаковская, 34.
12.1. Задачи
Смешение в объеме
Пример решения задачи:
12.1. В объеме адиабатно смешиваются два идеальных газа: кислород (О2) и водород (Н2). Кислород до смешения занимал объем V1=0,5 м3 при р1=2 бар, t1=20 оС. Водород до смешения занимал объем V2=1,5 м3 при р2=4 бар, t2=80 оС. Определить параметры смеси: tсм, рсм , изменение энтропии системы за счет необратимости процесса смешения и потерю эксергии при температуре внешней среды 20 оС. Считать постоянными теплоемкости газов сv и ср.
Решение
1) Определяем массы газов и их массовые доли:
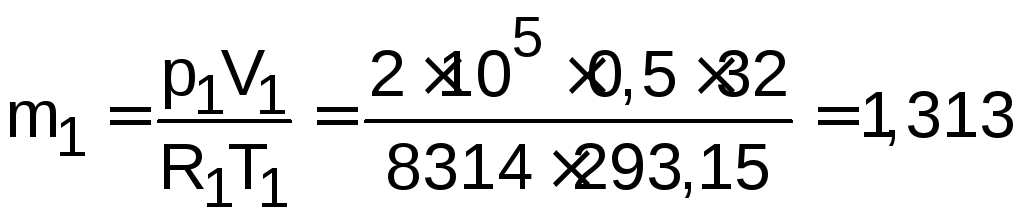 кг
;
кг
;
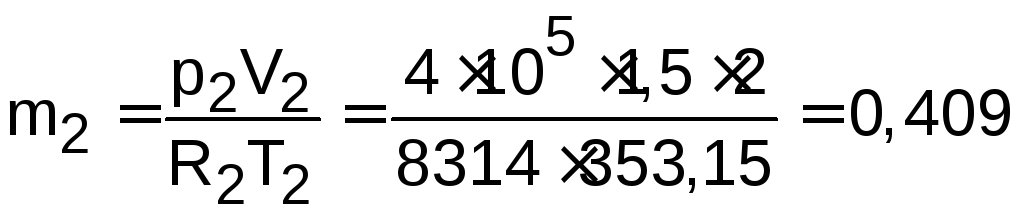 кг
;
кг
;
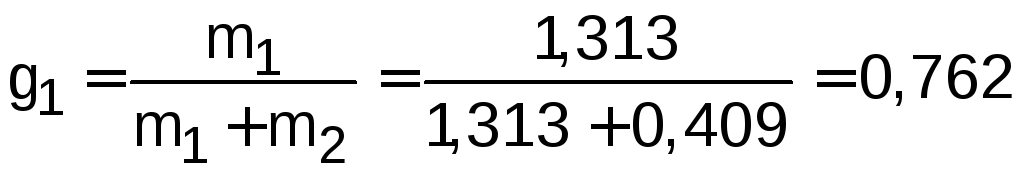 ;
;
![]() .
.
2) Определяем удельные массовые изохорные теплоемкости газов:
![]() ;
;
![]() .
.
3) Определяем температуру смеси газов:
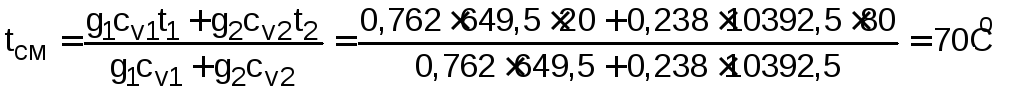 .
.
4) Определяем газовую постоянную и давление смеси газов:
![]() ;
;
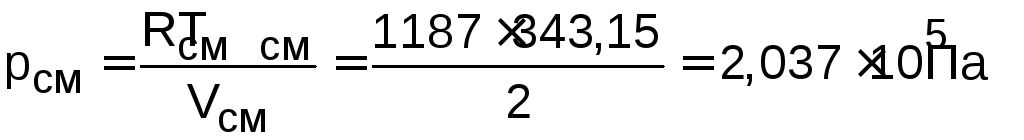 .
.
5) Определяем парциальные давления компонентов смеси газов и увеличения энтропии системы за счет необратимости адиабатного процесса смешения газов:
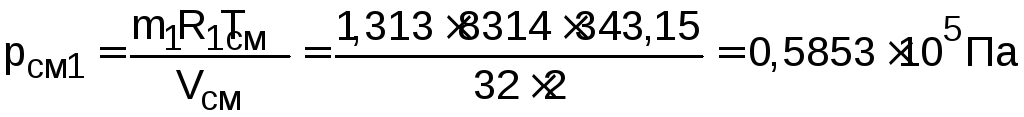 ;
;
![]() ;
;
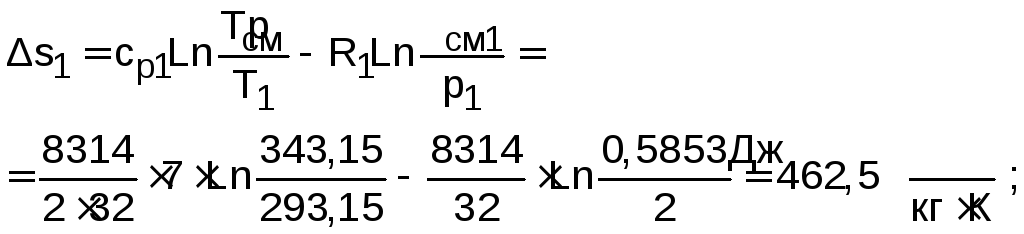
 ;
;
![]() .
.
12.2. В объеме адиабатно смешиваются два идеальных газа: двухатомный с 1=28 кг/кмоль и трехатомный с 2=17 кг/кмоль. Количество и параметры газов: m1=2 кг, р1=6 бар, t1=20 оС, m2=3 кг, р2=2 бара, t2=250 оС. Определить давление и температуру смеси газов. Считать постоянными теплоемкости газов сv и ср.
Ответ: рсм=2,29 бар, tсм=192 оС.
12.3. В объеме V=1 м3=сonst, разделенном пополам перегородкой (V1=V2), находятся идеальные газы: в одной половине азот N2 при р1=1 бар и t1=300 оС, в другой – двуокись углерода СО2 при р2=3 бар и t2=200 оС. Определить параметры смеси рсм, tсм, vсм, получившиеся после того, как перегородку убрали. Считать процесс смешения газов адиабатным, а теплоемкости газов сv и ср, постоянными.
Ответ: рсм=1,99 бар, tсм=218,7 оС, vсм=0,507 м3/кг.
12.4. В объеме смешиваются два газа: метан (СН4) и азот (N2). Задано: для метана m1=3 кг, р1=5 бар, t1=20 оС; для азота m2=7 кг, р2=3 бар, t2=90 оС. Считая газы идеальными с жесткими молекулами, а смешение адиабатным, определить параметры смеси tсм , рсм , vсм, изменение энтропии системы за счет необратимости процесса смешения и потерю эксергии газов при температуре внешней среды 20 оС.
Ответ: tсм=56,8 оС, рсм=3,5 бар, vсм=0,343 м3/кг ;
Sс=2,66 кДж/К, E = 780 кДж.
12.5. В объеме V=1 м3=сonst, разделенном пополам перегородкой (V1=V2), находится водяной пар с параметрами: 1-й – р1=10 бар и t1=300 оС, 2-й – с р2=1 бар и х2=0,95. Перегородку убрали, и произошло адиабатное смешение пара в постоянном объеме. Определить параметры пара после смешения и увеличение энтропии системы.
Ответ: рсм=5,45 бар, tсм=261 оС, Sc=0,3567 кДж/К.
12.6. В объеме смешиваются два газа: кислород (О2) и азот (N2). Задано: для кислорода р1=2 бар, t1=47 оС; для азота р2=5 бар, t2=127 оС. После смешения температура газов стала tсм=80 оС. Считая газы идеальными с жесткими молекулами, а смешение адиабатным, определить давление смеси и потерю эксергии на 1 кг смеси при температуре внешней среды 20 оС.
Ответ: рсм=2,84 бар, е=0,204 кДж/кг.
Смешение в потоке
12.7. В потоке адиабатно смешиваются два идеальных газа: кислород O2 с параметрами р1=3 бар и t1=30 оС и двуокись углерода CО2 с параметрами р2=2 бар и t2=200 оС (рис. 12.4). Массовые расходы газов: G1=2 кг/с, G2=3 кг/с. После смешения давление газов рсм=1,5 бар. Определить температуру, удельный объем смеси газов, а также увеличение энтропии системы Sc.
С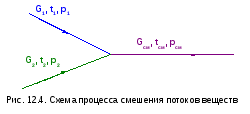 читать
постоянными теплоемкости газов сv
и ср.
читать
постоянными теплоемкости газов сv
и ср.
Ответ: tсм=124,3 оС, vсм=0,576 м3/кг, Sc=0,621 кВт/К.
12.8. Два трубопровода водяного пара от двух котлов с параметрами р1=25 бар, х1=0,98 и р2=20 бар, t2=350 оС объединяются в общий трубопровод. Массовая производительность первого котла в два раза больше производительности второго котла (G1/G2=2). Давление пара после смешения pсм=20 бар. Определить параметры пара после адиабатного его смешения: hсм , tсм , sсм и потерю удельной эксергии пара на 1 кг смеси при температуре внешней среды 20 оС.
Ответ: hсм=2888 кДж/кг, tсм=245 °С, sсм=6,52 кДж/(кг∙К), е=23,7 кДж/кг.
12.9. Происходит адиабатное смешение двух потоков идеальных газов: метан CH4 с t1=-5 оС и р1=30 бар и кислород O2 с t2=30 оС и р2=30 бар. Соотношение массовых расходов газов G1:G2=1:4. Давление газа после смешения рсм=30 бар.
Считая постоянными теплоемкости газов сv и ср, определить температуру смеси газов и возрастание энтропии системы за счет необратимости процесса смешения в расчете на 1 кг смеси.
Ответ: tсм=17,3 оС, sc=0,20 кДж/(кгК).
12.10. В трубопроводах адиабатно смешиваются два потока водяного пара (рис.12.4): 1-й – с р1=40 бар и t1=370 оС, 2-й – с р2=1 бар и х2=0,95. Соотношение расходов G1:G2=2:3, давление пара после смешения 1 бар.
Определить температуру смеси и возрастание энтропии системы за счет необратимости процесса смешения в расчете на 1 кг смеси.
Ответ: tсм =160 оС, sc=0,756 кДж/(кгК).
12.11. В коллекторе смешиваются 3 потока водяного пара (рис. 12.5) с параметрами: р1=30 бар и t1=400 оС, р2=27 бар и х2=0,97, р3=25 бар. Из коллектора пар уходит с параметрами рсм=25 бар, tсм=300 оС. Массовые расходы газов: G1=12 кг/с , G2=8 кг/с, G3=10 кг/с. Определить температуру третьего потока t3 и увеличение энтропии системы Sc , считая процесс смешения адиабатным.
О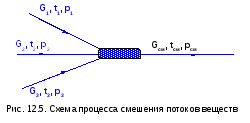 твет:t3=280
оС,
Sc=7,74
кВт/К.
твет:t3=280
оС,
Sc=7,74
кВт/К.
Смешение при заполнении объема
12.12. При заполнении из магистрали с параметрами р2=20 бар и t2=30 оС идеальным газом СH4 баллона объемом 10 м3 , содержащим тот же газ с параметрами р1=10 бар и t1=20 оС, в него поступило 25 кг газа (рис 12.6).
Определить температуру и давление газа в баллоне после его заполнения, считая постоянными теплоемкости газа сv и ср , а процесс смешения адиабатным.
Ответ: tсм=50,5 оС, рсм=15,3 бар.
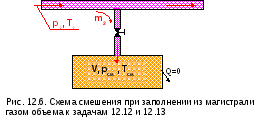
12.13. В баллоне емкостью 0,15 м3 находится азот (N2) при р1=5 бар, t1=20 оС (рис.12.6). Из магистрали баллон заполняется азотом с р2=100 бар и t2=30 оС до тех пор, пока давление в нем не повысится до рсм=80 бар.
Считая азот идеальным газом с постоянными теплоемкостями сv и ср, а процесс смешения адиабатным, определить температуру азота в баллоне, количество азота, поступившего в баллон из магистрали, и общее количество азота в баллоне после его заполнения.
Ответ: tсм=140 оС, m2=8,93 кг, mсм=9,79 кг.
12.14. Из магистрали с идеальным газом СН4 при р1=10 бар, t1=30 оС метан подается в баллон емкостью \/=1 м3 с давлением р2=1 бap и температурой t2=17 оC, где находится тоже метан.
Определить температуру газа после заполнения баллона, если его туда поступило 2,6 кг. Считать теплоемкости сv и ср метана постоянными, а процесс смешения адиабатным.
Ответ: tсм=107,7 оС.
12.15. В баллон емкостью 2 м3, где находится идеальный воздух (=28,96 кг/кмоль) при р2=2 бар и t2=tос=17 оС, из магистрали поступает идеальный кислород (О2) с давлением р1=10 бар и температурой t1=27 оС до увеличения давления газа в баллоне рсм=8 бар.
Определить потерю эксергии Е в этом необратимом процессе. Считать теплоемкости газов сv и ср постоянными, а процесс смешения адиабатным.
Ответ: Е=688 кДж.
12.16. Адиабатно смешиваются два потока водяного пара (рис. 12.7) с параметрами: р1=50 бар и t1=400 оС, р2=30 бар и х2=0,8. Массовые расходы пара G1=2 кг/с , G2=3 кг/с. После смешения давление пара pсм=20 бар. Затем пар адиабатно дросселируется до состояния сухого насыщенного пара (х=1) и поступает в сопло, где он адиабатно расширяется до давления рк=0,05 бар. Необратимость истечения через сопло характеризует коэффициент потерь сопла =0,1.
Определить температуру пара после смешения tсм и за дроссельным клапаном tо, а также параметры пара на выходе из сопла hкi, sкi .
О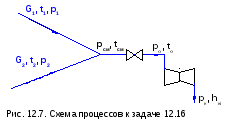 твет:tсм=212
оС,
tо=150
оС,
hкi=2150
кДж/кг, sкi=7,05
кДж/(кгК).
твет:tсм=212
оС,
tо=150
оС,
hкi=2150
кДж/кг, sкi=7,05
кДж/(кгК).
