
Материаловедение
.pdf
4.1. Фазовые равновесия в полупроводниковых системах |
151 |
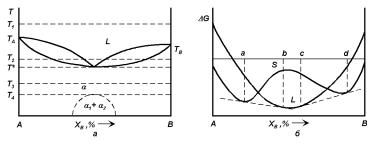
Рис. 4.6. а — Диаграмма состояния бинарной системы с неограниченной растворимостью компонентов друг в друге и максимумом температуры плавления. б — Зависимости термодинамического потенциала твердых и жидких растворов от состава при некоторой температуре T2 такой, что T > T2 > Tпл(A).
кого и твердого раствора от состава будут пересекаться в двух точках (рис. 4.6,б) и в интервале концентраций между точками пересечения сродство компонентов A и B в твердом состоянии проявляется сильнее, чем в жидком |∆H(L)| < |∆H(S)|; при Tпл(B) < T < Tпл(A) кривые ∆G для жидкого и твердого растворов пересекаются только в одной точке во всем интервале концентраций; а при температурах T3 < Tпл(B) кривая ∆G(S) расположена ниже, чем ∆G(L) во всем интервале концентраций, то на диаграмме состояния линии ликвидуса и солидуса примут вид кривых с общим максимумом (рис. 4.6,а).
С ростом абсолютной величины отрицательной по знаку ∆H(S) будет усиливаться тенденция к упорядочению твердого раствора. При высоких температурах этой тенденции будет препятствовать энтропийный вклад в ∆G(S) (Sнеуп.с > Sуп.с). Следовательно, упорядочение будет проявляться, как правило, только при относительно низких температурах. Это означает, что должна существовать некоторая равновесная температура TК, при которой термодинамические потенциалы упорядоченного и неупорядоченного твердого раствора равны Gуп.с = Gнеуп.с. При температурах выше TК твердый раствор неупорядочен, а при T < TК — упорядочен.
Упорядочение сопровождается резким изменением свойств твердого раствора, например, значительным изменением электро- и теплопроводности, пластичности и т. д. Процесс упорядочения является диффузионным процессом (превращение сопровождается перемещением атомов), поэтому медленное охлаждение способствует упорядочению. Температу-
152 Глава 4. Фазовые равновесия и элементы теории образования фаз
ра TК тем выше, чем больше |∆H| = |Hуп.с − Hнеуп.с|. Выигрыш в энергии при упорядочении чаще всего связан с уменьшением энергии упругих искажений решетки твердого раствора, которое пропорционально квадрату ∆R [17], то есть TК тем выше, чем больше ∆R. Но чем выше TК, тем больше диффузионная подвижность и, следовательно, выше вероятность достижения равновесного упорядоченного состояния. Поэтому в тех случаях, когда ∆R велико, TК высока и упорядочение достигается легко; в тех же случаях, когда ∆R мало, TК низка и по кинетическим причинам упорядочение может не реализоваться или реализоваться лишь частично.
Степень упорядочения твердого раствора определяется отклонением числа ближайших соседей от предсказываемого теорией вероятности. Например, если твердый раствор B в A содержит 25 ат.% B, то первая (и любая другая) координационная сфера при отсутствии упорядочения должна содержать в среднем 75% атомов A и 25% атомов B. Если же атомы A окажутся окруженными в первой координационной сфере атомами B более чем на 25%, то твердый раствор будет упорядочиваться; если же более чем 75% соседей будут атомами A, то будет существовать тенденция к расслоение (или оно наступит) твердого раствора на две фазы. Таким образом, в твердых растворах возможно различное упорядочение в расположении атомов. В неупорядоченных твердых растворах замещения атомы разного сорта произвольно распределены в узлах кристаллической решетки, то есть отсутствует дальний и ближний порядок.
Втвердых растворах замещения с ближним порядком есть корреляция в расположении атомов разного сорта в области с конечным радиусом.
Втвердых растворах внедрения атомы одного компонента образуют регулярную кристаллическую решетку, атомы другого сорта беспорядочно распределены в междоузлиях этой решетки. В упорядоченном твердом растворе атомы компонентов образуют несколько вставленных друг в друга кристаллических подрешеток.
Степень упорядочения может быть оценена количественно с помощью дифракционных методов исследования.
Количественными критериями степени упорядочения служат параметры дальнего и ближнего порядка. Если в кристаллической решетке твердого раствора (бинарного) определенные узлы решетки заполняются преимущественно атомами определенного сорта (в этом случае распределение атомов разного сорта по узлам кристаллической решетки, существующее в одной из элементарных ячеек твердого раствора, повторяется во всех элементарных ячейках данного кристаллического блока), то возникающее распределение атомов называют дальним порядком. Дальний порядок — это корреляция в расположении атомов на макроскопических расстояниях. Под степенью (параметром) дальнего порядка η понимают величину
η = p − q, |
(4.5) |
4.1. Фазовые равновесия в полупроводниковых системах |
153 |
где p — доля атомов сорта A, занимающих «правильные» положения в решетке, q — доля атомов того же сорта, занимающих «неправильные» положения в кристаллической решетке. Если η = 1, то твердый раствор полностью упорядочен (все «правильные» положения заняты правильно); если η = 0, то твердый раствор неупорядочен (нахождение атомов в «правильных» и «неправильных» позициях равновероятно).
Однако степень дальнего порядка не полностью определяет характер взаимного расположения атомов по узлам кристаллической решетки. Энергия взаимодействия между разными парами атомов, вообще говоря, различна, и поэтому каждый атом стремится окружить себя либо атомами другого сорта, либо одноименными атомами, причем при этом в твердом растворе может и не существовать дальнего порядка. Наличие корреляции в расположении атомов на расстояниях порядка нескольких межатомных расстояний называется ближним порядком. Только в простейших случаях ближний порядок распространяется на одну-две координационные сферы. Как правило, корреляция ощущается и на более далеких расстояниях. Степенью (параметром) ближнего порядка для i-й координационной сферы в неупорядоченных твердых растворах называют величину
где NAB |
αi = 1 − NiAB/NcAcBci = 1 − piAB/cB, |
(4.6) |
— число пар атомов A и B, находящихся на расстоянии ri |
один от другого, |
|
i |
|
|
NcAcBci — число пар атомов A и B, которые находились бы на этом расстоянии при полностью случайном распределении по узлам решетки, N — общее число атомов, cA и cB — концентрации атомов сорта A и B, ci — число узлов в i-й координационной сфере, pABi — вероятность нахождения атома B около атома A, расположенного в начале координат, на i-сфере. Из этого определения параметра ближнего порядка следует, что α1 < 0, если ближайшими соседями являются разноименные атомы, и α1 > 0, если ближайшие соседи — атомы одного сорта. Если α1 = 1, то сплав находится в состоянии расслоения, то есть представляет собой механическую смесь. При полном отсутствии ближнего порядка все
αi = 0
Параметры αi связаны с характером распределения атомов при дальнем порядке, и эта связь позволяет ввести понятие о сверхструктуре (полностью упорядоченном твердом растворе). Действительно, при появлении дальнего порядка атомы разных сортов занимают определенные места в кристаллической решетке. Поэтому спектр параметров αi, очевидно, должен в какой-то мере определять тип дальнего порядка. Эта связь проявляется в том, что зависимость параметров α(ri) от радиуса координационной сферы оказывается различной для разных типов упорядочения, и это дает возможность по виду α(ri) определять сверхструктуру.
Следует заметить, что для полупроводниковых систем появление сверхструктур не так характерно, как для металлических систем. Поэтому для простоты в качестве примера упорядоченных твердых растворов приведем упорядоченные твердые растворы в системе Fe–Al. В этой системе образуются две упорядоченные фазы (сверхструктуры) при 25% и 50% Al, отвечающие формулам Fe3Al и FeAl. В неупорядоченном состоянии твердый раствор имеет о.ц.к. решетку со случайным распределением атомов по узлам кристаллической решетки. Вероятность наличия в данном узле решетки того или иного атома зависит от концентрации сплава. В упорядоченной фазе FeAl атомы Al располагаются в центрах всех малых кубов, как в решетке типа CsCl. Элементарная ячейка, как и в неупорядоченном растворе, равна малой о.ц.к. ячейке. В упорядоченной фазе Fe3Al атомы Al занимают только центры четырех из восьми малых ячеек большого куба; центры остальных четырех малых ячеек остаются вакантными. Теперь элементарной будет уже не маленькая о.ц.к. ячейка, а большой куб, состоящий из восьми малых. Если определить αi по формуле (4.6) для первых восьми координационных сфер, то окажется, что зависимость параметров α(ri) от радиуса координационной сферы (последовательность значений α(ri) для разных ri) различна для разных типов упорядочения [36].
154Глава 4. Фазовые равновесия и элементы теории образования фаз
Сувеличением абсолютной величины отрицательной по знаку ∆H(S) температура перехода TК в упорядоченное состояние будет повышаться, но тип решетки твердого раствора, образующегося при T < TК, будет такой же, что и твердого раствора, образующегося при T > TК, то есть будет сохраняться, хотя периоды решетки могут изменяться (см. пример Fe–Al). Лишь в некоторых случаях может происходить незначительное
искажение решетки. Наконец, при очень большой отрицательной величине ∆H(S) сильное химическое сродство может привести к образованию химического соединения со своей решеткой, отличающейся от решетки твердого раствора, уже при температуре кристаллизации. Таким образом, упорядоченные твердые растворы являются промежуточными фазами между химическими соединениями и твердыми растворами. При полном упорядочении твердые растворы напоминают химические соединения, потому что у них: а) соотношение чисел атомов компонентов фазы строго определенное: то есть соответствует стехиометрической пропорции, что может быть выражено формулой; б) расположение атомов в решетке упорядоченное. Однако упорядоченные твердые растворы могут быть причислены и к твердым растворам, так как у них сохранилась решетка растворителя.
3.Если силы химической связи разнородных атомов слабы и велика разница в размерах атомов взаимодействующих компонентов, то есть
велика энергия упругой деформации при образовании твердого раствора, то в этом случае ∆H — величина положительная. Пусть ∆H(L) > 0
и ∆H(S) > 0, тогда, если при температуре T1 > Tпл(A) кривая ∆G(L) расположена ниже, чем ∆G(S) во всем интервале концентраций; при Tпл(B) < T < Tпл(A) кривые ∆G для жидкого и твердого растворов пересекаются только в одной точке во всем интервале концентраций; но в интервале температур T < T2 < Tпл(B) кривые ∆G для жидкого и твердого растворов так же, как в предыдущем случае, пересекаются в
двух точках (рис. 4.7,б) и в интервале концентраций между точками пересечения затруднено образование твердого раствора ∆H(S) > ∆H(L); и при T3 < T кривая ∆G(S) расположена ниже, чем ∆G(L) во всем интервале концентраций, то линии ликвидуса и солидуса будут иметь общий минимум (рис. 4.7,а).
Сувеличением величины положительного ∆H(S) образование связей A–A и B–B будет более выгодным по сравнению с образованием связей A–B, то есть будет проявляться тенденция к распаду твердого раствора и образованию механической смеси. При высоких температурах, близких к температуре, при которой линии ликвидуса и солидуса имеют общий минимум, этой тенденции препятствует энтропийный вклад в
4.1. Фазовые равновесия в полупроводниковых системах |
155 |
Рис. 4.7. а — Диаграмма состояния бинарной системы с неограниченной растворимостью компонентов друг в друге и минимумом температуры плавления. б — Зависимости термодинамического потенциала твердых и жидких растворов от состава при некоторой температуре T2 такой, что T < T2 < Tпл(B).
∆G(S), так как Sтв.р > Sм.с. Сплавы поэтому будут кристаллизоваться в виде твердых растворов, но при более низких температурах твердый раствор может начать распадаться, превращаясь в механическую смесь твердых растворов меньшей концентрации (α1 + α2). Таким образом, при ∆H > 0 при высоких температурах Gтв.р < Gм.с, а при низких температурах Gтв.р > Gм.с, и должна существовать некоторая температура T4, при которой Gтв.р = Gм.с. Если ∆H(S) невелико, то эта температура низкая и распад твердого раствора не происходит. Однако с ростом ∆H(S) эта температура увеличивается, а температура общего минимума линий ликвидуса и солидуса одновременно понижается до тех пор, пока их значения не совпадут. Такая тенденция приведет к преобразованию диаграммы состояния из диаграммы состояния с неограниченной растворимостью компонентов друг в друге в диаграмму состояния с эвтектическим превращением, на которой уже при температуре кристаллизации жидкой фазы будет образовываться двухфазная смесь.
Диаграммы состояния систем с ограниченной растворимостью компонентов
Диаграммы состояния с эвтектическим превращением. Рассмотрим более подробно диаграмму с эвтектическим превращением (рис. 4.8). Она состоит из шести фазовых областей: области жидкой фазы L, двух двухфазных областей (жидкая фаза L + твердый раствор α и жидкая фаза L + твердый раствор β), двух однофазных областей твердых растворов α и β и двухфазной области сосуществования твердых растворов α + β.
Линиями A e и B e на диаграмме обозначены линии ликвидуса. Ли-

156 Глава 4. Фазовые равновесия и элементы теории образования фаз
Рис. 4.8. Диаграмма состояния бинарной системы, образующей твердые растворы с эвтектикой.
нии A c и B d — линии солидуса при температурах, превышающих эвтектическую температуру Te. Горизонтальная эвтектическая линия ced является линией солидуса, но не отвечает реально существующим фазам за исключением трех точек: c (эвтектическое превращение твердого раствора α), d (эвтектическое превращение твердого раствора β) и e (эвтектическое превращение жидкой фазы). Особенность этой линии состоит в том, что при соответствующей ей температуре Te в сплавах состава от c до d в равновесии находятся три фазы: L + α + β. Линии ac и bd — это линии твердых растворов предельной концентрации (ac — B в A, а bd — A в B), существующих при температурах ниже эвтектической.
При охлаждении сплавов составов от 0 до c мы сначала проходим двухфазную область L + α, а затем получаем однофазный твердый раствор α. При дальнейшем охлаждении мы можем либо сохранить однофазный твердый раствор α, либо, в случае пересечения линии ac, получить двухфазную смесь α + β, так как в точке пересечения сплав находится в состоянии предельно насыщенного раствора, а ниже начинается его распад с выделением фазы β. Во втором случае при дальнейшем охлаждении сплава в пределах двухфазной области одновременно изменяются как состав обеих фаз, так и их количественное соотношение. Состав фаз характеризуют точки пересечения горизонтальных линий с линиями ac и bd, ограничивающими двухфазную область; количественное соотношение фаз определяется правилом рычага. Кристаллизация сплавов составов от d до B происходит аналогично.
При охлаждении сплавов составов от c до d при температуре Te (окончание кристаллизации) происходит распад жидкости состава e на два твердых раствора α и β с составами c и d по эвтектической реакции L → α + β. При дальнейшем охлаждении сплавов изменяется состав
4.1. Фазовые равновесия в полупроводниковых системах |
157 |
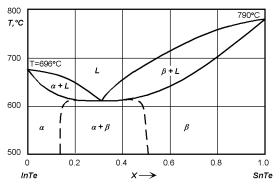
Рис. 4.9. Диаграмма состояния системы InTe–SnTe.
каждого твердого раствора α и β по кривым ac и bd соответственно, а количественное соотношение фаз определяется правилом рычага.
Основными особенностями диаграмм эвтектического типа являются: 1) уменьшение температуры плавления твердого раствора как со стороны компонента A, так и со стороны компонента B при их растворении друг в друге; 2) наличие эвтектического превращения, заключающегося в распаде жидкости при охлаждении на две твердые фазы.
Диаграммы эвтектического типа наблюдаются, например, в системах InTe–SnTe (рис. 4.9) и Si–Au (рис. 4.3).
Диаграммы состояния с перитектическим превращением. Если температура плавления твердых растворов уменьшается со стороны компонента A (или B), а со стороны компонента B (или A) повышается при их ограниченной растворимости друг в друге, то возможно перитектическое превращение, которое представляет собой процесс образования фазы за счет взаимодействия двух других, полностью или частично исчезающих при этом (жидкость реагирует с ранее выпавшими кристаллами и образует новый вид кристаллов): L + α → β. Реакция подобного типа называется перитектической.
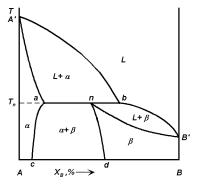
Рассмотрим диаграмму состояния с перитектическим превращением (рис. 4.10). Линия A bB — линия ликвидуса; линии A a и nB — линии солидуса; линии ac и nd — линии твердых растворов предельной концентрации, существующих при температурах ниже перитектической температуры Tп. При температуре Tп в равновесии находятся три фазы: жидкая и две твердые фазы — L + α + β. Горизонтальная линия ab на-
158 Глава 4. Фазовые равновесия и элементы теории образования фаз
Рис. 4.10. Диаграмма состояния бинарной системы, образующей твердые растворы с перитектикой.
зывается перитектической горизонталью и ее точки не отвечают реально существующим фазам (как и на эвтектической горизонтали), кроме трех точек a, n и b.
При охлаждении сплавов составов от 0 до a кристаллизация происходит аналогично кристаллизации сплавов составов от 0 до c на диаграмме состояния с эвтектическим превращением.
При охлаждении сплавов, составы которых лежат в интервале от a до n, количество жидкой фазы при температуре Tп недостаточно для того, чтобы произошло взаимодействие со всей твердой фазой α. В итоге после перитектического превращения, кроме новой фазы β, сплавы будут содержать и избыточное количество кристаллов фазы α. При Tп состав жидкой фазы будет отвечать точке b (точка перитектического превращения жидкости), а состав кристаллов — точке a (точка перитектического превращения твердого раствора α). Эти обе фазы реагируют и дают третью фазу β, состав которой определяется точкой n (точка перитектического превращения твердого раствора β). Количественное соотношение фаз, участвующих в перитектической реакции, определяется правилом рычага. При дальнейшем охлаждении сплавы представляют собой механическую смесь твердых растворов α + β, составы которых изменяются по кривым ac и nd соответственно, а количественное соотношение фаз определяется правилом рычага.
Аналогично для сплавов, составы которых лежат в интервале от n до b, количество фазы α при Tп мало по сравнению с количеством жидкой фазы. В результате перитектического превращения мы получим двухфазную систему L + β. При дальнейшем понижении температуры состав жидкой фазы изменяется по линии bB , а состав образующихся кристаллов — по nB . Количественное соотношение фаз определяется правилом
4.1. Фазовые равновесия в полупроводниковых системах |
159 |
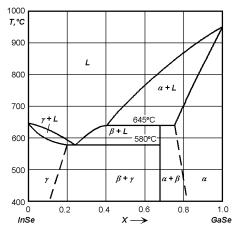
Рис. 4.11. Диаграмма состояния системы InSe–GaSe.
рычага. Важной особенностью системы с перитектикой является то, что при температуре Tп кристаллизация ряда составов сплава завершается не полностью. Для сплавов состава от n до b кристаллизация завершается на линии nB при температурах ниже Tп и при этом образуется твердый раствор β.
Подобного типа диаграммы состояния редко встречаются в полупроводниковых системах, тем не менее, примером может служить система InSe–GaSe (рис. 4.11). По перитектической реакции в этой системе образуется β фаза (InGa2Se3).
Диаграммы состояния с химическими соединениями. В соответствии со сказанным выше при сильном химическом сродстве компонентов системы их взаимодействие приводит к образованию химического соединения. Диаграммы состояния с химическими соединениями различают по двум признакам: 1) по соотношению составов соединения и жидкой фазы, образующейся при плавлении этого соединения; 2) по способности соединения растворять в себе другие компоненты, в том числе и составляющие данное соединение, то есть по ширине области гомогенности (по величине области концентраций, в которой может существовать соединение, сохраняя свою однофазность).
1. Конгруэнтно и инконгруэнтно плавящиеся соединения. Соединения, для которых составы соединения и жидкой фазы, образующейся при плавлении этого соединения, совпадают, называются конгруэнтно плавящимися. Температура плавления таких соединений лежит на ли-
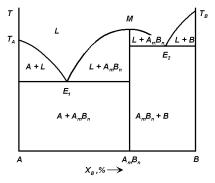
160 Глава 4. Фазовые равновесия и элементы теории образования фаз
Рис. 4.12. Диаграмма состояния системы с одним конгруэнтно плавящимся соединением.
нии ликвидуса, а сама линия имеет вид кривой с максимумом (точка M), который в первом приближении соответствует составу соединения (рис. 4.12). В простейшем случае двухкомпонентной системы (компоненты системы A и B), в которой образуется только одно химическое соединение AmBn и твердые растворы отсутствуют, диаграмму состояния можно рассматривать как двойную систему: химическое соединение рассматривается как отдельный компонент, объединяющий две самостоятельные фазовые диаграммы с эвтектиками (на диаграмме состояния имеются две эвтектические точки E1 и E2):
A + AmBn и AmBn + B.
Например, система InAs может быть разделена на системы In–InAs и InAs–As (рис. 4.13). Кристаллизация сплавов на этой диаграмме происходит совершенно аналогично кристаллизации сплавов, образующих механическую смесь кристаллов «чистых» компонентов. Отличие состоит только в том, что, кроме выделения кристаллов «чистых» компонентов A и B, происходит еще образование кристаллов химического соединения AmBn.
Если же соединение способно давать ограниченные твердые растворы с компонентами фазовой диаграммы (в случае полупроводниковых соединений растворимость в них компонентов соединения, как правило, очень невелика), то диаграмма состояния системы будет иметь вид, представленный на рис. 4.14. На этом рисунке изображены α и β твердые растворы на основе «чистых» компонентов A и B и γ твердый раствор на основе химического соединения AmBn.
В другом случае, когда составы жидкой и твердой фаз при плавлении не совпадают, соединения называются инконгруэнтно плавящими-
