
Материаловедение
.pdf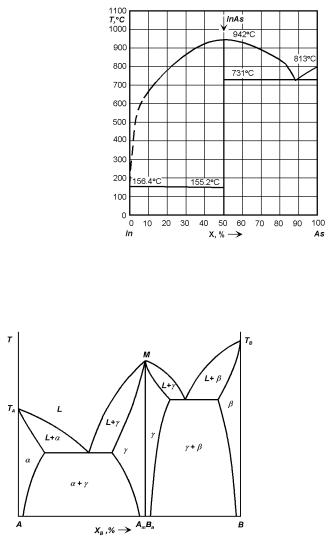
4.1. Фазовые равновесия в полупроводниковых системах |
161 |
Рис. 4.13. Диаграмма состояния системы In–As с конгруэнтно плавящимся соединением InAs.
Рис. 4.14. Диаграмма состояния системы с одним конгруэнтно плавящимся соединением и ограниченными твердыми растворами с эвтектиками.
162 Глава 4. Фазовые равновесия и элементы теории образования фаз
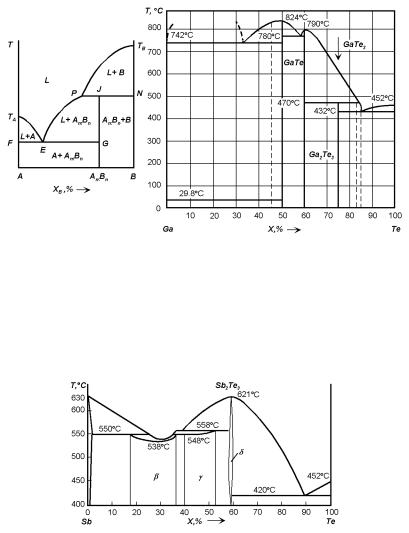
ся. Инконгруэнтно плавящиеся соединения характеризуются тем, что при плавлении твердая фаза превращается в две фазы — жидкую и твердую, составы которых лежат по обе стороны состава исходного соединения (соединение AmBn (точка J) и соединение GaTe3 на рис. 4.15,а,б). Плавление инконгруэнтно плавящихся соединений идет как превращение перитектического типа, но плавится не новый твердый раствор, как при перитектической реакции, а химическое соединение. Температура плавления соединения при этом лежит ниже линии ликвидуса, в результате чего последняя не имеет максимума, связанного с соединением.
2. Ширина области гомогенности. Существуют соединения с широкой областью гомогенности (единицы–десятки атомных процентов), например, соединение Sb2Te3 в системе Sb–Te (рис. 4.16). Существуют соединения с узкой областью гомогенности (сотые и тысячные доли процентов), например, соединение InAs в системе In–As (рис. 4.13). Полупроводниковые соединения группы AIVBVI занимают промежуточное положение. Для них характерна ширина области гомогенности порядка 0.1 ат.%.
4.1.3. Кристаллизация в неравновесных условиях
Все, что до сих пор говорилось о фазовых превращениях, относилось к равновесным при данной температуре состояниям, то есть предполагалось, что скорость изменения температуры так мала, что при каждой температуре в системе успевает установиться равновесие. Однако установление равновесия в системе, осуществляемое путем диффузии, требует времени, продолжительность которого зависит от природы диффундирующих элементов, среды, температуры, размера и степени совершенства кристаллов и других факторов. В реальных условиях время, необходимое для достижения равновесия, может изменяться от долей секунд до многих сотен часов. Кроме того, как отмечалось в начале главы, фазовое превращение при температуре фазового равновесия невозможно, так как в этом случае нет энергетического выигрыша, стимулирующего это превращение. Поэтому равновесную диаграмму состояния следует рассматривать как предельный случай, при котором скорость изменения температуры настолько мала, что фазовое превращение совершается с бесконечно малой скоростью. Тем не менее, этот предельный случай крайне важен для изучения реальных условий кристаллизации.
Если скорость изменения температуры невелика, то есть если превращение происходит в условиях малых переохлаждений (в условиях близких к равновесным), то в этих случаях можно пренебречь небольшой
4.1. Фазовые равновесия в полупроводниковых системах |
163 |
Рис. 4.15. а — Диаграмма состояния системы с инконгруэнтно плавящимся соединением. б — Диаграмма состояния системы Ga–Te с инконгруэнтно плавящимся соединением GaTe3.
Рис. 4.16. Диаграмма состояния системы Sb–Te с широкой областью гомогенности у соединения Sb2Te3.

164 Глава 4. Фазовые равновесия и элементы теории образования фаз
степенью переохлаждения и рассматривать превращение как совершающиеся при температурах и в последовательности, указанной на равновесной диаграмме состояния.
Вусловиях же быстрых изменений температур изменяется не только температура превращения, но и условия превращения, так как не успевают произойти диффузионные процессы, необходимые для осуществления превращений по типу равновесных. Для этих случаев диаграмма фазового равновесия уже не действительна.
Наиболее распространенным следствием отклонения от условий превращения, близких к равновесным, является внутрикристаллическая ликвация, которая заключается в том, что в системе образуется про- странственно-неоднородное состояние: химический состав части кристалла, затвердевшей в начале кристаллизации, отличается от состава частей кристалла, закристаллизовавшихся в последнюю очередь. Ликвация является следствием того, что твердая фаза отличается по составу от жидкой для любой фигуративной точки, лежащей между линиями ликвидуса
исолидуса, и следствием замедленности процессов диффузии в твердой фазе.
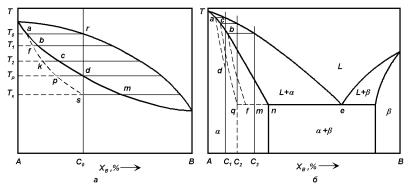
Рассмотрим подробнее это явление, а именно рассмотрим непрерывную кристаллизацию расплава состава C0 при охлаждении в температурном интервале кристаллизации (рис. 4.17). В соответствии с равновесной диаграммой состояния при T0 в нем должны появиться кристаллы состава a, при температуре T1 — кристаллы состава b, при T2 — состава c и т. д. Таким образом, с понижением температуры образуется твердая фаза, все более обогащенная элементом B. В условиях равновесной кристаллизации состав твердой фазы, отвечающий каждому значению температуры, должен быть однородным по объему. Для этого необходимо:
а) чтобы успевало пройти диффузионное выравнивание состава в жидкой фазе;
б) чтобы во всем объеме твердой фазе также успевало пройти диффузионное выравнивание состава.7
Вреальных условиях диффузионное выравнивание состава в твердой фазе никогда полностью не происходит. Если принять, что в жидкой фазе
ина границе раздела фаз выравнивание состава успевает пройти,8 а изменениями в составе твердой фазы вследствие диффузии пренебречь, то
7Помимо рассмотрения процессов в объемах двух фаз необходимо учитывать и процессы, происходящие на границе. Однако, как показывает опыт, на границе раздела фаз скорость установления равновесия не меньше таковой в жидкости и намного превышает соответствующую скорость для твердой фазы.
8Коэффициенты диффузии в жидкой фазе обычно на несколько порядков выше, чем в твердой фазе.
4.1. Фазовые равновесия в полупроводниковых системах |
165 |
Рис. 4.17. Схема ликвации в сплавах систем с неограниченной (а) и ограниченной (б) растворимостью компонентов в твердом состоянии (ad, cq и bf — кривые среднего состава твердого раствора при неравновесной кристаллизации сплавов C1, C2 и C3, соответственно; практически кристаллизация сплава C2 завершается при температуре Te и при этой температуре средний состав кристаллов будет C2 как у расплава до начала кристаллизации; сплавы, составы которых лежат слева от C2, будут кристаллизоваться в однофазном состоянии, а сплавы, составы которых лежат справа, — в двухфазном, хотя сплавы из интервала C2–n по равновесной диаграмме должны быть однофазными. Для составов, лежащих правее от C2, например, для состава C3 при эвтектической температуре жидкость примет состав точки e, кристаллы — состав точки f и, следовательно, остается какое-то количество жидкости fm, которое затвердеет и даст эвтектику. Таким образом, при кристаллизации вместо однородного твердого раствора согласно равновесной фазовой диаграмме получается структура неоднородного твердого раствора + эвтектика).
166 Глава 4. Фазовые равновесия и элементы теории образования фаз
неоднородный по составу кристалл будет характеризоваться средней концентрацией, которая всегда меньше равновесной концентрации, то есть лежит левее равновесной линии солидуса ad (рис. 4.17,а). Так, при температуре T1 состав твердой фазы вместо равновесного b будет средним между b и a и соответствовать точке f, при T2 — точке k и т. д. При равновесной температуре Tр еще будет оставаться какое-то количество жидкости (характеризуется отрезком pd), которое будет охлаждаться до температуры Tк пока линия as не пересечет линию rs. Таким образом, завершение кристаллизации произойдет не при равновесной температуре солидуса Tр, а при температуре Tк, когда средний состав твердой фазы, лежащий на линии as, сравняется с C0. Линию as называют неравновесным солидусом системы.
Так как скорость диффузии в твердой фазе мала, то по мере роста кристалла вновь нарастающие слои будут обогащаться компонентом B. Такое же обогащение было и в равновесном случае, однако там обогащались не только приграничные слои, но и весь объем твердой фазы. Это приводило к тому, что в конце кристаллизации состав кристалла становился равным составу исходного расплава. В результате неравновесной кристаллизации химический состав по длине кристалла оказывается неоднородным. Получающийся кристалл представляет собой ряд твердых растворов с непрерывно меняющимися концентрациями. Итак, мы пришли к выводу, сделанному вначале: неоднородность химического состава по длине кристалла связана с разницей в составах жидкой и твердой фаз, находящихся между собой в равновесии при данной температуре, и замедленностью процессов выравнивания состава (диффузии) в твердой фазе.
Следует иметь в виду, что при реальных скоростях, используемых при выращивании кристаллов, выравнивание состава жидкой фазы также, как правило, оказывается неполным (см. гл. 5).
Отклонения от равновесного состояния, еще более резкие, чем в системах с неограниченной растворимостью, наблюдаются в системах с эвтектическими и перитектическими превращениями. В таких системах однофазные согласно фазовым диаграммам сплавы могут оказаться двухфазными в условиях неравновесной кристаллизации (см. рис. 4.17,б).
Другим важным примером отклонения от равновесных условий кристаллизации является образование в процессе фазовых превращений метастабильных фаз. Так называют неравновесные фазы, представляющие собой переходную стадию между исходной фазой и равновесной. Свободная энергия у метастабильной фазы меньше, чем у исходной, но больше, чем у равновесной, однако превращение ее в равновесную тре-
4.1. Фазовые равновесия в полупроводниковых системах |
167 |
бует определенной энергии активации, при отсутствии которой метастабильная фаза может долго существовать. С метастабильными фазами мы сталкиваемся при резком охлаждении твердых растворов (закалка), которые должны в равновесных условиях охлаждения испытывать эвтектоидные превращения; при распаде пересыщенных твердых растворов, если он осуществляется при низких температурах, когда диффузия и соответственно образование равновесных фаз затруднено. Для практических целей важно, что многие из метастабильных состояний обладают полезными, а иногда и уникальными свойствами. Поэтому оказывается необходимым установить природу этих неравновесных состояний, разработать принципиальные режимы термической и иной обработки, позволяющей их получить. Исходным моментом при решении этих задач является знание равновесных диаграмм состояния.
Знать диаграмму состояния необходимо также для выбора составов жидкой фазы и температурных условий кристаллизации. По фазовым диаграммам определяют температурную область плавления вещества, получают сведения о возможной степени ликвации компонентов, о режимах термической обработки, обеспечивающих нужный фазовый состав вещества и т. д, то есть роль диаграмм состояния для процессов кристаллизации огромна.
4.1.4. P − T − X диаграммы состояния
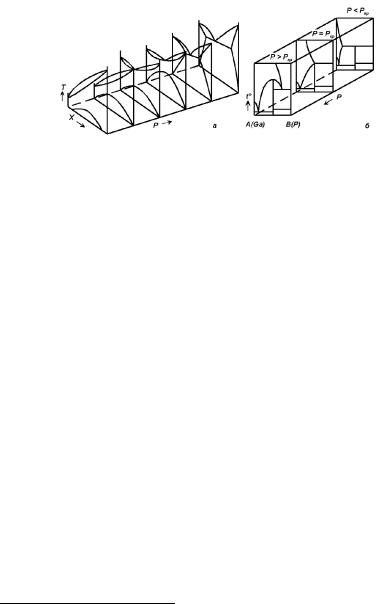
Рассмотрим P − T − X диаграммы для бинарных систем. Интенсивные работы по изучению P − T − X диаграмм состояния показали, что использование высоких давлений (десятки и сотни тысяч атмосфер) в ряде случаев приводит к изменению типа диаграммы состояния, к резкому изменению температур фазовых и полиморфных превращений, к появлению новых фаз, отсутствующих в данной системе при атмосферном давлении. Так, например, диаграмма с неограниченной растворимостью в твердом состоянии при высоких температурах и распадом твердого раствора α на два твердых раствора α1 + α2 при низких температурах может с увеличением давления постепенно переходить в диаграмму с эвтектикой (см. рис. 4.18,а). На рис. 4.18,б показана диаграмма состояния системы Ga–P, в которой образуется полупроводниковое соединение GaP. В зависимости от давления это соединение может плавиться конгруэнтно или инконгруэнтно. Соответственно изменяется и вид двойной диаграммы T − X на различных изобарических сечениях тройной P −T − X диаграммы.
На практике объемные P − T − X диаграммы строятся очень редко. Обычно фазовые превращения в трехмерных P −T − X диаграммах ана-
168 Глава 4. Фазовые равновесия и элементы теории образования фаз
Рис. 4.18. а — P − T − X диаграмма; б — P − T − X диаграмма состояния системы Ga–P с конгруэнтно и инконгруэнтно плавящимся соединением GaP в зависимости от давления.
лизируют с помощью их проекций на плоскости P − T, T − X и P − X, а также различных сечений при постоянных значениях температуры или давления (см. рис. 4.18,а).
Заметим, что при анализе фазовых превращений в системе следует различать P − T − X фазовые диаграммы, в которых давление диссоциации Pдис9 мало и P на фазовой диаграмме — это внешнее давление и в которых давление диссоциации велико и P — это Pдис. В системах, компоненты которых обладают низким давлением диссоциации и в которых максимальная температура плавления смеси ниже самой низкой температуры кипения (в системе нет легколетучих компонентов), ролью газовой фазы при фазовых превращениях можно пренебречь. Если же давление диссоциации какого-либо из компонентов велико (система содержит легколетучие компоненты), то состав газовой фазы необходимо учитывать при температурах как выше, так и ниже ликвидуса.
Рассмотрим подробнее фазовые диаграммы Pдис − T − X с высоким давлением диссоциации (фазовые диаграммы с легколетучими компонентами). Следует отметить, что внимание к ним повысилось в связи с возросшей ролью в полупроводниковой электронике соединений, содержащих летучие компоненты. Например, к ним относятся соединения AIIIBV, содержащие легколетучие компоненты фосфор и мышьяк, соединения AIIBVI, содержащие ртуть, AIVBVI, содержащие серу, и т. д.
Все полупроводниковые соединения обладают более или менее протяженной областью гомогенности, то есть способны растворять в себе
9Pдис — равновесное для данных условий давление диссоциации всех фаз, находящихся в равновесии. При наличии в системе одного легколетучего компонента Pдис — это равновесное давление диссоциации легколетучего компонента системы.

4.1. Фазовые равновесия в полупроводниковых системах |
169 |
какой-либо из компонентов сверх стехиометрического состава или третий компонент.
Любые отклонения от стехиометрического состава сказываются на электрических свойствах (см. гл. 3). Поэтому для воспроизводимого получения кристаллов, содержащих летучий компонент, с заданными свойствами необходимо и воспроизводимое получение соединений заданного состава.
Однако летучесть одного их компонентов соединения приводит к отклонению от стехиометрического состава из-за образования вакансий — анионных или катионных — в зависимости от того, давление диссоциации какого компонента будет выше, и, соответственно, избытка другого компонента. Как уже обсуждалось в гл. 3, вакансии в ряде соединений могут создавать акцепторные или донорные уровни, тем самым влияя на физические свойства.
Энергия образования вакансий в позициях A и B практически никогда не бывает одинаковой, поэтому концентрация анионных и катионных вакансий также различна, а область гомогенности соединения оказывается несимметричной относительно стехиометрического состава. Соответственно практически для всех соединений максимум температуры плавления не соответствует сплаву стехиометрического состава.10
Предотвратить изменение состава соединения за счет летучести можно, если выращивать его из расплава или раствора при внешнем давлении летучего компонента, равном давлению диссоциации при температуре выращивания. Это условие и выбирают с помощью Pдис − T − X диаграмм.
Давление диссоциации легколетучего компонента в сплавах сильно зависит от его состава, как правило, понижаясь с уменьшением концентрации этого компонента, как, например, для системы In–As (давление диссоциации мышьяка понижается почти на четыре порядка с уменьшением концентрации мышьяка в интервале от 100 до 20% [17]). В результате давление диссоциации летучего компонента в соединении оказывается намного меньше давления диссоциации над чистым компонентом при той же температуре.
Это обстоятельство используется в двухтемпературной схеме получения этого соединения. В одной печи создаются две температурные зоны.
10Тем не менее, для соединений, в частности AIIIBV, с узкой областью гомогенности и большинства соединений, в частности AIVBVI, со средней шириной области гомогенности применяется понятие конгруэнтно плавящихся соединений, так как отклонения реальной температуры плавления соединения от температуры плавления соединения стехиометрического состава незначительны.
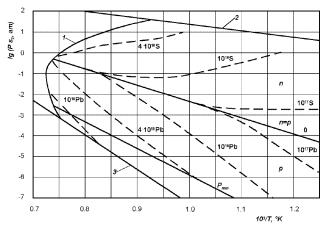
170 Глава 4. Фазовые равновесия и элементы теории образования фаз
Рис. 4.19. Pдис −T сечение Pдис −T − X диаграммы состояния системы Pb–S. 1 — трехфазная линия; 2 — PS2 чистой серы над PbS+S2; 3 — PS2 над PbS+Pb.
Одна имеет температуру T1, равную температуре кристаллизации соединения. Здесь помещают контейнер с расплавом. Во второй зоне помещают чистый летучий компонент соединения — As. Температура T2 во второй зоне поддерживается равной температуре, при которой давление диссоциации летучего компонента в чистом виде равно давлению диссоциации этого компонента в соединении при температуре T1. В результате в первой зоне давление паров летучего компонента над соединением равно его парциальному давлению диссоциации в соединении, что предотвращает улетучивание этого компонента из расплава и обеспечивает кристаллизацию соединения заданного состава.
На рис. 4.19 приведена P − T проекция фазовой диаграммы Pb–S. Сплошной линией показана линия трехфазного равновесия твердой, жидкой и газообразной фаз, ограничивающая область устойчивости твердого соединения; пунктиром — изоконцентрационные линии в пределах области гомогенности. Изоконцентрационные линии показывают составы с равным отклонением от стехиометрии (одинаковые составы) в сторону избытка свинца (проводимость n-типа) или в сторону избытка серы (проводимость p-типа), равновесные при данных значениях температуры и давления паров серы. Линия n = p соответствует значениям температуры и давления PS2 , при которых твердая фаза имеет строго стехиометрический состав. Она пересекает трехфазную линию при температуре, которая является температурой плавления соединения стехиометрического
