
Материаловедение
.pdf2.3. Основные свойства ковалентной связи |
|
|
|
|
|
|
41 |
|||||||||
|
|
|
|
|
|
|
||||||||||
Ионная |
|
|
|
Ковалентная |
Металлическая |
Ван-дер-Ваальсова |
||||||||||
|
|
|
|
|
|
|
Структурные свойства |
|
|
|
|
|
||||
Крупные |
анионы |
Структуры |
с |
Компактные кри- |
Компактные кри- |
|||||||||||
образуют |
струк- |
неплотной |
упа- |
сталлические |
|
|
сталлические |
|||||||||
туры |
с |
плотной |
ковкой |
решет- |
структуры |
|
с |
структуры |
с |
|||||||
упаковкой, |
|
в |
ки |
|
(например, |
плотнейшей |
упа- |
плотнейшей |
упа- |
|||||||
пустотах которых |
Zк = 4) и низкой |
ковкой (Zк = 12 |
ковкой (Zк = 12) |
|||||||||||||
размещены |
кати- |
плотностью. |
|
и 8) |
и |
высокой |
и высокой |
плот- |
||||||||
оны (Zк = 8, 6, 4 |
|
|
|
|
плотностью. |
|
|
ностью. |
|
|||||||
и 3). |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Тепловые свойства |
|
|
|
|
|
|
|||
Довольно |
высо- |
Высокие |
тем- |
Различные |
тем- |
Низкие |
темпе- |
|||||||||
кие |
температуры |
пературы |
плав- |
пературы плавле- |
ратуры |
плавле- |
||||||||||
плавления. |
Низ- |
ления. |
Низкий |
ния. |
|
|
|
|
ния. |
Высокий |
||||||
кий коэффициент |
коэффициент |
|
|
|
|
|
коэффициент |
|||||||||
расширения. |
|
расширения. |
|
|
|
|
|
расширения. |
||||||||
|
|
|
|
|
|
Электрические свойства |
|
|
|
|
|
|||||
Изоляторы. Про- |
Электронный |
Проводники. |
|
|
Изоляторы. |
|
||||||||||
водимость |
носит |
тип |
проводимо- |
Основной |
|
тип |
|
|
|
|||||||
в основном ион- |
сти |
(два |
типа |
проводимости |
— |
|
|
|
||||||||
ный |
характер |
и |
носителей). |
Ак- |
электронный. |
|
|
|
|
|||||||
увеличивается |
с |
тивационная |
Проводимость |
с |
|
|
|
|||||||||
ростом |
темпера- |
зависимость про- |
ростом |
темпера- |
|
|
|
|||||||||
туры. |
|
|
|
водимости |
от |
туры |
уменьшает- |
|
|
|
||||||
|
|
|
|
|
температуры. |
ся. |
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
Оптические свойства |
|
|
|
|
|
||||
Прозрачны |
для |
Прозрачны |
для |
Непрозрачны |
|
|
Прозрачны |
для |
||||||||
электромагнитно- |
электромагнит- |
для |
электромаг- |
электромагнит- |
||||||||||||
го излучения |
от |
ное излучения от |
нитных |
волн |
от |
ного |
излучения |
|||||||||
низких частот до |
низких частот до |
самых |
низких |
от низких частот |
||||||||||||
края поглощения. |
края поглощения. |
частот вплоть до |
до дальней |
уль- |
||||||||||||
Обычно |
прозрач- |
|
|
|
|
середины |
уль- |
трафиолетовой |
||||||||
ны |
в |
видимой |
|
|
|
|
трафиолетовой |
области. |
|
|||||||
области спектра. |
|
|
|
|
области; |
хорошо |
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
отражают свет. |
|
|
|
||||
42 |
|
|
|
Глава 2. Основы теории химической связи |
||||||
|
|
|
|
|
|
|||||
Ионная |
|
Ковалентная |
|
Металлическая |
Ван-дер-Ваальсова |
|||||
|
|
|
|
Зонная структура |
|
|
|
|
||
Полностью |
за- |
Полностью |
за- |
Зона проводимо- |
Полностью |
за- |
||||
полненная |
верх- |
полненная |
верх- |
сти частично за- |
полненная |
верх- |
||||
няя |
валентная |
няя |
валентная |
полнена. |
няя |
|
валентная |
|||
зона |
отделена |
зона |
отделена |
|
зона |
|
отделена |
|||
от |
следующей |
от |
следующей |
|
от |
следующей |
||||
пустой |
зоны |
пустой |
зоны |
|
пустой |
|
зоны |
|||
проводимости |
проводимости за- |
|
проводимости |
|||||||
широкой |
запре- |
прещенной зоной |
|
очень |
|
широкой |
||||
щенной |
зоной |
Eg < 2–3 эВ. |
|
запрещенной |
||||||
(Eg > 2–3 эВ). |
|
|
|
|
зоной. |
|
|
|
||
2.4. Элементарные полупроводники
Элементы, обладающие полупроводниковыми свойствами, то есть имеющие преимущественно ковалентный тип связи, образуют в таблице Д. И. Менделеева компактную группу. Снизу и слева с нею граничат металлы, сверху и справа — вещества, в твердом состоянии являющиеся изоляторами (табл. 1.1).
Рассмотрим элементарные полупроводники с точки зрения особенностей реализующихся в них межатомных связей. Учтем, что у всех этих полупроводников часть электронов валентной оболочки находится в на p-орбиталях, причем их число меняется от 1 (бор) до 5 (йод). Покажем, что в зависимости от числа p-электронов, принимающих участие в образовании ковалентной связи, оказывается различной кристаллическая структура вещества и его полупроводниковые свойства.
2.4.1. Подгруппа IVA: углерод, кремний, германий, α-олово
Валентные оболочки свободных атомов этих элементов описываются формулой ns2np2-электронов, где главное квантовое число n = 2 для углерода, 3 для кремния, 4 для германия и 5 для олова.
Химическая связь в элементарных полупроводниках из IVA подгруппы образуется с помощью sp3-гибридных σ-связей. Поэтому расположение атомов в пространстве таково, что каждый атом окружен четырьмя равноотстоящими ближайшими атомами, которые образуют тетраэдр. Такой тетраэдр может быть вписан в куб (рис. 2.12). Повторяющимся элементом, который образует бесконечную периодическую структуру в этих полупроводниках, является большой куб (рис. 2.13), содержащий 8 малых кубов, типа изображенных на рис. 2.12, из которых 4 центрированы,

2.4. Элементарные полупроводники |
43 |
Рис. 2.12. а — Схема распределения электронов по квантовым ячейкам валентной оболочки C, Si, Ge и α-Sn. б — Пространственная ориентация sp3-гибридов в структуре типа алмаза.
а 4 не центрированы. В большом кубе каждый малый куб, содержащий центрированный тетраэдр, отделен от соседнего малого центрированного куба нецентрированным малым кубом. Полученную таким образом структуру называют структурой типа алмаза (координационное число в ней Zк = 4).10 На одну элементарную ячейку решетки алмаза приходится 8 атомов. Таким образом, элементарные полупроводники IVA подгруппы имеют структуру типа алмаза, которую можно представить как образованную двумя гранецентрированными решетками, вставленными одна в другую и взаимно смещенными вдоль пространственной диагонали на одну четверть ее длины. В такой решетке каждый атом из одной подрешетки окружен четырьмя равноотстоящими ближайшими атомами другой подрешетки.
Кратчайшее расстояние между ядрами атомов дает длину связи d, а
√
постоянная решетки a = 4d 3/3 характеризует расстояние между атомами, расположенными в вершинах кубов.
Коэффициент упаковки в структуре типа алмаза (плотность упаковки) мал — 0.34. Такая неплотная упаковка решетки, обусловленная направленностью связей, существенно сказывается на особенностях образования точечных дефектов, растворимости и диффузии примесей в алмазоподобных полупроводниках.
Углерод существует в нескольких модификациях, например, алмаз и графит. У алмаза (метастабильная при нормальных условиях модификация углерода) под внешней оболочкой находится всего два электрона, поэтому связь валентных электронов с ядром наименее экраниро-
10Структуру алмаза нельзя получить путем набора только малых центрированных кубов, так как в этом случае каждый атом имел бы 8 ближайших соседей и решетка была бы объемноцентрированной.

44 |
Глава 2. Основы теории химической связи |
Рис. 2.13. Структура алмаза.
вана по сравнению с другими элементами этой подгруппы. Прочность связей валентных электронов с ядром проявляется как в механических, так и в электрических свойствах алмаза. Его ширина запрещенной зоны (Eg = 5.48 эВ) максимальна среди элементарных полупроводников. Несмотря на большую величину Eg и на высокое удельное сопротивление, алмаз включают в группу полупроводников, так как при наличии примесей или при освещении в нем обнаруживается проводимость с типичными для полупроводников высокими подвижностями электронов (см. табл. 2.3). Область прозрачности алмаза охватывает весь спектр видимого света, область собственного поглощения hν > Eg находится в ультрафиолетовой области, а прочность — максимальна среди всех элементов периодической системы Д. И. Менделеева.
Существование второй модификаций углерода — графита (стабильной при нормальных условиях) — связано с иным, чем в алмазе, характером гибридизации волновых функций, участвующих в образовании химической связи. Графит существенно отличается от алмаза структурой и своими физическими свойствами. Он имеет слоистое строение и гексагональную структуру, показанную на рис. 2.14. Атомы углерода лежат в параллельных плоскостях, в каждой из которых они расположены в вершинах правильных шестиугольников. Расстояние между атомами
˚
в слое (d1 = 1.42 A) близко к длине связи в алмазе, что указывает на ковалентный характер связи в слое, а большое расстояние между слоя-
˚
ми (d2 = 3.35 A) указывает на слабую связь между ними, по-видимому, обусловленную действием ван-дер-ваальсовых сил. Естественно предположить, что в графите валентные связи строятся не на sp3- (как в алмазе), а на sp2-гибридных и p-орбиталях. Действительно, эксперимент показывает, что три эквивалентные связи образуют плоскую структуру (слой) и расположены под углом близким к 120◦ (sp2-гибридные орби-

2.4. Элементарные полупроводники |
45 |
Таблица 2.3. Некоторые физические свойства элементарных полупроводников [19]. (В таблице везде, где не отмечено специально, приводимые значения относятся к T = 290 K.)
Элемент |
Кристаллич. |
Eg, эВ |
Характерные значения |
||||
|
структура |
|
|
подвижности, см2/В · с |
|||
|
|
|
|
µn |
µp |
||
C |
Куб., Oh5 |
|
5.48 |
1800 |
1400 |
||
(алмаз) |
˚ |
|
|
|
|
|
|
a=3.566 A |
|
|
|
|
|
|
|
Si |
Куб., Oh7 |
|
1.11 |
3000 |
500 |
||
|
˚ |
|
|
|
|
|
|
|
a=5.43 A |
|
|
|
|
|
|
Ge |
Куб., Oh7 |
|
0.664 |
3800 |
1820 |
||
|
˚ |
|
|
|
|
|
|
|
a=5.66 A |
|
|
|
|
|
|
α-Sn |
Куб., Oh7 |
|
0.09 |
2500 |
2400 |
||
|
˚ |
|
|
|
|
|
|
|
a=6.49 A |
|
|
|
|
|
|
P |
Орторомб., D218h |
0.33 (0 K) |
220 |
350 |
|||
(черный) |
a=3.31, b=4.37, |
|
|
|
|
|
|
|
˚ |
|
|
|
|
|
|
|
c=10.47 A |
|
|
|
|
|
|
As |
Ромбоэдр., D35d |
0.175 |
40–550 |
50–1210 |
|||
(серый) |
a=3.76, |
|
(< 20 K) |
(анизотр.) |
(анизотр.) |
||
|
˚ |
|
|
|
|
|
|
|
c=10.76 A |
|
|
|
|
|
|
Sb |
Ромбоэдр., D35d |
0.1 (1.15 K) |
110–274 |
180–363 |
|||
|
a=4.308, |
|
|
(анизотр.) |
(анизотр.) |
||
|
˚ |
|
|
|
|
|
|
|
c=11.274 A |
|
|
|
|
|
|
α-S |
Орторомб., D224h |
3.8 |
7.5 |
10 |
|||
|
a=10.46, b=12.88, |
|
|
|
|
|
|
|
˚ |
|
|
|
|
|
|
|
c=24.48 A |
|
|
|
|
|
|
Se |
Триг., D34 |
˚ |
1.9 |
— |
40 |
||
|
|
|
|
|
|
|
|
|
a=4.35, c=4.94 A |
|
|
|
|
|
|
Te |
Триг., D34 |
˚ |
0.335 |
2380 ( c) |
1260 ( c) |
||
|
=5.95 A |
|
1150 ( |
) |
650 ( |
) |
|
|
a=4.94, c |
5 |
|
|
c |
|
c |
α-B |
|
1.97 (E c) |
|
|
|||
Ромбоэдр., D3d |
— |
120 |
|||||
|
˚ |
|
1.90 (E c) |
|
|
|
|
|
a=5.057 A, |
|
|
|
|
|
|
|
α=58◦ |
|
|
|
|
|
|
β-B |
Ромбоэдр., D35d |
1.63 (E c) |
1 |
|
300 |
||
|
˚ |
|
1.61 (E c) |
|
|
|
|
|
a=10.14 A, |
|
|
|
|
|
|
|
α=65◦ |
|
|
|
|
|
|
46 |
Глава 2. Основы теории химической связи |
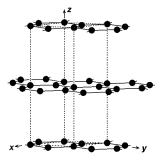
Рис. 2.14. Структура графита. Элементарная ячейка указана штриховыми линиями.
тали), а четвертая связь направлена перпендикулярно плоскости слоя и построена на p-орбиталях. Отсюда следует, что три sp2 σ-связи являются ковалентными, то есть строго локализованными по соответствующим направлениям, а перекрытие между p-орбиталями соседних атомов приводит к образованию π-связывающих орбиталей, которые расположены сверху и снизу от плоскости. Высокая электропроводность графита в направлениях, параллельных плоскостям, и металлический блеск обусловлены лишь частичным заполнением p-орбиталей, из которых образуются π-связывающие молекулярные орбитали. Таким образом, особенности образования ковалентной химической связи в графите приводят к тому, что этот материал имеет слоистую структуру с резкой анизотропией механических и электронных свойств.
Кремний Si имеет 10 экранирующих электронов, которые ослабляют связь валентных электронов с ядром. О величине этого эффекта можно судить по уменьшению первого потенциала ионизации. Физические параметры Si приведены в табл. 2.3.
Германий Ge имеет 28 экранирующих электронов. Физические параметры приведены в табл. 2.3.
У олова между валентной оболочкой и ядром находится 46 электронов и их экранирующее действие столь велико, что ковалентная связь оказывается неустойчивой. Алмазной структурой с Eg = 0.09 эВ и типичными для этой группы подвижностями носителей заряда обладает лишь одна из модификаций — α-Sn (серое олово), устойчивая при температурах ниже −13◦С; обычное β-Sn, устойчивое при более высоких температурах, — металл.
Таким образом, видно, что по мере возрастания атомного номера элемента ковалентная составляющая связи закономерно ослабляется, уменьшается Eg и возрастает доля металлической составляющей связи. У ато-
2.4. Элементарные полупроводники |
47 |
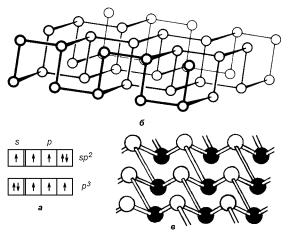
Рис. 2.15. а — Схема возможного распределения электронов по квантовым ячейкам валентной оболочки элементов подгруппы VA. б — Один слой кристаллической структуры черного фосфора. в — Кристаллической структура мышьяка, сурьмы и висмута.
ма Pb, следующего за Sn, химическая связь теряет направленность и становится металлической (для атома свинца характерно сильное влияние внутренних электронов на потенциал взаимодействия внешних электронов с ядром, что приводит к значительному расщеплению s- и p-состояний и, как следствие, s-электроны не участвуют в образовании химической связи — нет sp3-гибридизации).
2.4.2. Подгруппа VA: фосфор, мышьяк, сурьма и висмут
Структура валентной оболочки — ns2np3 с n = 3 для фосфора, 4 для мышьяка, 5 для сурьмы, 6 для висмута. Распределение электронов по ячейкам валентной оболочки показано на рис. 2.15,а: основное состояние характеризуется тремя электронами с неспаренными спинами (p3), причем число их не будет меняться даже при переходе одного из s-электронов на p-орбиту. Таким образом, во всех указанных выше элементах этой подгруппы три связи любого атома направлены к трем другим соседним атомам, при этом образуются структуры с координационным числом Zк = 3. Физические параметры элементов этой подгруппы приведены в табл. 2.3.
48 |
Глава 2. Основы теории химической связи |
Фосфор. Фосфор имеет по крайней мере пять полиморфных модификаций (белый (две модификации), красный, коричневый и черный). Лишь одна из них — черный фосфор, который образуется при повышенной температуре (≈200◦C) и повышенном давлении, — обладает полупроводниковыми свойствами. Черный фосфор — наиболее устойчивая кристаллическая форма фосфора. Он кристаллизуется в орторомбической системе; его элементарная ячейка содержит восемь атомов. Кристалл имеет слоистую структуру, в которой каждый атом связан с тремя другими. Один слой этой структуры показан на рис. 2.15,б. Длина свя-
˚
зи P–P равна 2.23 A. Два угла между направлениями валентных связей составляют 102◦, а один — 96,5◦. По-видимому, ковалентные связи образуются в результате частичного смешивания и перекрытия sp2-гибридных и p-орбиталей.
Мышьяк. Мышьяк также существует в трех разных модификациях (белый, серый и аморфный), из которых серая кристаллическая и аморфная модификации обладают полупроводниковыми свойствами. Термодинамически устойчивым при нормальных условиях является серый мышьяк, кристаллизующийся в ромбоэдрической решетке. Кристалл серого мышьяка имеет гофрированно-слоистую структуру (рис. 2.15,в). Ее можно представить состоящей из двухслойных пакетов, суперпозиция которых дает ромбоэдрическую структуру кристалла. Таким образом, каждый атом имеет три ближайших соседа в соседнем слое того же пакета
˚
на расстоянии d1 = 2.52 A, с которыми он связан ковалентными связями, и три более удаленных соседа из соседнего пакета на расстоянии
˚
d2 = 3.12 A. Углы между направлениями межатомных связей в одном пакете (96.65◦) указывают на то, что ковалентные связи образуются в результате перекрытия простых p3-орбиталей. Соседние пакеты связаны между собой в основном слабыми силами Ван-дер-Ваальса, однако в химической связи между соседними пакетами присутствует значительная доля металлической составляющей. Смешанный характер связей накладывает отпечаток на степень совершенства структуры и на электрические свойства: они явно анизотропны, а подвижность носителей заряда оказывается существенно ниже, чем в элементах с трехмерной ковалентной структурой.
Сурьма, висмут. Сурьма и висмут имеют ту же кристаллическую структуру, что и мышьяк. Однако с увеличением атомного номера увеличивается доля металлической составляющей связи (в обычном виде сурьма и висмут — полуметаллы). Этот факт находит свое отражение и
˚ |
˚ |
в кристаллической структуре: для сурьмы d1 = 2.91 A и d2 |
= 3.36 A и |
разность между ними (d2 − d1) оказывается существенно меньшей, чем
2.4. Элементарные полупроводники |
49 |
|
в случае мышьяка. Для Bi |
˚ |
˚ |
d1 = 3.07 A и d2 |
= 3.53 A. Однако сле- |
|
дует заметить, что несмотря на очевидно металлический характер Sb и Bi существует различие между их структурой с относительно низкой координацией и структурами с высокой координацией, типичными для настоящих металлов.
Таким образом, закономерности изменения Eg с увеличением порядкового номера элемента в этой группе полупроводников аналогичны описанным выше для IVA подгруппы. Кроме того, видно, что химическая связь, образующаяся в подгруппе VA, оказывается заметно слабее связи, построенной на sp3-гибридных орбиталях.
2.4.3. Подгруппа VIA: сера, селен, теллур
Структура валентной оболочки — ns2np4 (n = 3 для серы, 4 для селена, 5 для теллура. Элементы этой группы содержат два неспаренных p-электрона на внешней оболочке, поэтому две ковалентные связи от каждого атома могут быть направлены либо к одному атому (при этом будут образовываться двухатомные молекулы как в O2), либо к двум различным атомам (образуются многоатомные молекулы в виде замкнутых колец или бесконечных протяженных цепочек). Угол между соседними ковалентными связями, направленными к двум различным атомам, не должен сильно отличаться от 90◦. Отличие может быть связано либо с частичной sp-гибридизацией волновых функций электронов, либо со взаимодействием между вторыми соседями. В кристалле кольца или изогнутые цепочки связаны между собой силами Ван-дер-Ваальса. Можно ожидать, что связи здесь будут еще слабее, чем в кристаллах VA подгруппы. Физические параметры элементов подгруппы приведены в табл. 2.3.
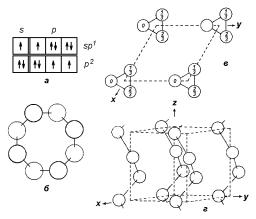
Сера. Существует несколько различных полиморфных модификаций серы, однако полупроводниковыми свойствами обладает только наиболее стабильная при нормальных условиях орторомбическая модификация. Структура этой фазы строится из молекул S8, которые имеют кольцевую форму, показанную на рис. 2.16,б. Расстояние S–S составляет
˚
d = 2.06 A, что соответствует ковалентному радиусу атома серы. Углы между ковалентными связями равны 108◦. Отдельные компактные молекулы S8 относительно слабо связаны между собой силами Ван-дер- Ваальса.
Селен. Для наиболее часто встречающейся полупроводниковой модификации селена (тригональной) характерно образование длинных спиральных цепочек, оси которых образуют оси c гексагональной структуры. Угол между связями в такой цепочке составляет 103◦, поэтому можно
50 |
Глава 2. Основы теории химической связи |
Рис. 2.16. а — Схема возможного распределения электронов по квантовым ячейкам валентной оболочки элементов подгруппы VIA. б — Молекула S8 в кристаллической структуре орторомбической серы. в, г — Схема элементарной ячейки гексагональной структуры селена, спроектированная на плоскость, перпендикулярную оси z; клинографическая проекция той же самой ячейки.
говорить, что эти связи осуществляются не чистыми p-, а частично гибридизованными sp-волновыми функциями. Расстояние Se–Se в цепочке
˚ ˚
равно d1 = 2.37 A, а между атомами в соседних цепочках — d2 = 3.49 A, что соответствует слабым ван-дер-ваальсовым силам, удерживающим цепочки вместе. Заметим, что расстояние d2 значительно меньше, чем соответствующий радиус Ван-дер-Ваальса для атома селена, поэтому, вероятно, что в связи между цепочками присутствует металлическая составляющая, и следует ожидать усиления металлических свойств элемента. Каждый атом в структуре селена оказывается симметрично окруженным шестью соседями в базисной плоскости, а цепочки образуют структуру подобную прутикам в связке. Такая сложная природа связей и такая кристаллическая структура селена приводят к тому, что для селена характерна сильная анизотропия электропроводности и подвижности (вдоль и перпендикулярно оси c). Общее же несовершенство структуры создает в кристаллах большие концентрации активных дефектов, поэтому Se всегда имеет проводимость p-типа, которую не удается изменить даже введением больших концентраций примесей.
Теллур. Теллур имеет такую же структуру, что и селен (расстояние
˚
Te–Te в ней оставляет 2.835 A, а угол между связями в цепочке — 103.2◦). Однако она более совершенная, чем у селена, вследствие чего
