
Материаловедение
.pdf4.2. Элементы общей теории образования фаз |
171 |
состава. или в сторону избытка серы (проводимость p-типа) .
Как видно из рис. 4.19, температура плавления соединения стехиометрического состава ниже максимальной температуры плавления, которую имеет сплав с избытком свинца по сравнению с формульным составом. Видна резкая зависимость состава кристалла от парциального давления паров летучего компонента. В области высоких температур все кривые, соответствующие разным составам, приближаются к линии n = p. С понижением температуры разница между равновесными давлениями, соответствующими разным составам, увеличивается. Этим объясняется трудность получения сплава заданного состава непосредственно при кристаллизации, проходящей при высоких температурах. Поскольку кривые парциального давления для разных составов близки, небольшие случайные отклонения давления паров летучего компонента могут привести к ощутимому изменению состава твердой фазы.
Если же кристалл после выращивания подвергнуть длительному отжигу при более низких температурах и таком давлении, что изоконцентрационные линии для разных составов резко расходятся, то состав кристалла можно довести до заданного. Этим часто пользуются на практике.
4.2. Элементы общей теории образования фаз
В процессе получения любого материала в нем происходят переходы из одного фазового состояния в другое. Основными промышленными методами получения монокристаллов является кристаллизация из жидкой и конденсация из газовой фаз.
Кристаллизацией называется переход вещества из жидкой в твердую фазу. Конденсацией называется переход вещества из газообразной в жидкую или твердую фазы.
Фазовые превращения никогда не проходят одновременно во всем объеме материала. В начале процесса в разных местах исходной фазы образуются центры новой фазы — стабильные частицы новой фазы, которые затем разрастаются благодаря процессам переноса. Процесс роста кристаллов принято представлять состоящим из трех основных стадий: 1) возникновения неравновесного состояния — переохлаждения для исходной жидкой фазы или пересыщения для газовой фазы; 2) образования центров новой фазы; 3) увеличения их линейных размеров — собственно рост кристалла. При данной температуре жидкую фазу называют переохлажденной, если ее температура ниже температуры равновесного образования твердой фазы. При данной температуре газовую фазу назы-
172 Глава 4. Фазовые равновесия и элементы теории образования фаз
вают пересыщенной, если ее давление превышает равновесное давление насыщенных паров жидкой или твердой фазы.
Создание неравновесного состояния — необходимое условие для самопроизвольного возникновения центров новой фазы. В равновесных условиях возможность их появления исключена. В различных точках газообразной или жидкой атомной или молекулярной системы, находящейся в термодинамическом равновесии, непрерывно возникают флуктуации, то есть отклонения величин некоторых параметров системы от их наиболее вероятных (средних) значений. Флуктуации плотности и концентрации в исходной фазе могут приводить к изменению фазового состояния, то есть к образованию зародышей новой фазы. Такие флуктуации сопровождаются изменением свободной энергии системы, однако энергия образующихся частиц (зародышей) новой фазы в системе, находящейся в термодинамически равновесном состоянии, значительно превышает энергию таких же частиц исходной фазы и флуктуационно возникшие частицы новой фазы быстро распадаются. Образование центров новой фазы в равновесных условиях оказывается энергетически не выгодным. Ниже будет показано, что создание неравновесного состояния для кристаллизации (конденсации) исходной фазы необходимо для сообщения системе дополнительной энергии, требуемой для того, чтобы процесс образования центров новой фазы сделать энергетически выгодным.
Движущей силой любого фазового превращения является стремление системы к уменьшению свободной энергии F. Для протекания фазового превращения необходимо, чтобы свободная энергия единицы объема исходной фазы была больше свободной энергии такого же объема новой фазы. Кроме того, следует учитывать, что при образовании частиц новой фазы обязательно возникают поверхности раздела между новой и исходной фазами. Эти поверхности обладают поверхностной энергией, что затрудняет превращение. Поэтому в общем виде суммарное изменение свободной энергии системы при фазовом превращении будет:
∆F = ∆Fv + ∆Fs, |
(4.7) |
где ∆Fv = Fv(S) − Fv(L) и ∆Fs = Fs(S) — изменения свободной энергии, связанные с объемной и поверхностной составляющими. Проанализируем более подробно необходимые для протекания фазовых превращений условия.

4.2. Элементы общей теории образования фаз |
173 |
Рис. 4.20. Зависимость свободной энергии системы от радиуса зародыша новой фазы при различных температурах
T1 > T2 > T3 > T4.
4.2.1. Образование центров новой фазы
Механизм образования центров новой фазы может быть гомогенным или гетерогенным.
Гомогенное образование центров новой фазы
Гомогенным называется образование зародыша новой фазы в объеме исходной фазы, сопровождающееся образованием всей поверхности, ограничивающей зародыш. Гиббс впервые показал, что зародыш новой фазы становится устойчивым лишь при условии, что его размер превосходит определенное критическое значение. Области новой фазы, размер которых меньше критического, называются зародышами, а размер которых больше критического, — центрами новой фазы (в случае кристаллизации центры новой фазы часто называют центрами кристаллизации). Френкель подробнее рассмотрел условия зарождения частиц новой фазы и определил размер критического зародыша. Найдем его для случая кристаллизации из жидкой фазы.
Пусть в жидкой фазе в результате флуктуаций в системе появился зародыш твердой фазы с объемом V и с поверхностью S, характеризуемой коэффициентом поверхностного натяжения σ. Тогда
∆ |
= |
Vρ |
( |
( |
) |
− F |
( )) и ∆ |
Fs |
= |
S |
σ, |
(4.8) |
|
|
M |
||||||||||||
Fv |
|
|
F |
S |
|
L |
|
|
|
||||
где ρ и M — плотность и молекулярный вес зародыша, F (S) и F (L) — молярная свободная энергия твердой и жидкой фаз.
Зародыш твердой фазы будет устойчивым, если величина ∆F = ∆Fv + ∆Fs будет отрицательной.
Составляющая ∆Fs всегда положительна, так как при всех условиях создание новой поверхности раздела требует затраты энергии. Величина и знак ∆Fv зависят от соотношения между фактической температурой T
174 Глава 4. Фазовые равновесия и элементы теории образования фаз
иTпл. При T1 > Tпл (см. рис. 4.20) F (S) > F (L) и, следовательно, ∆F > 0
при любых размерах зародыша r. С приближением температуры T к Tпл кривая ∆F(r) будет становиться все более пологой, но ∆F будет моно-
тонно расти. При температуре T3 < Tпл ∆Fv < 0, так как F (S) < F (L). Однако при малых r в суммарном изменении свободной энергии ∆F пре-
обладает вклад положительной составляющей ∆Fs. По мере роста размера зародыша r абсолютная величина ∆Fv возрастает быстрее, чем ∆Fs,
ипри некотором критическом значении r кривая ∆F(r) достигает мак-
симума. Критическим зародышем называется зародыш, размер которого определяется из условия максимума кривой ∆F(r) при T < Tпл. Таким образом, самопроизвольный (спонтанный) рост кристалла, сопровождающийся уменьшением свободной энергии системы, может происходить только при T < Tпл, то есть когда система находится в неравновесном
состоянии, и для зародышей с размером r выше критического r , то есть при r > r .
Образование зародыша критического размера требует затраты энергии ∆F . Найдем ∆F и r . При этом будем считать, что форма зародыша остается постоянной в процессе его роста до r и, учтем, что S = KV2/3,
где K — коэффициент, учитывающий форму зародыша. Тогда |
|
|||||||||
∆ |
= |
Vρ |
( |
( |
) |
− F |
( )) + |
σ 2/3. |
(4.9) |
|
|
M |
|||||||||
F |
|
|
F |
S |
|
L |
K V |
|
||
Максимальное значение изменения свободной энергии ∆F можно найти продифференцировав ∆F по V и приравняв производную нулю.
Выполнив это, получим |
|
∆F = σS /3. |
(4.10) |
Таким образом, энергия, необходимая для образования зародыша критического размера, равна одной трети его поверхностной энергии. Остальные две трети этой энергии компенсируются выигрышем объемной составляющей свободной энергии.
Для зародыша кубической формы с длиной ребра a = 2r (V = 8r3 и
K = 6) находим размер критического зародыша |
|
||
r = |
2σM |
|
|
|
. |
(4.11) |
|
[ρ(F (L) − F (S)] |
|||
Полученное выражение не дает в явном виде зависимости критического размера зародыша от температуры, а точнее, от величины переохлаждения ∆T = Tпл −T. Однако если учесть, что
∆F = F (L) − F (S) = [U (L) −TS (L)] − [U (S) −TS (S)]
= U (L) −U (S) −T[S (L) − S (S)] = ∆L − ∆LT/Tпл, (4.12)

4.2. Элементы общей теории образования фаз |
175 |
где U (L) − U (S) = ∆L — скрытая молярная теплота кристаллизации, а S (L) − S (S) = ∆L/Tпл, так как при T = Tпл ∆F = 0 и U (L) − U (S) = Tпл[S (L) − S (S)], то (4.11) преобразуется к виду
r = |
2σMTпл |
. |
(4.13) |
|
|||
|
ρ∆L∆T |
|
|
Таким образом, критический размер зародыша тем больше, чем больше коэффициент поверхностного натяжения σ на границе между новой и исходной фазами и чем меньше величина переохлаждения. Каждому значению переохлаждения соответствует своя величина равновесного критического зародыша. Зародыш с r > r будет расти (появится центр новой фазы), а с r < r — уменьшаться в своем размере. Заметим, что зародыш критического размера должен обладать свойствами макрофазы.
Выражение для размера критического зародыша, аналогичное приведенному выше для случая кристаллизации, может быть получено и для случая образования жидкой капли из пересыщенного пара с давлением P (пар характеризуется равновесным давлением P0 при температуре T).11 Изменение свободной энергии газа, обусловленное его изотермическим сжатием и энергией, затраченной на образование поверхности раздела жидкость–пар, для сферической капли радиусом r выражается формулой:
∆F = ∆Fv + ∆Fs = − |
4πr3ρ |
R0T ln(Pr/P0) + 4πr2σ, |
(4.14) |
3M |
где Pr — давление пересыщенного пара над каплей радиуса r при температуре T, P0 — равновесное давление пара при температуре T, ρ и M — плотность и молекулярный вес зародыша, R0 — газовая постоянная.
Анализ выражения (4.14) показывает, что если Pr/P0 < 1, то при любых размерах капли ∆F положительна, и капли, возникающие в результате флуктуаций, проявляют тенденцию к испарению. Если Pr/P0 > 1, то при малых r преобладает второй член и значение ∆F положительно, а при достаточно больших r основную роль играет первый член и ∆F < 0 (аналогично выше изложенному). Нетрудно показать, что ∆F составляет одну треть от работы образования поверхности зародыша критического размера при конденсации капли из пересыщенного пара (аналогично
случаю кристаллизации), а критический радиус капли равен |
|
|||
r = |
2σM |
|
||
|
. |
(4.15) |
||
ρR0T ln(Pr/P0) |
||||
|
|
|
|
|
11Вывод и выражение для размера критического зародыша для случая конденсации в твердую фазу будут аналогичны приведенным ниже для капель, если учесть форму кристаллического зародыша.

176 Глава 4. Фазовые равновесия и элементы теории образования фаз
Капля размером r < r будет испаряться, а размером r > r будет расти. Таким образом, рассмотрение начальных стадий процессов кристаллизации и конденсации показало, что для зарождения и роста кристаллов необходимо, чтобы исходная фаза была переохлаждена или пересыщена по отношению к возникающей в ней новой фазе. Пересыщение при этом выражается одним из следующих способов: ∆P = P − P0 — абсолютное пересыщение; δ = ∆P/P0 — относительное пересыщение; α = P/P0 — коэффициент пересыщения. Жидкая фаза, как было показано выше, ха-
рактеризуется переохлаждением ∆T = Tпл −T.
Как уже отмечалось выше, образование зародышей новой фазы, требующее затраты энергии, обеспечивается за счет флуктуаций. Вероятность таких флуктуаций согласно статистике Больцмана равна
W exp(−∆F/kT). |
(4.16) |
Вероятность образования критического зародыша при кристаллизации из переохлажденного расплава нетрудно найти, подставляя размер критического зародыша (4.13) в формулу (4.10), а затем (4.10) в (4.16):
W exp |
− |
32σ3T2 M2 |
. |
(4.17) |
(∆L∆Tρ)2kT |
||||
|
|
пл |
|
|
Аналогичные действия дают выражение для конденсации капель из пересыщенного пара:
W exp − |
16πσ3M2 |
. |
(4.18) |
3kT(R0Tρ ln(Pr/P0))2 |
Таким образом, вероятность возникновения зародыша критического размера растет с увеличением переохлаждения расплава или пересыщения пара, а размер критического зародыша уменьшается.
Рассчитаем скорость образования центров новой фазы в жидкой или газовой фазе в зависимости от переохлаждения или пересыщения. Скоростью образования центров новой фазы V (см−3с−1) называется число стабильных частиц новой фазы, образующихся в единицу времени в единице объема старой фазы.
Сначала найдем выражение для скорости образования центров новой фазы V в пересыщенном паре. Полагают, что скорость образования центров новой фазы в такой неравновесной системе равна средней скорости, с которой критические зародыши увеличивают свой размер. Предполагая, что концентрация критических зародышей равна nкр,12 мы получим
12Ниже концентрация критических зародышей определяется из условия флуктуационного равновесия с метастабильной исходной фазой.

4.2. Элементы общей теории образования фаз |
177 |
следующее выражение для скорости образования центров новой фазы в единице объема газовой фазы:
V = ωкрnкр, |
(4.19) |
где ωкр — частота, с которой критические зародыши захватывают атомы или молекулы и становятся центрами новой фазы. Заметим, что в приведенном выражении не учитывается процесс, при котором центр новой фазы в результате распада снова становится критическим зародышем, а также не учитываются процессы объединения зародышей.13 Частота захвата частиц критическим зародышем при гомогенном зародышеобразовании капель может быть представлена в виде
ωкр = acqS , |
(4.20) |
где q = P/(2πmkT)1/2 — плотность потока частиц с массой m из паровой фазы с давлением P и температурой T, S = 4πr 2 — площадь поверхности зародыша критического размера, ac — коэффициент конденсации, равный отношению числа конденсирующихся (остающихся на поверхности) частиц к числу ударившихся о поверхность зародыша частиц [37]. Тогда
V = acqS nкр. |
(4.21) |
Пусть общее число зародышей новой фазы мало, то есть существует флуктуационное равновесие с исходной метастабильной фазой. Это предположение позволяет ввести представление о квазиравновесном распределении зародышей критического размера. Тогда согласно статистике Больцмана получаем nкр ≈ n1 exp(−∆F /kT), где n1 = P/kT — концентрация частиц в газовой фазе (атомов или молекул, не входящих в зародыши).
Более точный анализ показывает, что расчет с использованием статистики Больцмана не вполне корректен (хотя и используется в качестве первого приближения), так как в процессе зарождения зародышей критического размера равновесное состояние не достигается. Уточненное выражение для скорости образования центров новой фазы V можно получить, анализируя образование и распад зародышей с помощью ряда бимолекулярных реакций типа A + Ai−1 Ai, описывающих процесс образования зародышей в газовой фазе путем последовательного присоединения частиц (A — частица, Ai — зародыш из i частиц). В результате анализа этих реакций рассчитывают стационарную концентрацию зародышей в условиях необратимого процесса, когда число зародышей критического размера может уменьшаться как путем их разрастания, так и путем их распада. Учет этих процессов приводит к возникновению в формуле (4.21) дополнительного сомножителя Z — «фактора неравновесности», имеющего вид
13Такое предположение, вообще говоря, несправедливо. Однако далее возможность таких процессов будет учтена.
178 Глава 4. Фазовые равновесия и элементы теории образования фаз
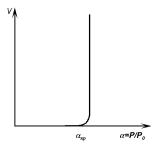
Рис. 4.21. Зависимость скорости гомогенного образования центров новой фазы (жидких капель) в пересыщенном паре от коэффициента пересыщения.
Z = (∆F /3πkTiкр2 )1/2, |
(4.22) |
где iкр — число частиц в зародыше критического размера.
С учетом фактора неравновесности скорость образования центров новой фазы из пара будет определяться выражением:
V = 4πr 2(acP/(2πmkT)1/2)(∆F /3πkTi2кр)1/2n1 exp(−∆F /kT). (4.23)
Анализ полученного выражения показывает, что, начиная с некоторого пересыщения, наблюдается резкое увеличение скорости зарождения центров новой фазы в зависимости от пересыщения. Это пересыщение называют критическим (рис. 4.21).
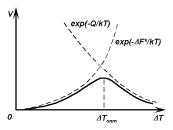
Иная зависимость скорости образования центров новой фазы от степени переохлаждения наблюдается при кристаллизации. Основное различие случаев зарождения центров новой фазы из расплава и газовой фазы состоит в следующем. В случае газовой фазы, как было показано выше, зарождение центров новой фазы развивается лавинообразно при некотором критическом пересыщении (рис. 4.21). Скорость же зарождения центров новой фазы в вязком расплаве при малых величинах переохлаждения (при температурах расплава немного ниже Tпл материала) близка к нулю, с увеличением переохлаждения расплава она возрастает, достигает максимума при ∆T = ∆Tопт, затем снижается и при больших величинах переохлаждения обращается в 0 (рис. 4.22). Физическое объяснение такого различия состоит в том, что и на зарождение и на рост из расплава, кроме рассмотренного выше термодинамического фактора, сильное влияние оказывает подвижность атомов (скорость диффузии), которая с увеличением переохлаждения расплава значительно уменьшается. Рост скорости образования центров новой фазы при малых ∆T обусловлен тем, что вблизи Tпл подвижность атомов велика, а вероятность возникновения критических зародышей растет с увеличением ∆T
4.2. Элементы общей теории образования фаз |
179 |
Рис. 4.22. Зависимость скорости гомогенного образования центров кристаллизации в единице объема расплава от степени его переохлаждения.
(см. 4.17). Уменьшение же скорости зарождения центров кристаллизации с увеличением ∆T (большие степени переохлаждения) вызвано тем, что при низких температурах подвижность атомов уменьшена, а тем самым уменьшена и способность системы к превращению. При очень больших ∆T скорость зарождения становится равной нулю, так как подвижность атомов уже недостаточна для того, чтобы осуществилась перестройка их из хаотического расположения в жидкости в правильное в кристалле.
Таким образом, в случае кристаллизации из расплава на скорость зарождения помимо термодинамического фактора существенное влияние оказывает и кинетический фактор. Этот фактор оказывает такое же влияние и на линейную скорость роста кристаллической фазы. Кинетический фактор учитывается с помощью множителя exp(−Q/kT), где Q — энергия активации процесса, контролирующего подвижность атомов. Тогда скорость образования центров кристаллизации в единице объема расплава будет
V exp(−Q/kT) exp(−∆F /kT). |
(4.24) |
Вероятность возникновения критических зародышей, определяемая значением ∆F , растет с увеличением переохлаждения расплава. В то же время с ростом переохлаждения расплава понижается подвижность атомов, определяемая Q, особенно в вязких расплавах, и тем самым замедляется образование центров кристаллизации даже при сильных переохлаждениях. Поэтому для каждой жидкости существует оптимальное переохлаждение, при котором скорость возникновения центров кристаллизации максимальна (рис. 4.22).
При кристаллизации невязких жидкостей (например, расплавы кремния и германия) кинетический фактор играет меньшую роль, и в результате этого максимума в скорости образования центров может и не наблюдаться. В этом случае при достижении некоторого критического переохлаждения происходит резкое увеличение скорости образования цен-
180 Глава 4. Фазовые равновесия и элементы теории образования фаз
тров кристаллической фазы и наступает быстрая кристаллизация всего объема жидкости.
Коротко изложенная теория позволяет оценить критическое пересыщение и оптимальное переохлаждение для начала гомогенного образования центров новой фазы. При кристаллизации из расплава ∆Tопт составляет 0.2Tпл; в случае конденсации из газовой фазы критический коэффициент пересыщения αкр = Pr/P0 ≈ 10.
Однако наблюдаемые в реальных условиях значения переохлаждения или пересыщения во многих случаях оказываются намного ниже указанных величин. Это связано главным образом с наличием в реальных условиях факторов, снижающих величину составляющей поверхностной энергии в изменении свободной энергии при образовании зародыша новой фазы и соответственно уменьшающих энергию образования зародыша критического размера и критическое пересыщение или переохлаждение. Параметром, с помощью которого можно существенно изменять энергию образования критического зародыша, а следовательно, и необходимую величину пересыщения (переохлаждения), является поверхностное натяжение σ. Управлять процессом фазовых превращений, изменяя поверхностное натяжение σ, можно двумя путями: введением специальных примесей в исходную фазу или созданием готовых поверхностей раздела. Растворимые в расплаве примеси, располагающиеся в поверхностных слоях центров новой фазы и уменьшающие их свободную поверхностную энергию, называются поверхностно-активными примесями. В случае наличия готовых поверхностей раздела зародышеобразование происходит по гетерогенному механизму.
Гетерогенное образование зародышей новой фазы
Гетерогенным называется образование зародышей новой фазы в исходной фазе на готовых поверхностях раздела, сопровождающееся образованием лишь части поверхности зародыша. К гетерогенным фазовым превращениям на готовых поверхностях раздела относятся кристаллизация на затравках при выращивании монокристаллов, на подложках при эпитаксиальном росте, на нерастворимых твердых частицах в расплаве. К гетерогенным превращениям по существу относятся и все случаи роста зародышей, возникших гомогенным путем.
Рассмотрим процесс гетерогенного зародышеобразования на примере конденсации насыщенного пара на гладкую плоскую чистую подложку.
Поскольку свободная поверхностная энергия жидкости изотропна, то зародыш, образующийся на плоской подложке и находящийся в равновес-
