
Материаловедение
.pdf5.1. Кристаллизационные методы очистки |
191 |
исключить загрязнения, вносимые в в анализируемый материал в ходе самого анализа. Чувствительность радиоактивационного метода очень велика. Для полупроводниковых материалов наибольшее распространение получили косвенные, физические методы оценки чистоты на основании измерения концентрации носителей заряда, удельного сопротивления, подвижности и др. Физические методы анализа чистых веществ гораздо менее трудоемки и длительны, чем обычные аналитические методы определения содержания примесей. Однако результаты, полученные такими методами, дают представление только о суммарном содержании примесей. Тем не менее они позволяют надежно судить о возможности использования проанализированных чистых веществ в технологии полупроводниковых материалов.
Понятие химической чистоты материалов, а также способы ее выражения различны и зависят от области применения материала. В нашей стране для чистых веществ, использующихся в химической и металлургической практике, в зависимости от степени очистки установлены следующие классификации: «чистый» (марка Ч, содержание примесей от 2 · 10−5 до 1.0%), «чистый для анализа» (марка ЧДА, содержание примесей от 1 · 10−5 до 0.4%), «химически чистый» (марка ХЧ, содержание примесей от 5 · 10−6 до 0.5%) и «особо чистый» (марка ОЧ, содержание примесей 0.05%). Особо чистые вещества для полупроводниковой техники разделяют на классы A, B и C. В класс A входят вещества, чистоту которых по содержанию основного компонента можно надежно охарактеризовать современными аналитическими методами. Классы чистоты B и C характеризуют чистоту по содержанию определяемых примесей. В последнем случае о содержании основного компонента можно говорить только условно, понимая под этим разницу между 100% и суммарным содержанием определяемых примесей.
Неметаллы и химические соединения относят к высоко чистым веществам, если содержание лимитирующих примесей в них не менее чем на порядок ниже по сравнению с соответствующей маркой ХЧ, на два порядка — для марки ЧДА и на три порядка — для марки Ч. К высоко чистым веществам принято относить также металлы и полупроводниковые материалы, если содержание каждой из контролируемых примесей в них не превышает 1 · 10−4% (по массе).
Высоко чистым веществам в зависимости от количества и суммарной концентрации контролируемых примесей присваивают марки двух категорий: ВЭЧ («вещества эталонной чистоты») и ОСЧ («особо чистые вещества»). В веществах марки ВЭЧ лимитируется общее содержание примесей и содержание некоторых нежелательных примесей. В веществах марки ОСЧ лимитируется содержание большого числа нежелательных примесей.
В зарубежной литературе принято квалифицировать вещества по чистоте числом (n) атомов (молекул) примесей, приходящихся на: 1) 1000 атомов (молекул) основного вещества, что обозначают n%f (n promille); 2) 106 атомов (молекул) основного вещества, n ppm (n parts per million); 3) 109 атомов (молекул) основного вещества, n ppb (n parts per billion). Кроме такой квалификации для обозначения веществ высокой степени чистоты используют символ N и различают вещества по качеству цифровыми индексами.
До сих пор речь шла о химической чистоте вещества. Однако понятие чистоты вещества значительно шире. В частности, в электронной технике при использовании полупроводников важна не только степень химической чистоты, но и отсутствие собственных дефектов в кристаллической решетке. Эти дефекты, так же как и химические примеси, сильно влияют на свойства полупроводников. Следует отметить, что концентрации собственных дефектов («физическая» чистота) и примесей (химическая чистота) взаимосвязаны, поскольку структурное совершенство кристаллов во многом зависит от наличия примесей в кристаллической решетке, а предел химической чистоты кристалла часто определяется типом и количеством собственных дефектов, образующихся при выращивании.
192 Глава 5. Получение чистых полупроводниковых материалов
Итак, получение чистых полупроводниковых материалов производится химическими и металлургическими методами. Химическая очистка, например, германия и кремния заключается в получении их летучих соединений (как правило, галогенидов, см. гл. 6), которые легко отделяются от примесей и их соединений, а затем в восстановлении предварительно очищенных летучих соединений до элементарных Ge и Si. Металлургические методы заключаются в многократной перекристаллизации слитка основного вещества путем последовательного расплавления его участков. В этом курсе мы не будем рассматривать химические методы очистки веществ, так как они специфичны для каждого вещества, а остановимся на металлургических (кристаллизационных) методах очистки, при которых вещество может очищаться в процессе его выращивания. Кристаллизационные методы очистки основаны на различии содержания примесей в жидкой и твердой фазах, находящихся в равновесии при данной температуре (см. рис. 5.1). Следствием этого свойства является оттеснение примеси к концу слитка или ее захват в начальных частях слитка в ходе кристаллизации, то есть очистка вещества от примеси в любом случае.
В полупроводниковой технологии кристаллизация из жидкой фазы, как правило, применяется на последнем этапе технологического процесса очистки вещества. При этом наряду с высокой степенью очистки материала от примесей достигается и необходимое совершенство кристаллической структуры, то есть в конечном счете полупроводники получают в виде высокочистых монокристаллов.
Ge и Si — это два важнейших полупроводниковых элемента. Их способность к взаимодействию друг с другом и с другими химическими элементами имеет большое значение для электронной промышленности, поэтому процессы очистки мы будем рассматривать на их примере. Для разработки методов кристаллизационной очистки вещества необходимо знание фазовой диаграммы состояния вещества с присутствующими в нем примесями. Ge и Si кристаллизуются в кубической структуре типа алмаза и могут образовывать неограниченные твердые растворы только с немногочисленными элементами, которые также имеют структуру типа алмаза и атомные радиусы не сильно отличающиеся от атомных радиусов Ge и Si. Как правило, растворимость большинства примесей в Ge и Si очень невелика (≈0.1 ат.%). Кроме того, как уже упоминалось, кристаллизационные методы применяются на конечной стадии процесса очистки, а содержание остаточных примесей в очищаемом веществе настолько мало, что их взаимное влияние или взаимодействие между собой в среде основного материала практически отсутствует. Все это позволя-
5.1. Кристаллизационные методы очистки |
193 |
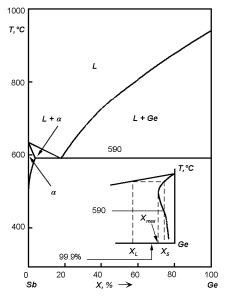
Рис. 5.1. Диаграмма состояния системы Ge–Sb.
ет при описании кристаллизационных методов очистки заменить одну сложную многокомпонентную систему совокупностью фазовых диаграмм бинарных систем: основной компонент — примесь.
Для бинарных систем диаграммы плавления–затвердевания, как уже обсуждалось ранее, весьма разнообразны и сложны. На рис. 5.1 приведена типичная диаграмма полупроводниковой системы: диаграмма состояния системы Ge–Sb. Однако для небольших концентраций примеси в полупроводнике все сложные диаграммы можно свести к двум типам без потери общности рассуждений при описании процессов кристаллизационной очистки. Действительно, в области малых концентраций примеси, то есть в области, примыкающей к точке плавления чистого компонента, различия между разными типами фазовых диаграмм пропадают: линии ликвидуса L и солидуса S в этих областях можно аппроксимировать прямыми линиями, касательными к кривым L и S в точке плавления основного компонента (рис. 5.2). В результате имеем два типа диаграмм: 1) если прямые L и S направлены вверх, то примесь понижает температуру плавления (рис. 5.2,а); 2) если прямые направлены вниз, то примесь повышает температуру плавления (рис. 5.2,б).
Для фиксированной температуры, при которой в системе сосуществуют жидкая и твердая фазы, концентрации примеси в кристалле и в жид-

194 Глава 5. Получение чистых полупроводниковых материалов
Рис. 5.2. Аппроксимация участка фазовых диаграмм вблизи точки плавления основного компонента отрезками прямых, касательных к кривым солидуса S и ликвидуса L в точке плавления основного компонента TA: а — примесь, понижающая температуру плавления; б — примесь, повышающая температуру плавления.
кости оказываются различными: концентрация примеси в твердой фазе CS определяется по абсциссе точки пересечения коноды с линией солидуса, а концентрация примеси в жидкой фазе CL — по абсциссе точки пересечения коноды с линией ликвидуса (рис. 5.2). В случае, когда примесь понижает температуру плавления, CS оказывается меньше CL (рис. 5.2,а), а в случае, когда примесь повышает температуру плавления, CS > CL (рис. 5.2,б). В процессе кристаллизации примесь будет либо оттесняться в расплав (в первом случае), либо захватываться кристаллом (во втором случае).
Действительно, для любой температуры из интервала, соответствующего области сосуществования жидкой и твердой фаз, концентрации основного вещества и примеси в этих фазах различны. Тем не менее, в равновесных условиях кристаллизации после завершения процесса весь закристаллизовавшийся слиток должен иметь состав, равный составу расплава (см. гл. 4). Соответственно этому не должно возникать никаких закономерных неоднородностей состава в кристаллизующемся материале, то есть в результате перекристаллизации никакой очистки твердой фазы не происходит. Однако в реальных условиях выращивания кристаллов твердая фаза кристаллизуется неоднородной по своему составу. Это происходит из-за медленных диффузионных процессов выравнивания со-
5.2. Коэффициент разделения примесей |
195 |
става в твердой фазе (предполагают, что равновесие в жидкой фазе и на границе раздела фаз успевает непрерывно устанавливаться, а диффузия в твердой фазе идет настолько медленно, что изменениями в составе твердой фазы можно пренебречь). Кроме того, при выращивании кристаллов создают такие градиенты температур, при которых нарастающие слои твердой фазы попадают в область с пониженной температурой, что также снижает скорость диффузионного выравнивания состава. Все эти процессы приводят к фиксации неоднородностей состава, возникающих в твердой фазе, и к очистке веществ при кристаллизации.
Если затруднена диффузия в жидкой фазе, то на границе раздела фаз в ходе процесса будет увеличиваться избыток компонента, которым обеднена образующаяся твердая фаза, и недостаток компонента, которым твердая фаза обогащена. Кристаллизация твердой фазы при этом будет происходить не из основной массы жидкой фазы, а из прилегающего к фронту кристаллизации слоя, что приводит к снижению эффекта очистки. Таким образом, затрудненность диффузии компонентов в жидком состоянии снижает эффективность очистки при кристаллизации. Еще одним важнейшим фактором, влияющим на эффективность очистки, являются условия проведения кристаллизации, которые должны обеспечивать монокристалличность получаемого материала.
5.2. Коэффициент разделения примесей
Для оценки эффективности очистки веществ от примесей кристаллизацией из расплава служит коэффициент разделения K, представляющий собой отношение концентрации растворенного вещества в твердой фазе к его концентрации в жидкой фазе:
K = CS/CL. |
(5.1) |
Значение K может быть больше или меньше 1. Если примесь понижает температуру плавления вещества, то K < 1, что часто встречается на практике. В обратном случае, когда примесь повышает температуру плавления вещества, K > 1. Этот случай в технологии полупроводников встречается сравнительно редко. Значение K может изменяться в широких пределах от величины менее 10−6 до величины более 10. Величина K определяется типом фазовой диаграммы основного компонента и примеси и зависит от условий кристаллизации (скорости перемещения фронта кристаллизации, интенсивности перемешивания расплава и т. д.). Величина K играет большую роль в кристаллизационных способах очистки.

196 Глава 5. Получение чистых полупроводниковых материалов
Различают равновесный и эффективный коэффициенты разделения.
5.2.1. Равновесный коэффициент разделения
С помощью равновесного коэффициента разделения K0 характеризуют эффект разделения компонентов смеси в каждый момент равновесия между кристаллом и расплавом. Его называют равновесным именно потому, что он отражает состав фаз на диаграмме состояния, построенной в близких к равновесию условиях, то есть при достаточно малых скоростях кристаллизации. В этом случае концентрация примеси, растворенной в расплаве CL, одинакова во всем объеме расплава, а ее концентрация в закристаллизовавшейся части CL = K0CS.
Как можно видеть из рис. 5.2, в пределах прямолинейности L и S линий K0 не зависит от концентрации и температуры, то есть является постоянной величиной для данной пары веществ (это следует из подобия прямоугольных треугольников, построенных на отрезках CS и CL при разных температурах кристаллизации). Однако при достаточно высоких концентрациях примеси, когда линии S и L нельзя аппроксимировать прямыми, K0 уже не будет постоянной величиной и будет зависеть от концентрации примеси.
Точный расчет K0 на основе фазовых диаграмм часто затруднен, поскольку во многих случаях имеющиеся фазовые диаграммы недостаточно точны в области малых концентраций примеси. Фазовые диаграммы поэтому часто используются только для примерной оценки K0 (K0 > 1 или K0 < 1), что позволяет принципиально оценить поведение примеси в условиях очистки вещества кристаллизационными методами.
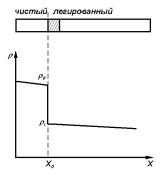
Наиболее распространенный метод определения коэффициента разделения основан на измерении концентрации свободных носителей заряда в чистом и легированном полупроводнике (предполагается, что примеси электрически активны). Схема определения непосредственно вытекает из самого смысла K0 = CS/CL, то есть сводится к определению концентрации примеси в твердой фазе, соответствующей ее заданной концентрации в жидкой фазе. Пусть навеска электрически активной примеси pi вводится в расплав предварительно очищенного слитка при положении X0 фронта кристаллизации1 (рис. 5.3; кристаллизация полупроводникового материала проводится методом зонной плавки (см. ниже)). Если концентрация введенной примеси Ni = CS заметно превышает разность
1Движущаяся граница между твердой и жидкой фазами называется фронтом кристаллизации.
5.2. Коэффициент разделения примесей |
197 |
Рис. 5.3. Изменение удельного сопротивления ρ по длине слитка, в который в точке X0 добавлена примесь.
концентраций остаточных примесей |Nd0 − Na0| в чистом материале, то граница, отделяющая чистый и легированный материал, может быть надежно выявлена по изменению удельного сопротивления материала ρ (рис. 5.3). Вырезав два образца из участков кристалла, прилегающих к границе легирования, и измерив в них коэффициент Холла, можно определить концентрации носителей заряда в нелегированном (n0 или p0) и легированном (n или p) образцах. Считая для простоты примеси однозарядными и полностью ионизованными при температуре измерений, можно определить концентрацию Ni введенной примеси из следующих соотношений:
1. Если нелегированный образец n-типа, то при введении донорной или акцепторной примесей имеем соответственно
Nd = n − n0; Na = p + n0. |
(5.2) |
2. Если нелегированный образец p-типа, то для тех же примесей име-
ем |
|
Nd = n + p0; Na = p − p0. |
(5.3) |
Определение CL сводится к расчету атомных долей примеси, введенной в объем VL расплава навеской pi примеси. Объем VL определяется из измеренного объема твердой легированной части кристалла с учетом теплового расширения и изменения плотности вещества при плавлении (например, для Ge объемный коэффициент теплового расширения равен 18 ·10−6, а уменьшение объема при плавлении составляет 5.5%; для Si — 12 · 10−6 и 9% соответственно).
Если Mi — атомный вес примесного элемента, выраженный в граммах, а NA — число Авогадро, то NApi/Mi — число примесных атомов в
198 |
Глава 5. Получение чистых полупроводниковых материалов |
|
заданной навеске. Тогда |
|
|
|
CL = (NApi)/(MiVL), |
(5.4) |
|
K = CS/CL = (NiMiVL)/(NApi). |
|
|
|
|
|
Определенные таким способом коэффициенты разделения точны при |
|
следующих условиях: 1) CS = Ni, то есть все атомы примеси электрически активны (обычно соблюдается в пределах растворимости примесей); 2) K = K0, то есть не отличается от оцениваемых из равновесных диаграмм состояния сплавов и K не зависит от V — скорости движения фронта кристаллизации (обычно это имеет место при V < 1 мм/ч) и других условий кристаллизации.
Рассмотрим значения K0 для различных примесей в Ge и Si. На рис. 5.4 эти значения сопоставлены с ковалентными радиусами примесных атомов. Видно, что в Ge лишь две примеси — Si и B — имеют K0 > 1; Tпл. обоих элементов более высокие, чем у Ge. Оба элемента имеют ковалентные радиусы rk меньшие, чем у Ge, и это объясняет легкость их вхождения в решетку. У остальных примесей третьей, четвертой и пятой групп значения K0 резко падают с ростом rk. Общая черта подавляющего числа примесей этих групп — K0 < 1 и, как правило, в этом случае Tпл примесей меньше, чем Tпл германия.
Для Si характерны те же закономерности, однако сами значения K0 примесей, естественно, другие. Обращает внимание K0 ≈ 1 у примеси бора, имеющее далеко идущие последствия в технологии очистки Si.
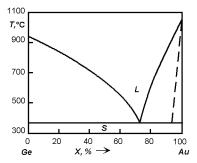
Однако следует заметить, что K0 1 в Ge и Si имеют и примеси, Tпл которых выше, чем у основного вещества. Примером может служить Au (Tпл = 1063◦С) в Ge. Этот случай реализуется, как правило, когда диаграмма состояния системы полупроводник–примесь относится к диаграммам состояния с ограниченной растворимостью компонентов друг в друге. Рассмотрим диаграмму состояния системы Ge–Au, показанную на рис. 5.5. Из рисунка следует, что с ростом содержания Au в интервале 0–73% Tпл сплава понижается до 365◦С, то есть становится меньше, чем TплGe, и лишь затем снова повышается. Линиями солидуса на диаграмме состояния вблизи Ge будут эвтектическая горизонталь (365◦С) и линия вблизи чистого германия, которая не изображена на рис. 5.5 из-за малой растворимости Au в твердом Ge (в линейном масштабе она вырождается
ввертикальную линию). Известно, что максимальная растворимость Au
втвердом Ge не превышает 1.5·1016 см−3, то есть составляет 4·10−5 ат.% при температуре T = 921◦С. Если сопоставить это значение с соответ-
ствующим значением концентрации Au в Ge на линии ликвидуса, то K0 получится тот же, что показан на рис. 5.4, то есть ≈ 10−5.

5.2. Коэффициент разделения примесей |
199 |
Рис. 5.4. Зависимости коэффициентов разделения примесей в точке плавления Si (сверху) и Ge (снизу) от тетраэдрических радиусов примесных атомов [32].
200 Глава 5. Получение чистых полупроводниковых материалов
Рис. 5.5. Диаграмма состояния системы Ge–Au.
Таким образом, следует еще раз подчеркнуть, что равновесный коэффициент разделения K0 определяется видом фазовой диаграммы, а в конечном счете — свойствами взаимодействующих атомов.
Обращает на себя внимание тот факт, что для всех переходных металлов (Fe, Co, Mn, Ni) в Ge и Si характерны очень малые K0 ≈ 10−5–10−6, точность определения которых, естественно, не может быть высокой. Все эти примеси, включая Au и Ag, относятся к разряду «глубоких» и даже в малых концентрациях оказывают сильное влияние на времена жизни неравновесных носителей заряда. Отделим эту группу примесей от группы «мелких» водородоподобных примесей. В дальнейшем будем особо рассматривать условия их вхождения в решетку, их диффузию и растворимость.
Для полупроводниковых соединений характерен тот же интервал значений K0, что и для Ge и Si, но большее количество примесей имеет K0 > 1 и корреляция коэффициентов разделения с ковалентными радиусами примесей более слабая. Очистка полупроводниковых соединений сопряжена с большими трудностями, чем очистка элементарных полупроводников. Поэтому обычно очистку соединений начинают с очистки входящих в соединение компонентов, а затем производят синтез предварительно очищенных компонентов. Суммарное содержание остаточных примесей в исходных материалах обычно составляет величину ≈10−4–10−5%. Часто синтез совмещают с последующей дополнительной очисткой соединения путем направленной или зонной кристаллизации расплава (см. ниже). Однако, как правило, даже в чистом с химической точки зрения соединении остаются собственные дефекты, возникающие из-за отклонения состава от стехиометрического (неточности в соотношении числа атомов компонентов в соединении относительно формульного состава). К таким соединениям относятся, например, соединения
