
- •Лабораторный практикум по физико-химическим методам анализа
- •Часть 1. Спектральные методы анализа
- •Рекомендовано научно-методическим советом университета в качестве учебного пособия
- •© Ярославский государственный технический университет, 2006
- •1 Фотометрический метод анализа
- •1.1 Теоретические основы
- •1.2 Блок-схема фотоколориметра кфк-2
- •1.3 Порядок работы на фотоколориметре кфк-2
- •1.4 Блок- схема установки монохроматора ум-2
- •1.5 Порядок титрования на ум-2
- •Лабораторная работа № 1 фотометрический анализ красителей по методу собственного поглощения
- •Лабораторная работа № 2 анализ смеси красителей с непересекающимися спектрами на фотоколориметре кфк-2
- •Красителей в анализируемой смеси
- •Лабораторная работа № 3 анализ смеси красителей с пересекающимися спектрами на фотоколориметре кфк-2
- •Экстинкции анализируемых веществ
- •Лабораторная работа № 4 определение хрома дифенилкарбазидным методом
- •Лабораторная работа № 5 определение железа в виде трисульфосалицилата
- •Лабораторная работа № 6 определение меди методом дифференциальной фотометрии
- •Вопросы к отчету по теме «Фотометрический метод анализа»
- •Дополнительные вопросы
- •Лабораторная работа № 7 фотометрическое титрование солей железа с сульфосалициловой кислотой
- •Вопросы к отчету по лабораторной работе «Фотометрическое титрование на фотоколориметре кфк-2»
- •Лабораторная работа № 8 фотометрическое титрование смеси протолитов на монохроматоре ум-2
- •Вопросы к отчету по лабораторной работе «Фотометрическое титрование смеси протолитов на монохроматоре ум-2»
- •2 Турбидиметрический метод анализа
- •Теоретические основы
- •Лабораторная работа № 9 турбидиметрический анализ сульфат-ионов
- •Вопросы к отчету по лабораторной работе «Турбидиметрический анализ сульфат-ионов»
- •3 Абсорбционная спектроскопия
- •3.2 Использование спектров поглощения для определения константы диссоциации кислотно-основных индикаторов
- •При различном положении равновесия
- •3.3 Блок-схема однолучевого спектрального прибора
- •3.4 Порядок работы на однолучевом спектрофотометре ум-2
- •Блок-схема двухлучевого спектрофотометре сф-10
- •3.6 Порядок работы на спектрофотометре сф-10
- •Лабораторная работа № 10 запись спектров поглощения на однолучевом спектрофотометре
- •Анализ смеси невзаимодействующих красителей с пересекающимися спектрами на однолучевом спектрофотометре ум-2
- •Лабораторная работа № 12 анализ смеси невзаимодействующих красителей с пересекающимися спектрами на двухлучевом спектрофотометре сф-10
- •Вопросы к отчету по работе
- •Вопросы к отчету по работе
- •4 Инфракрасная спектроскопия
- •4.1 Теоретические основы
- •Связь с-н в метане
- •И деформационных колебаний
- •4.2 Расшифровка инфракрасных спектров
- •4.3 Блок-схема спектрометра мом-2000
- •4.4 Порядок включения и записи спектров на спектрометре мом-2000
- •Лабораторная работа № 14 идентификация органических соединений методом инфракрасной спектроскопии
- •Вопросы к отчету по работе
- •5 Пламенная фотометрия
- •5.1 Теоретические основы
- •5.2. Схема пламенного фотометра
- •Вопросы к отчету по лабораторной работе
- •Дополнительные вопросы
- •6 Кинетические методы анализа
- •6.1 Теоретические основы
- •Скорость химической реакции зависит от следующих факторов:
- •В кинетических методах анализа используются различные методы определения концентрации. Среди них выделяют три основные группы методов:
- •По методу тангенсов:
- •По методу тангенсов
- •4) Используя градуировочный график, определяют концентрацию анализируемого вещества в пробе.
- •По методу фиксированного времени
- •Метод фиксированной концентрации
- •По методу фиксированной концентрации
- •По методу добавок
- •В основе определения концентрации тиосульфат-иона лежит окислительно-восстановительная реакция:
- •Индикаторным веществом является роданид аммония, катализатором – соли меди (CuSo4).
- •По методу тангенсов
- •Анализируемого вещества
- •Вопросы к отчету по лабораторной работе
- •Библиографический список
- •Оглавление
- •Учебное издание
- •Лабораторный практикум по физико-химическим методам анализа
- •Часть 1. Спектральные методы анализа
- •План 2005
- •150023, Ярославль, Московский пр., 88
- •150028, Ярославль, ул. Советская, 14а
- •Ярославль 2006
5.2. Схема пламенного фотометра
Схема пламенного фотометра представлена на рисунке 5.1.
8 9 10 11
12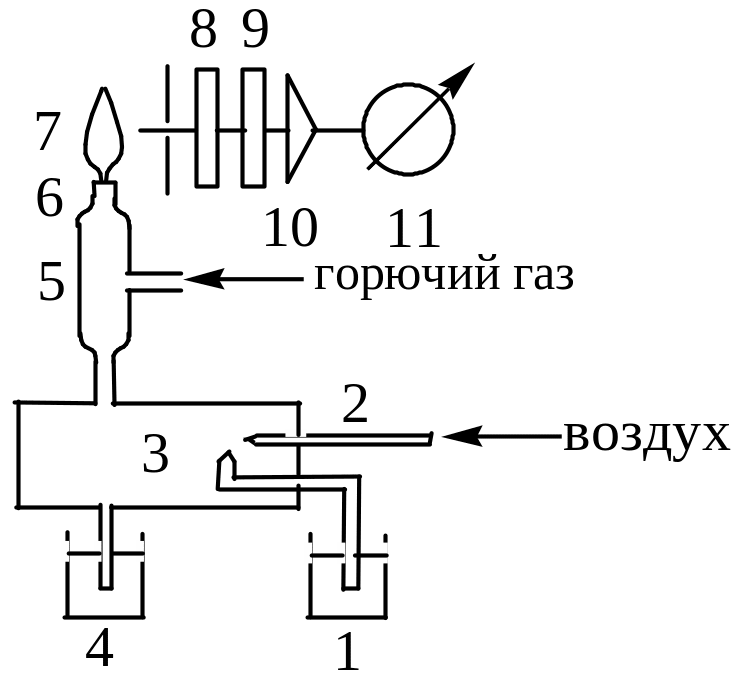
Рисунок 5.1 - Схема пламенного фотометра ПФЛ-1:
1 – стаканчик с раствором; 2- распылитель; 3 – распылительная камера; 4 – водяной затвор; 5 – смесительная камера; 6 – горелка; 7 – пламя; 8 – входная щель; 9 – светофильтр; 10 – фотоэлемент; 11 – усилитель;
12 – гальванометр
В качестве монохроматора в приборе использованы три сменных светофильтра, полосы пропускания которых соответствуют аналитическим спектральным линиям натрия, калия и кальция [1, табл. 8]. Полосы пропускания светофильтров являются достаточно узкими. Светофильтры пропускают излучение аналитической линии определяемого элемента и поглощают излучение других элементов.
В качестве аналитического сигнала при количественном анализе в пламенной фотометрии используются показания гальванометра 12, расположенного на передней панели прибора. Гальванометр измеряет ток фотоэлемента 10, который зависит от интенсивности спектральной линии и, в свою очередь, от концентрации анализируемого раствора.
5.3 Порядок работы на пламенном фотометре
1) Фотометр включает лаборант за 10 минут до начала работы.
2) Устанавливают светофильтр, соответствующий анализируемому элементу, поворачивая рычаг на правой стенке прибора.
3) Проводят калибровку прибора. Для выполнения калибровки необходимо подготовить стандартные растворы.
Лабораторная работа № 15
ОПРЕДЕЛЕНИЕ ЭЛЕМЕНТОВ
МЕТОДОМ ПЛАМЕННОЙ ФОТОМЕТРИИ
Цель работы: |
определение концентрации ионов Na+, K+, Ca2+ в анализируемой смеси. |
Реактивы: |
стандартные растворы хлоридов натрия, калия, кальция. |
Посуда: |
мерные колбы вместимостью 50 см3 (13 шт.), капельница, пробки. |
Выполнение работы:
Готовят серии стандартных растворов солей каждого определяемого элемента с различными фиксированными концентрациями, внося в мерные колбы на 50 см3 заданный лаборантом объем исходного раствора. Объем растворов доводят дистиллированной водой до метки. Растворы в колбах тщательно перемешивают.
Пробу для анализа студенты получают у лаборанта в мерной колбе и также доводят до метки дистиллированной водой.
Заполняют нумерованные стаканчики приготовленными стандартными, анализируемыми растворами и дистиллированной водой.
Устанавливают светофильтр, соответствующий анализируемому элементу, поворачивая рычаг на правой стенке прибора.
Трубку распылителя опускают в стаканчик с дистиллированной водой и с помощью ручки гальванометра, расположенной на передней панели прибора слева, устанавливают стрелку гальванометра на ноль.
Трубку распылителя опускают в стаканчик с самым концентрированным раствором, при этом стрелка прибора отклоняется вправо. С помощью правой ручки гальванометра устанавливают стрелку в положение, соответствующее делению шкалы 80-90. Повторяют процедуру 3-4 раза. Такая методика гарантирует от зашкаливания прибора при дальнейших измерениях, т.к. все растворы с меньшей концентрацией соответствуют показаниям прибора между нулем и максимальным показанием гальванометра.
Снимают показания гальванометра для остальных растворов анализируемого элемента в порядке снижения концентрации. Затем снимают показания гальванометра анализируемой смеси. Результаты заносят в таблицу 1.
По полученным экспериментальным данным строят калибровочный график. Для этого по оси абсцисс откладывают значения концентрации растворов в единицах мг/мл, по оси ординат – соответствующие значения показаний гальванометра.
По калибровочному графику определяют концентрацию ионов анализируемого металла.
Повторяют измерения с п.3 по п.7 для других солей.
Для непрерывного контроля результатов рекомендуется наносить значения концентрации и показания прибора на калибровочный график одновременно с записью в таблицу. В этом случае можно проверить точки, выпавшие из графической зависимости, вновь установив стаканчик с раствором для измерения.
Расчет результатов анализа
1) Расчет концентрации приготовленных стандартных растворов солей
,
где Сисх.ст. р-ра – концентрация исходного стандартного раствора соли в склянке, мг/мл; Сст. – концентрация, приготовленного раствора в колбе, мг/мл; Vисх.ст.р-ра – объем исходного стандартного раствора, отмеренный по бюретке, мл; Vк – объем колбы, мл.
2) Экспериментальные результаты заносят в таблицу 1.
Таблица 1 – Результаты эксперимента
№ колбы |
Показания гальванометра |
|||||
Na |
K |
Ca |
||||
C, мг/мл |
J, мА |
C, мг/мл |
J, мА |
C, мг/мл |
J, мА |
|
1 2 3 4 |
|
|
|
|
|
|
Анализир. раствор |
|
|
|
|
|
|
Построение калибровочного графика и определение концентрации металла в анализируемом растворе.
Калибровочный график строится по результатам, приведенным в таблице 1.
мг/мл
J,
мА
Jx
J1
Результат проверяют у преподавателя или лаборанта, оформляют отчет по выполненной работе.
