
- •Лабораторный практикум по физико-химическим методам анализа
- •Часть 1. Спектральные методы анализа
- •Рекомендовано научно-методическим советом университета в качестве учебного пособия
- •© Ярославский государственный технический университет, 2006
- •1 Фотометрический метод анализа
- •1.1 Теоретические основы
- •1.2 Блок-схема фотоколориметра кфк-2
- •1.3 Порядок работы на фотоколориметре кфк-2
- •1.4 Блок- схема установки монохроматора ум-2
- •1.5 Порядок титрования на ум-2
- •Лабораторная работа № 1 фотометрический анализ красителей по методу собственного поглощения
- •Лабораторная работа № 2 анализ смеси красителей с непересекающимися спектрами на фотоколориметре кфк-2
- •Красителей в анализируемой смеси
- •Лабораторная работа № 3 анализ смеси красителей с пересекающимися спектрами на фотоколориметре кфк-2
- •Экстинкции анализируемых веществ
- •Лабораторная работа № 4 определение хрома дифенилкарбазидным методом
- •Лабораторная работа № 5 определение железа в виде трисульфосалицилата
- •Лабораторная работа № 6 определение меди методом дифференциальной фотометрии
- •Вопросы к отчету по теме «Фотометрический метод анализа»
- •Дополнительные вопросы
- •Лабораторная работа № 7 фотометрическое титрование солей железа с сульфосалициловой кислотой
- •Вопросы к отчету по лабораторной работе «Фотометрическое титрование на фотоколориметре кфк-2»
- •Лабораторная работа № 8 фотометрическое титрование смеси протолитов на монохроматоре ум-2
- •Вопросы к отчету по лабораторной работе «Фотометрическое титрование смеси протолитов на монохроматоре ум-2»
- •2 Турбидиметрический метод анализа
- •Теоретические основы
- •Лабораторная работа № 9 турбидиметрический анализ сульфат-ионов
- •Вопросы к отчету по лабораторной работе «Турбидиметрический анализ сульфат-ионов»
- •3 Абсорбционная спектроскопия
- •3.2 Использование спектров поглощения для определения константы диссоциации кислотно-основных индикаторов
- •При различном положении равновесия
- •3.3 Блок-схема однолучевого спектрального прибора
- •3.4 Порядок работы на однолучевом спектрофотометре ум-2
- •Блок-схема двухлучевого спектрофотометре сф-10
- •3.6 Порядок работы на спектрофотометре сф-10
- •Лабораторная работа № 10 запись спектров поглощения на однолучевом спектрофотометре
- •Анализ смеси невзаимодействующих красителей с пересекающимися спектрами на однолучевом спектрофотометре ум-2
- •Лабораторная работа № 12 анализ смеси невзаимодействующих красителей с пересекающимися спектрами на двухлучевом спектрофотометре сф-10
- •Вопросы к отчету по работе
- •Вопросы к отчету по работе
- •4 Инфракрасная спектроскопия
- •4.1 Теоретические основы
- •Связь с-н в метане
- •И деформационных колебаний
- •4.2 Расшифровка инфракрасных спектров
- •4.3 Блок-схема спектрометра мом-2000
- •4.4 Порядок включения и записи спектров на спектрометре мом-2000
- •Лабораторная работа № 14 идентификация органических соединений методом инфракрасной спектроскопии
- •Вопросы к отчету по работе
- •5 Пламенная фотометрия
- •5.1 Теоретические основы
- •5.2. Схема пламенного фотометра
- •Вопросы к отчету по лабораторной работе
- •Дополнительные вопросы
- •6 Кинетические методы анализа
- •6.1 Теоретические основы
- •Скорость химической реакции зависит от следующих факторов:
- •В кинетических методах анализа используются различные методы определения концентрации. Среди них выделяют три основные группы методов:
- •По методу тангенсов:
- •По методу тангенсов
- •4) Используя градуировочный график, определяют концентрацию анализируемого вещества в пробе.
- •По методу фиксированного времени
- •Метод фиксированной концентрации
- •По методу фиксированной концентрации
- •По методу добавок
- •В основе определения концентрации тиосульфат-иона лежит окислительно-восстановительная реакция:
- •Индикаторным веществом является роданид аммония, катализатором – соли меди (CuSo4).
- •По методу тангенсов
- •Анализируемого вещества
- •Вопросы к отчету по лабораторной работе
- •Библиографический список
- •Оглавление
- •Учебное издание
- •Лабораторный практикум по физико-химическим методам анализа
- •Часть 1. Спектральные методы анализа
- •План 2005
- •150023, Ярославль, Московский пр., 88
- •150028, Ярославль, ул. Советская, 14а
- •Ярославль 2006
Вопросы к отчету по лабораторной работе
Принципы анализа, основанного на спектрах испускания. Природа линейчатых спектров. Атомный пар.
Различные способы возбуждения атомов.
Метод пламенной фотометрии, область его применения.
Назначение светофильтров, качественный анализ
Методы количественного анализа (метод калибровочного графика, метод внутреннего стандарта, метод добавок).
Схема прибора и принцип его действия.
Дополнительные вопросы
Устройство газовых горелок.
Структура пламени, процессы, протекающие в пламени.
Основные характеристики атомных спектральных линий: частота, интенсивность, ширина.
6 Кинетические методы анализа
6.1 Теоретические основы
В кинетических методах анализа концентрация анализируемого вещества определяется по скорости химической реакции. Основным законом химической кинетики является закон действия масс, в соответствии с которым скорость химической реакции пропорциональна произведению концентраций реагирующих веществ:
А + В = Х
 – в
начальный момент времени, (6.1)
– в
начальный момент времени, (6.1)
 – в
любой момент времени,
– в
любой момент времени,
где V – скорость реакции, К – константа скорости.
В кинетических методах анализа аналитическую реакцию, по скорости которой определяют концентрацию анализируемого вещества, называют индикаторной (по аналогии с индикатором в титриметрических методах анализа или индикаторным электродом в электрохимических методах анализа).
Например: скорость реакции восстановления железа (III) тиосульфат ионом
(CNS–)
Fe3+
+ 2S2O32–
![]() 2Fe2+
+ S4O62–
2Fe2+
+ S4O62–
зависит от концентрации иона S2O32–, т.е. она является индикаторной для этого иона.
Вещество, по изменению концентрации которого опытным путём находят концентрацию анализируемого вещества, называют индикаторным веществом. В приведённой реакции – это железо (III).
Требования к индикаторным реакциям:
1) Скорость реакции должна быть не слишком большой и не слишком медленной. Оптимальное время протекания реакции 10- 20 мин.
2) Концентрация индикаторного вещества должна измеряться быстрым и простым методом.
3) Концентрация анализируемого вещества во времени проведения реакции не должна существенно изменяться. Как правило, его берут в большом избытке по сравнению с индикаторным веществом. Так концентрация S2O32– должна превышать концентрацию Fe3+ в несколько раз.
Скорость химической реакции зависит от следующих факторов:
энергии активации взаимодействующих молекул и их ориентации в пространстве (столкновения молекул)
![]() ,
,
где Q – стерический фактор, учитывающий ориентацию молекул при химическом взаимодействии; z – общее число соударений; Е – энергия активации, Дж; Т – абсолютная температура, К; R – газовая постоянная;
2) температуры, а именно: скорость реакции увеличивается с увеличением температуры.
![]() .
.
3) присутствия посторонних солей
![]() ,
,
где К0 – константа скорости в отсутствии посторонних солей,
![]() –
заряды, реагирующих частиц А и В,
–
заряды, реагирующих частиц А и В,
μ – ионная сила раствора.
Скорость реакции будет увеличиваться, если заряды у частиц А и В одноимённые, и уменьшаться, если заряды разноимённые.
4) присутствия катализатора.
Реакции, скорость которых зависит от концентрации катализатора, называются каталитическими. Они находят широко применение в кинетических методах реакции.
Для каталитических реакций в уравнение скорости следует ввести концентрацию катализатора (СК):
![]()
при условии, что концентрация одного из веществ взята в избытке.
![]()
![]() и
и
![]() ,
,
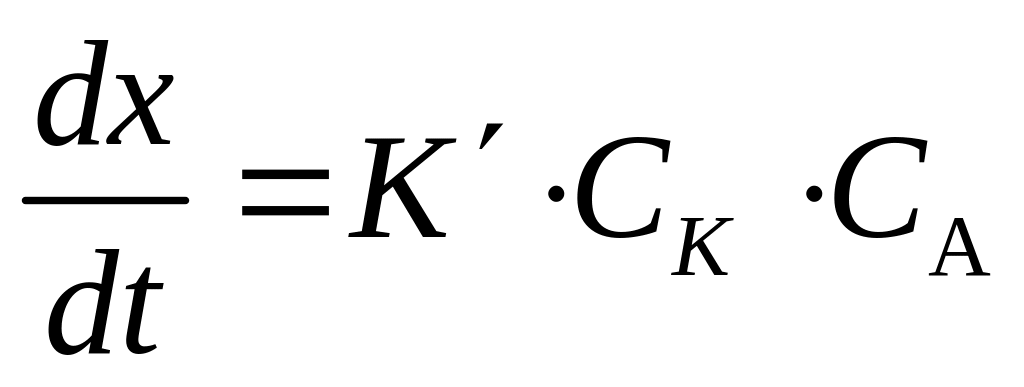 ;
;
![]() .
.
Методы анализа, основанные на применении этого уравнения, называются дифференциальными. Если проинтегрировать это выражение, можно получить уравнение для интегральных методов:
 .
.
Для измерения скорости реакции необходимо знать изменение во времени концентрации хотя бы одного из реагирующих (обычно индикаторного) веществ. С этой целью применяются химические и физико-химические методы анализа.
Химические методы анализа в основном используются для изучения медленно протекающих реакций. При изучении быстрых реакций, следует остановить их течение, что достигается следующими способами:
- резким охлаждением реакционной смеси,
- добавлением ингибитора, образующего прочное соединение с катализатором,
- добавлением вещества, связывающего одно из реагирующих веществ
- резким изменением рН.
После того как реакция остановлена, анализируют реакционную смесь подходящим химическим или физико-химическим методом анализа. Наиболее часто применяются титриметрические методы анализа: кислотно-основный, окислительно-восстановительный, комплексометрический или метод осаждения.
Достоинством химических методов анализа является измерение абсолютных концентраций реагирующих веществ. К недостаткам следует отнести: а) невозможность непрерывного измерения концентрации анализируемого компонента, б) продолжительность анализа.
Физико-химические методы анализа позволяют проследить за изменением какого-либо физического свойства анализируемого раствора во времени, например, показателя преломления, электропроводности, силы диффузионного тока, абсорбции раствора и др. Основными преимуществами физико-химических методов по сравнению с химическими являются: а) непосредственное измерение концентрации анализируемого вещества в реакционном сосуде без отбора пробы, т.е. без нарушения химического равновесия в системе, б) быстрота проведения анализа.
