
- •1, Ньютонова форма уравн механики
- •3. Гамильтонова форма представления
- •2.Лагранжева форма уравн механики
- •11. Типы термодинамических систем и процессов. Первое начало термодинамики. Работа. Количество теплоты. Внутренняя энергия.
- •12. Второе начало термодинамики. Цикл Карно. Второе начало термодинамики в формулировке Клаузиуса и Кельвина. Круговые процессы. Тепловые машины. Теоремы Карно.
- •13. Энтропия. Энтропия идеального газа. Закон возрастания энтропии. Статистическое истолкование второго начала термодинамики. Теорема Нернста (третье начало термодинамики).
- •14.Термодинамические потенциалы закрытых и открытых термодинамических систем. Понятие обобщенных термодинамических координат и сил.
- •15. Статистические распределения (микроканоническое, каноческое и большое каноническое), их физический смысл и использование для нахождения термодинамических параметров.
- •16. Идеальный квантовый Ферми-газ. Распределение ферми-Дирака. Вырожденный электронный газ. Поверхность.
- •19. Фазовые превращения. Фазовые диаграммы. Уравнения Клапейрона-Клаузиуса.
- •17. Идеальный квантовый Бозе-газ. Распределение Бозе-Эйнштейна. Квантовая статистика фотонов и фононов, их термодинамические величины и уравнения состояния.
- •18. Неидеальный газ. Уравнение Ван-дер-Ваальса.
- •22. Электрический заряд. Закон Кулона. Электрическое поле. Потенциальность электрического поля
- •24. Стационарное магнитное поле. Закон Био-Савара-Лапласа. Закон Ампера. Сила Лоренца.
- •23. Электрическое поле в проводниках и диэлектриках. Энергия электрического поля.
- •25. Вихревой характер магнитного поля. Энергия магнитного поля. Магнитные свойства вещества.
- •26. Электрический ток. Уравнение непрерывности. Законы постоянного тока. Проводимость различных сред. Критерий квазистационарности.
- •27. Электромагнитное поле. Явление электромагнитной индукции. Вихревое электрическое поле и токи смещения
- •29. Основы специальной теории относительности.
- •30. Электромагнитные волны. Волновые уравнения и их решения. Плоская электромагнитная волна, её свойства и характеристики. Перенос энергии электромагнитными волнами.
- •20. Фазовые переходы первого и второго рода (поведения термодинамическое потенциалов и производных от них)
- •33. Интерференция света. Когерентность. Способы получения когерентных волн. Интерференция многих волн. Интерферометрия.
- •34. Дифракция света. Принцип Гюйгенса-Френеля. Дифракция Френеля и Фраунгофера. Дифракционная решётка. Физические основы голографии.
- •35. Поляризация света. Основные виды поляризации. Получение и преобразование поляризованного света. Поляризационные приборы
- •4)Призма Аренса.
- •37. Геометрическая оптика. Принцип Ферма. Центрированная оптическая система. Простейшие оптические приборы.
- •38. Принцип работы лазера и свойств лазерного излучения. Основы нелинейной оптики
- •39. Корпускулярно-волновой дуализм. Фотоны. Фотоэффект. Опыты Франка-Герца. Волны де Бройля. Дифракция микрочастиц. Связь между корпускулярными и волновыми свойствами
- •21. Флуктуации термодинамических величин. Распределения Гаусса. Корреляции основных термодинамических величин.
- •40.Квантование энергии атомов. Постулаты Бора. Модель атома Бора.
- •41. Атом водорода. Волновые функции и уровни энергии. Квантовые числа.
- •43.Атом во внешних полях. Эффект Зеемана. Эффект Штарка.
- •42.Строение сложных атомов. Принцип Паули и электронные оболочки. Физическое объяснение периодического з-на.
- •36. Распространение света в среде. Дисперсия и поглощение. Рассеяние света.
- •45.Принцип суперпозиции состояний в кв.Мех. Решение уравнения Шредингера для линейного осциллятора
- •48. Интегралы движения в кв. Мех. Элементы теории представлений.
- •46.Принцип причинности в кв. Мех. Временное уравнение Шредингера. Стационарные состояния.
- •47.Одновременное определение физ. В-н. Соотношение неопределенностей.
- •49.Квант переходы.Вероятности переходов.
- •50.Уравнение Дирака.
- •51.Общая характеристика атомных ядер.
- •52.Энергия связи ядра.
- •53.Явление радиоактивности.
- •57. Стандартная модель
- •54.Ядерные реакции
- •56.Фундаментальные взаимодействия.
42.Строение сложных атомов. Принцип Паули и электронные оболочки. Физическое объяснение периодического з-на.
Для решения атомных систем с большим числом электронов разработаны приближающие методы решения (метод самосогласованного поля). Можно считать, что в первом приближении электрон в некотором усредненном поле, к-ое складывается с поля, создаваемого ядром + поле всех электронов, и в этом приближении можно считать, что движение в таком поле никак не влияет на движение других электронов. Этот метод использовал Хартри, но он не учитывал наличие спинового электрона; учет спина сделал Фок и поле ф-ии с учетом спина назыв. ф-ией Хартри-Фока. Решив такую задачу получили, что любой электрон описывается четверкой квантовых чисел: (n,l,ml,ms), (n,l,j,mj)-эти четверки описывают состояние электрона в многоэлектронном атоме. Как заполняются состояния в многоэлектронном атоме? Вначале заполняется состояние с минимальной энергией, потом все остальные. А сколько м.б. электронов в состоянии? Это решается с помощью принципа запрета Паули. Он доказал, что для электронов (фермионов) в одном и том же квантовом состоянии в атомной системе (и в любой др. системе) не может находиться более одного электрона, т.е. в атоме не м.б. электронов с одинаковой четверкой квантовых чисел. Электронная оболочка атома — область пространства вероятного местонахождения электронов, характеризующихся одинаковым значением главного квантового числа n и, как следствие, располагающихся на близких энергетических уровнях. Каждая электронная оболочка может иметь определенное максимальное число электронов.Порядок заполнения электронных оболочек (орбиталей с одинаковым значением главного квантового числа n) определяется правилом Клечковского, порядок заполнения электронами орбиталей в пределах одного подуровня (орбиталей с одинаковыми значениями главного квантового числа n и орбитального квантового числа l) определяется Правилом Хунда.
Электронные оболочки обозначаются буквами K, L, M, N, O, P, Q или цифрами от 1 до 7. Подуровни оболочек обозначаются буквами s, p, d, f, g, h, i или цифрами от 0 до 6. Электроны внешних оболочек обладают большей энергией, и, по сравнению с электронами внутренних оболочек, находятся дальше от ядра, что делает их более важными в анализе поведения атома в химических реакциях и в роли проводника, так как их связь с ядром слабее и легче разрывается.Каждая оболочка состоит из одного или нескольких подуровней, каждый из которых состоит из атомных орбиталей. К примеру, первая оболочка (K) состоит из одного подуровня «1s». Вторая оболочка (L) состоит из двух подуровней, 2s и 2p. Третья оболочка — из «3s», «3p» и «3d».Валентная оболочка — самая внешняя оболочка атома. Электроны этой оболочки зачастую неверно называют валентными электронами, то есть электронами, определяющими поведение атома в химических реакциях. С точки зрения химической активности, наименее активными считаются атомы, в которых валентная оболочка окончательно заполнена (инертные газы). Наибольшей химической активностью обладают атомы, в которых валентная оболочка состоит всего из одного электрона (щелочные металлы), и атомы, в которых одного электрона не хватает для окончательного заполнения оболочки (галогены).
В 1869 Менделеев открыл период закон, согласно кот хим св-ва период элем повторяются. Основные положения: 1. Положение о квантовых числах. Состояние отдельного электрона в атоме определяется набором квантовых чисел – гл квант число n=1.2.3…, -определ число электронных оболочек; l=0…..n-1, при заданном nопределяет число подоболочек; магнитн орбит квант число при заданных n, l – ml=0,±1,…,±l, любое из значен2l+1; магнит кв число ms=±1/2. Магн квант число определяет число электр в подоболочке. 2. Принцип Паули «В атоме не могут находится 2 и более электр с одинаковым набором квант чисел». 3. Положение об устойчивости состояния атома – система устойчива тогда, когда находится в состоянии с наименьшей энергией. ПО мере увеличения порядкового номера атома заполнение электронных оболочек и подоболочекпроисходит так, чтобы состояние атома соответствовало наиболее устойчивому состоянию, с наим энергией. 4. Правило Маделунга «Без учета электростатического отталкивания между элект энергия отдельного электр увеличив в порядке возрастания чилаn. Если же учесть отталкивание, то энергия электр в атоме будет завистеть от кв числе nи l.» Заполнение электрических оболочек идет в порядке возрастания суммы n+lдля каждого значения этой суммы в порядке возрастания. 5.5 Хим и оптические св-ва атома определяются только строением внешней оболочки.
Последоват заполнение электр состояний в пределах подоболочек определяется правилом Хунда. Сначала заполн состояния с разл значением кв числа mlприодин значениях проекции спина – ½. После того как все состояния по кв числу ml оказываются заполненымиэлектр с одинак спинами, начинается их заполнение электр с противопол проекцией спина.
44. Частица в одномерной потенциальной яме. Туннельный эффект.
Потенциальная
яма![]()
Ч-ца массы m находится в одномерной потенциальной яме бесконечной глубины. Потенциальная эн.U удовлетворяет следую. гранич. условиям U(x) = {∞ x < 0, x > L; 0 0 < x < L
При таких граничных условиях частица находится внутри потенциальной ямы 0< x<L и не может выйти за ее пределы, т.е.
ψ(x)=0
x<0, x>L. Условие нормировки

Используя
станционарное уравнение Шредингера
для случая U=0, получим
 или
или
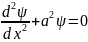 где
a2
= 2mE/h2.
где
a2
= 2mE/h2.
Ур-ние описывает положение частицы внутри потенциальной ямы. Оно имеет решение (x) = Ae+iax + Be-iax, представляющее собой суперпозицию двух волн, распространяющихся в противоположных направления вдоль оси x.Постоянные A и B находятся из граничных условийA+B=0 приx=0т.е. B = -A. Сл-но (x) = A(e+iax - e-iax) = 2iA sin ax. Условие ψ(L)= 0 дает 2ia sinaL = 0. ОтсюдаaL =πn, След-но и a=πn/L, где n=1,2, 3,...Подставляя полученное значение a получим соотношение для эн. ч-цы в бесконечной прямоугольной яме En =h2a2/2m =n2π2h2/2mL2, где n=1,2,3,... Волновые функции имеют вид ψn(x)=2iAsin(nπx/L).
ψn*(x)=-2iA sin(nπx/L).для бесконечной одномерной потенц. ямы имеем следующее. Эн. ч-цы принимает определенные дискретные значения. Ч-ца находится в определенных энергетических состояниях. Ч-ца может находиться в каком-то одном из множества энергетических состояний.Ч-ца не может иметь эн. =0..Каждому значению энергии En соответствует собственная волновая функция n, описывающая данное состояние. Для собственной функции ψ1(x) вероятность обнаружить частицу в точке x = L/2 максимальна. Для состояния ψ2(x) вероятность обнаружения частицы в этой точке = 0. Тунне́льный эффект, туннели́рование - преодоление микрочастицей потенциального барьера в случае, когда её полная эн. (остающаяся при туннелировании неизменной) меньше высоты барьера. Туннельный эффект - явл. исключительно квантовой природы, невозможное и даже полностью противоречащее классической механике. Аналогом туннельного эффекта в волновой оптике может служить проникновение световой волны внутрь отражающей среды (на расстояния порядка длины световой волны) в условиях, когда, с точки зрения геометрической оптики, происходит полное внутреннее отражение. Явление туннелирования лежит в основе многих важных процессов в атомной и молекулярной физике, в физике атомного ядра, твёрдого тела и т. д. Туннельный эффект можно объяснить соотношением неопределённостей. Записанное в виде: ΔxΔp≥ħ/2 оно показывает, что при ограничении квантовой ч-цы по координате, т.е.увеличении её определённости по x, её импульс p становится менее определённым. Случайным образом неопределённость импульса Δp может добавить ч-це эн. для преодоления барьера. Т.о, с некот. вероятностью квантовая ч-ца может проникнуть ч/з барьер, а средняя энергия частицы останется неизменной.
