
- •1 Билет
- •2 Билет
- •Количество электричества равное одному Фарадею всегда изменяет электрохимически 1 г-экв любого вещества независимо от его природы.
- •3. Билет
- •Ванна для электролитического получения цинка
- •4. Процесс взаимодействия продуктов электродных реакций между собой (вторичные реакции).
- •3.Закономерности роста крист фазы.
- •4 Билет
- •1. Удельная электропроводность
- •2.Равновесн электородный потенц.Ур-е Нернста.Стандрт электрод потенц
- •3Поляризациооные кривые в усл-ях электрохим перенапряжения
- •5 Билет
- •6 Билет
- •7 Билет
- •2 Диффузион перенапр в усл-ях молекулярн диффузии
- •8 Билет
- •3.Кинетика электрод-х пр-в в расплавл-х солях
- •9 Билет
- •Билет 10
- •1 Вывд т/д выраж для равновесн эдс
- •2 Влияние адсорбции на форму экк.
- •3Обр-е новой мет фазы на эл-де.
- •11 Билет
- •1. Уравнение Гиббса-Гельмгольца
- •2. Частные случаи электрохим перенапряжения
- •Билет 12
- •1 Знак эдс.
- •3. Концентрационные цепи с расплавленными солями.
- •Билет 13
- •Билет 14
- •15 Билет
- •Билет 16
- •2 Совмесное восст-е ме и водорода
1 Билет
1. Многие цвет ме-лы (нем-лы) пол-ют и рафинируют электролизом водных р-ров электролитов и расплав солей. Элек-зом водных р-ов получ Zn,Cd,Sb,Mn. Cu,Ni,Pb,Bi,благ и ред ме-в подвергают электролит-й очистке.AI,Mg пром-ть, получение щелочных, щелочноземельных ме-в, рафинирование основаны на электролизе расплавленных солей.
Особенности химических реакций:
Необходим контакт реагирующих частиц.2)Путь электрона, который переходит с одной частицы на другую, является очень коротким.3)Столкновение между реагирующими частицами происходит хаотично, поэтому электронные переходы могут совершаться в любых направлениях в пространстве.
Особенности электрохимических реакций.1)Пространственное разделение участников реакции.2)Прямой контакт между реагирующими частицами заменяется контактом каждого из его участников с электродом.3)Скорость электрохимической реакции зависит от температуры, активности, природы участников реакций и электродов, и электродного потенциала.
Гальванический элемент - электрохимическая система, производящая электрическую энергию за счёт протекающих в ней химических превращений.
Электролизер - электрохимическая система, в которой за счёт внешней электрической энергии совершаются химические превращения.
Составные части электрохим систем:
1)р-р электролита-проводник 2 рода в котором реагирующие в-ва диссоциируют на ионы 2)2 проводника 1 рода(электроды),контактирующие с электролитом и обеспещивающие обмен электронами с участниками р-и. 3)проводник 1 рода,соед э-ды между собо,либо с внешним источником тока
2.
Электрохимическое перенапряжение
возникает, если электрохтм акт,в котором
участвуют ионы плоьной части дэс
ограничивает скорость всего электродного
пр-са(лимитирующая стадия-пр-с
разряда-ионизации )
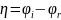
Поляризационные зависимости для частных плотностей тока
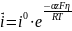
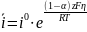
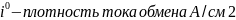
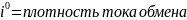
При
равновесии
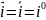 .
При сдвиге потенциала от равновесного
знач ч/з эл-д протекает ток,равный
разности частных токов.
.
При сдвиге потенциала от равновесного
знач ч/з эл-д протекает ток,равный
разности частных токов.
Катодная плотность тока

Анодная плотность тока
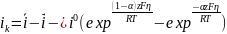 .Эти
ур-я-ур-я полной поляризацион криво
.Эти
ур-я-ур-я полной поляризацион криво
3.растврим ме-в в расплавленных солях при электролит получ ме-в происх расвор-е ме в солевой фазе Способность металлов растворяться в электролите – главная причина снижения выхода по току и ухудшения показателей электролиза. Растворимость металла зависит от природы металла и соли, состава металлической и солевой фаз и температуры. Большая взаимная растворимость наблюдается в системах с Na, Rb, Ce, K с галогенидами
Механизмы растворения (Ме – соль):
Растворение металлов с последующей их ионизацией Ме = Меz+ + ze
Растворение металлов как результат их реакции с собственной солью с образованием более сложных ионов Меz+ + nMe
 Mez+
n+1
Mez+
n+1Растворение металлов как результат их реакции с собственной солью с образованием ионов низшей валентности Меz+ + nMe (n+1)Mep+ p<z.
K(2)=
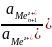 K(3)=
K(3)=
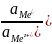 t=const
растворимость Ме зависит от активности
их соли,ионов высшей валентности в
расплаве
t=const
растворимость Ме зависит от активности
их соли,ионов высшей валентности в
расплаве
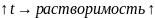 ,
,
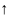 атомного радиуса
атомного радиуса ,
+ посторонних катионов
растворимость
,
+ посторонних катионов
растворимость
 ,
σ
растворимость
,
σ
растворимость
