
- •1 Билет
- •2 Билет
- •Количество электричества равное одному Фарадею всегда изменяет электрохимически 1 г-экв любого вещества независимо от его природы.
- •3. Билет
- •Ванна для электролитического получения цинка
- •4. Процесс взаимодействия продуктов электродных реакций между собой (вторичные реакции).
- •3.Закономерности роста крист фазы.
- •4 Билет
- •1. Удельная электропроводность
- •2.Равновесн электородный потенц.Ур-е Нернста.Стандрт электрод потенц
- •3Поляризациооные кривые в усл-ях электрохим перенапряжения
- •5 Билет
- •6 Билет
- •7 Билет
- •2 Диффузион перенапр в усл-ях молекулярн диффузии
- •8 Билет
- •3.Кинетика электрод-х пр-в в расплавл-х солях
- •9 Билет
- •Билет 10
- •1 Вывд т/д выраж для равновесн эдс
- •2 Влияние адсорбции на форму экк.
- •3Обр-е новой мет фазы на эл-де.
- •11 Билет
- •1. Уравнение Гиббса-Гельмгольца
- •2. Частные случаи электрохим перенапряжения
- •Билет 12
- •1 Знак эдс.
- •3. Концентрационные цепи с расплавленными солями.
- •Билет 13
- •Билет 14
- •15 Билет
- •Билет 16
- •2 Совмесное восст-е ме и водорода
8 Билет
1 образ дэс на границе ме-эл-д.ме «+« На катоде могут протекать две реакции
М е Меz+ + ze (A) окисление
М е Меz+ + ze (B) восстановление
Скорости прямого и обратного процессов неодинаковы
Скорость восстановления и окисления можно измерять плотностью тока
р еакция А i реакция B i
электрохимический потенциал катионов Ме в растворе выше, чем на поверхности Ме ,.ТО в начальный момент скорость восстановления (В) будет выше, чем скорость окисления (А). начнется осаждение катионов ме .поверхность металла приобретает избыточный положительный заряд, а избыток анионов в растворе сообщает ему отрицательный заряд.
По
мере увеличения этих зарядов скорость
осаждения будет уменьшаться, а скорость
обратного растворения увеличиваться
до наступления равновесия:
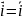
2. Химические цепи. В них источником электрической энергии является свободная энергия химической реакции, протекающей в электрохимической системе. Различают химические цепи с переносом, когда есть граница раздела между двумя растворами, и без переноса, когда такой границы нет.
В качестве примера химической цепи с переносом можно привести цепь элемента Даниеля-Якоби
Cu Zn ZnSO4 CuSO4 Cu
Левый электрод обратим по отношению к ионам цинка, а правый – к ионам меди
Zn + Cu2+ Zn2+ + Cu
E = E0 + RT/2F ln aCu2+/aZn2+
Примером химической цепи без переноса может служить стандартный элемент Вестона.
Pt Cd (Hg) CdSO4 (нас. р-р) Hg2SO4, Hg Pt
Левый электрод обратим по отношению к ионам кадмия
Cd – 2e Cd2+
а правый - к сульфат ионам
Hg2SO4 + 2e 2Hg + SO42-
3.Кинетика электрод-х пр-в в расплавл-х солях
анализ относ-ся к кинетики электродых пр-в позволил выявить ряд особенностей.Особенности:
1) высокая скорость всех стадий электродной реакции (высокая Т 500…1500 К)
2) высокие значения тока обмена i0 для реакций разряда – ионизации, малая величина электрохимического перенапряжения
3) различные процессы деполяризации
4) явление растворения металлов в солевой фазе или появление ионов с различными степенями окисления
5) анодный эффект – выделение на аноде газообразных веществ
6) высокая химическая активность расплавленных солей, которая затрудняет подбор конструкционных материалов и может привести в побочные реакциям
Электрохимическая поляризация наблюдается, когда в процессе электролиза образуются газообразные продукты во всех остальных случаях она мала.
Для процессов осаждения/растворения характерна концентрационная поляризация. Она вызывается ограниченной скоростью доставки вещества к поверхности электрода. Процесс образование сплошного слоя металла состоит из стадий (возникновение зародыша, рост слияние…). При высоких Т необходимо чтобы подложка была покрыта оксидной пленкой и изготовлена из металла, коэффициент диффузии которого очень мал. В этом случае возникает Фазовая поляризация – поляризация необходимая для образования на чужеродном катоде новой фазы.
Деполяризация. Появление нового пути электродного процесса, обеспечивающего протекание реакции с большой скоростью, способно снижать электродные потенциал. Это уменьшение φ и процесс обуславливающий его, называется деполяризацией. Деполяризация катодного процесса вызывается взаимодействием металла с материалом катода. Деполяризатором анодного процесса, является металл, растворенный в электролите и взаимодействующий с анодными продуктами.
