
- •1 Билет
- •2 Билет
- •Количество электричества равное одному Фарадею всегда изменяет электрохимически 1 г-экв любого вещества независимо от его природы.
- •3. Билет
- •Ванна для электролитического получения цинка
- •4. Процесс взаимодействия продуктов электродных реакций между собой (вторичные реакции).
- •3.Закономерности роста крист фазы.
- •4 Билет
- •1. Удельная электропроводность
- •2.Равновесн электородный потенц.Ур-е Нернста.Стандрт электрод потенц
- •3Поляризациооные кривые в усл-ях электрохим перенапряжения
- •5 Билет
- •6 Билет
- •7 Билет
- •2 Диффузион перенапр в усл-ях молекулярн диффузии
- •8 Билет
- •3.Кинетика электрод-х пр-в в расплавл-х солях
- •9 Билет
- •Билет 10
- •1 Вывд т/д выраж для равновесн эдс
- •2 Влияние адсорбции на форму экк.
- •3Обр-е новой мет фазы на эл-де.
- •11 Билет
- •1. Уравнение Гиббса-Гельмгольца
- •2. Частные случаи электрохим перенапряжения
- •Билет 12
- •1 Знак эдс.
- •3. Концентрационные цепи с расплавленными солями.
- •Билет 13
- •Билет 14
- •15 Билет
- •Билет 16
- •2 Совмесное восст-е ме и водорода
7 Билет
1. ДЭС При соприкосновении двух фаз, имеющих заряженные частицы, возможен переход таких частиц в неэквивалентном количестве из фазы в фазу. При этом в поверхностных слоях каждой из фаз возникают электрические заряды, равные по величине, но противоположные по знаку. Образуется так называемый двойной электрический слой (ДЭС), разность зарядов между обкладками которого, обуславливает скачок потенциала. Примером может служить поверхность раздела между металлом и водным раствором электролита.
ДЭС может образовываться и без перехода заряженных частиц из фазы в фазу. В этом случае образование ДЭС возможно за счёт избирательной адсорбции ионов одной из фаз на поверхности другой. ДЭС может образоваться при адсорбции и ориентации полярных молекул жидкой фазы (например, воды) на поверхности твёрдого тела.
М е Меz+
+ ze
(A)
окисление
е Меz+
+ ze
(A)
окисление
М е Меz+ + ze (B) восстановление
Скорости прямого и обратного процессов неодинаковы
Скорость восстановления и окисления можно измерять плотностью тока
р еакция А i реакция B i
По мере увеличения этих зарядов скорость реакции В будет уменьшаться, а скорость реакции А увеличиваться до наступления равновесия
2 Диффузион перенапр в усл-ях молекулярн диффузии
Диффузионное перенапряжение (концентрационное) возникает, если лимитирующей стадией является стадия массопереноса.концентрация разряжающегося вещества на поверхности электрода будет отличаться от концентрации в объеме электролита. . В условиях замедленной стадии массопереноса концентрация реагирующих веществ у поверхности электрода отличается от концентрации в глубине электролита.
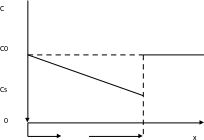
cs, c0 – концентрация разряжающегося вещества у поверхности электрода и в объёме электролита соответственно, - толщина диффузионного слоя.
Для электрода первого рода можно записать уравнение Нернста для равновесного потенциала и для потенциала под током
r
= 0
+
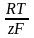 ln
c0
ln
c0
i = 0 + ln cs
Для реальных растворов концентрация должна быть заменена активностью. Диффузионное перенапряжение определяется как
D
= I
-
r
=
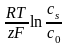
Если предположить, что концентрация изменяется линейно в диффузионном слое, а не зависит от плотности тока, то получим
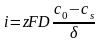
Из этого соотношения следует, что катодный ток может расти лишь до некоторого предела, когда сs обращается в нуль. При сs=0 имеем предельный диффузионный ток (id)
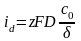
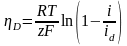 для
катодного пр-са
для
катодного пр-са
для
анодного процесса растворения металла
Сs>
С0,
тогда уравнение для анодного диффузионного
перенапряжения имеет вид: ηD=
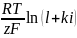 (не должна обнаруживаться предельная
плотность тока – отличие
от катодного процесса).
(не должна обнаруживаться предельная
плотность тока – отличие
от катодного процесса).
3. выход по току при эл-зе расплвлен солей При электролизе из расплавленных солей выход по току определятся величиной потерь металла с пов-ти катода.стадии потерь ме:
растворение ме в эл-те
перенос продуктов раств-я через толщу эл-та в зону кисления
перенос продуктов раств-я через прикатодный диф. Слой
окисление растворенного ме анодными газами или кислородом воздуха
другой причиной снижения выхода по току:совместный разряд нескольких видов ионов, механические потери ме, повышение температуры.чрезмерное уменьшение темп приводит к повыш вязкости эл-та,след появляются мех потери,уменьшается выход по току.
Добавки умен растворимость ме в эл-те,что квел выход по току.
Увел плотности тока приводит к увел плотности тока,межэлектродное расстояние также.
