
- •1 Билет
- •2 Билет
- •Количество электричества равное одному Фарадею всегда изменяет электрохимически 1 г-экв любого вещества независимо от его природы.
- •3. Билет
- •Ванна для электролитического получения цинка
- •4. Процесс взаимодействия продуктов электродных реакций между собой (вторичные реакции).
- •3.Закономерности роста крист фазы.
- •4 Билет
- •1. Удельная электропроводность
- •2.Равновесн электородный потенц.Ур-е Нернста.Стандрт электрод потенц
- •3Поляризациооные кривые в усл-ях электрохим перенапряжения
- •5 Билет
- •6 Билет
- •7 Билет
- •2 Диффузион перенапр в усл-ях молекулярн диффузии
- •8 Билет
- •3.Кинетика электрод-х пр-в в расплавл-х солях
- •9 Билет
- •Билет 10
- •1 Вывд т/д выраж для равновесн эдс
- •2 Влияние адсорбции на форму экк.
- •3Обр-е новой мет фазы на эл-де.
- •11 Билет
- •1. Уравнение Гиббса-Гельмгольца
- •2. Частные случаи электрохим перенапряжения
- •Билет 12
- •1 Знак эдс.
- •3. Концентрационные цепи с расплавленными солями.
- •Билет 13
- •Билет 14
- •15 Билет
- •Билет 16
- •2 Совмесное восст-е ме и водорода
Билет 13
1вольтамперные кривые в ус-ях диф-го перенапряж. дифф перенапряжение:
У-е даёт аналитическое выражение поляризационной зависимости для диффузионного перенапряжения.
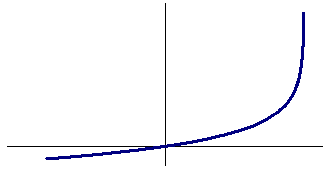
При
увеличении катодной плотности тока
диффузионное перенапряжение будет
плавно возрастать. При iid
перенапряжение D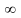 .
Для анодного процесса :
.
Для анодного процесса :
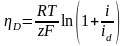 Ур-е
показывает, что D
монотонно возрастает с повышением
плотности тока.при анодном растворении
металла на поляризационной кривой также
появляется участок предельного тока,
а иногда после достижения определённого
потенциала, даже падение плотности
тока. Одна из причин может быть то, что
в реальных системах рост анодного тока
ограничен насыщением раствора продуктами
электролиза. Влияние миграции: часть
ионов к поверхности электрода может
доставляться не только диффузией, но и
миграцией, т.е. под действием градиента
электрического поля. Ионы переносят
часть электрического тока. Число
переноса: ti=Ii/I0,
в сумме : ti=1.
скорость, с которой будут двигаться
ионы определяется скоростью миграции
Ур-е
показывает, что D
монотонно возрастает с повышением
плотности тока.при анодном растворении
металла на поляризационной кривой также
появляется участок предельного тока,
а иногда после достижения определённого
потенциала, даже падение плотности
тока. Одна из причин может быть то, что
в реальных системах рост анодного тока
ограничен насыщением раствора продуктами
электролиза. Влияние миграции: часть
ионов к поверхности электрода может
доставляться не только диффузией, но и
миграцией, т.е. под действием градиента
электрического поля. Ионы переносят
часть электрического тока. Число
переноса: ti=Ii/I0,
в сумме : ti=1.
скорость, с которой будут двигаться
ионы определяется скоростью миграции
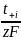 .
Суммарная скорость диффузии миграции
.
Суммарная скорость диффузии миграции
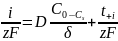 .
.

 для
миграции. Миграция ускоряет доставку
разряжающихся частиц к поверхности
электрода. В этом случае числа переноса
разряжающегося вещества становятся
очень малыми.
для
миграции. Миграция ускоряет доставку
разряжающихся частиц к поверхности
электрода. В этом случае числа переноса
разряжающегося вещества становятся
очень малыми.
2совместное восст-е двух мет.Если р-р электролита содержит катионы более электроплож ме-в чнм основной ме,то их совместный рзряд неизбежен.Если осн мет выдел с бол перенапряж то возможен разряд более электроотриц-х примесей чем осн ме.Пр-с осложняется обр-ем сплава на катоде при этом потенциал каждого ме + те обр-е сплава облегчает разряд катиона,тк уменьшается потенц энергия его компонентов и активоность ме в сплаве мен 1.
1-отраж пр-с восст осн мет 2-достигнута пред плотность тока,соответствует выдел ме2 в усл-ях пред плотности тока. Суммарная поляризационная---
Повышение электродной пол увел выход по току,тк скорость восст ме2 не м/т бол возр
3напряж разлож расплавленных солей. напряжение разложения-мин напряж,которое необходимо преложить из вне что бы происходил длит пр-с электролиза.
Если эл-з происходит без перенапряж и поляризации,то напр разл=равновесн эдс.
Электроды сравнения:1)обратимые по отнош к катионам(метал эл-ды-ме погружен в расплав соли этого ме) 2) обрат по отнош к анионам(газовые:хлорный,кислородный)
Билет 14
1. Окислительно-восстановительные электроды. В этих системах инертный металл электрода (Pt) является лишь передатчиком электронов между веществами Ox и Red. Например
Fe3+
+e
Fe2+
= 0Fe3+/Fe2+
+
ln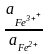 Стандартный
потенциал простых окислительно-восстановительных
электродов связаны со стандартными
потенциалами электродов 1 рода. Поясним
эту связь, которая называется правилом
Лютера.
Стандартный
потенциал простых окислительно-восстановительных
электродов связаны со стандартными
потенциалами электродов 1 рода. Поясним
эту связь, которая называется правилом
Лютера.
Поясним эту связь для реакции окисления металлического железа до ионов Fe3+. Возможны 2 пути: непосредственное окисление Fe→Fe3+ и окисление через образование Fe2+.
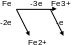
Известно (следствие 1 закона термодинамики) что, если вещество переходит из состояния 1 в состояние 2 и это превращение происходит изотермически и обратимо, то изменение энергии Гиббса не зависит от пути перехода, а определяется только начальным и конечным состояниями.
Следовательно, можно записать
G0Fe→Fe3+ = G0Fe→Fe2+ + G0Fe2+→Fe3+ G0 = - zF0
С помощью правила Лютера удаётся определить стандартные потенциалы и в более сложных случаях.
2. Электрокапиллярные явления отражают связь между поверхностным натяжением и потенциалом электрода. Изменение потенциала электрода () вследствие сообщения ему электрических зарядов от внешнего источника ЭДС (поляризация электродов) не должно сопровождаться процессами окисления или восстановления (фарадеевский процесс). Если электрические заряды, сообщаемые электроду, не будут расходоваться на протекание электродных реакций, то, оставаясь на электроде, они будут только изменять только его потенциал, изменяя соответственно только строение ДЭС. Такие электроды называются идеально поляризуемыми. Впервые электрокапиллярные явления были изучены на границе ртути и водных растворов электролитов Липпманом (1875), который использовал для этой цели сконструированный им капиллярный электрометр. Его исследования были продолжены Гуи, Фрумкиным, Батлером и др.
Для ряда разбавленных растворов (например, H2SO4, KOH, KNO3, Na2SO4 и др.) форма электрокапиллярной кривой (ЭКК) почти не зависит от природы электролита и близка к параболе (рис.).

Увеличение поверхностного натяжения будет до тех пор, пока не будут нейтрализованы все ионы ртути, тогда поверхностное натяжение принимает максимальное значение σм. Потенциал, при котором σ = σм , называется потенциалом нулевого заряда q=0. Дальнейшее сообщение отрицательного потенциала приводит к снижению поверхностного натяжения из-за отталкивания частиц, получивших отрицательный избыточный заряд.
3 катодное восст водорода. Электрохимическое восст. Н2 на поверхности рядя металлов протекает с очень большим перенапр.,выше чем в других электр. реакциях. Величина перенапряжения достигает 1В.Велечину перенапряжения можно изменить изменяя плотность тока, состава электролита,темпер.Во многих случаях технического применения эл-за водых р-в высокое перенапр вредно.При электроли получ ме-в за счет выс перенапр уменш кол-во элект-ва,которое расход на ненужное восст водорода
4стадии:
1)Стадия воосст водородного иона их кислого р-ра предст собой разряд катиона
Н
 Н2О+e=Надс
+Н2О
– кислая среда
Н2О+e=Надс
+Н2О
– кислая среда
в щелочн р-х предполаг непосредствен присоединения электронов к молекулам воды с помлед их распадом Н2О+e=Надс +ОН- - щелочная среда
2) закл в образ водорода из адсорбир атомов.Надс +Н Н2О+e=Н2+Н2О– кислая среда
Надс +Н2О+e= +Н2+ ОН-- щелочная среда
Любая из этих стадий м/т опред скорость всего пр-саэлектролит образ-я водорода и м/т бытьпоявлен водородного перенапряж.
При удалении от равновесного потенциала поляризационная зависимость имеет ур. Тафеля:
η=а+b lgi
