
- •1 Билет
- •2 Билет
- •Количество электричества равное одному Фарадею всегда изменяет электрохимически 1 г-экв любого вещества независимо от его природы.
- •3. Билет
- •Ванна для электролитического получения цинка
- •4. Процесс взаимодействия продуктов электродных реакций между собой (вторичные реакции).
- •3.Закономерности роста крист фазы.
- •4 Билет
- •1. Удельная электропроводность
- •2.Равновесн электородный потенц.Ур-е Нернста.Стандрт электрод потенц
- •3Поляризациооные кривые в усл-ях электрохим перенапряжения
- •5 Билет
- •6 Билет
- •7 Билет
- •2 Диффузион перенапр в усл-ях молекулярн диффузии
- •8 Билет
- •3.Кинетика электрод-х пр-в в расплавл-х солях
- •9 Билет
- •Билет 10
- •1 Вывд т/д выраж для равновесн эдс
- •2 Влияние адсорбции на форму экк.
- •3Обр-е новой мет фазы на эл-де.
- •11 Билет
- •1. Уравнение Гиббса-Гельмгольца
- •2. Частные случаи электрохим перенапряжения
- •Билет 12
- •1 Знак эдс.
- •3. Концентрационные цепи с расплавленными солями.
- •Билет 13
- •Билет 14
- •15 Билет
- •Билет 16
- •2 Совмесное восст-е ме и водорода
2 Билет
1. Законы Фарадея.Электролиз - протекание химических реакций на электроде, обусловленое прохождением электрического тока.
Количество вещества, прореагировавшего на границе электрод-электролит при протекании через неё электрического тока, прямо пропорционально количеству электричества, прошедшего через эту границу.
m = кQ
k-электрохимический эквивалент; Q-количество электричества, Кл.
Q = I
2.При электролитическом разложении различных веществ одним и тем же количеством электричества, количества полученных на электродах продуктов разложения пропорциональны их химическим эквивалентам
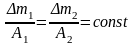
Количество электричества равное одному Фарадею всегда изменяет электрохимически 1 г-экв любого вещества независимо от его природы.
Величина
электрохимического эквивалента-массы
пр-в р-и,обр-ся при прохождении кол-ва
электричества=1Кл определяется как: ,
[г/Ас],
[г/Ач],
,
[г/Ас],
[г/Ач],
2. Газовые электроды. Газовый электрод состоит из инертного металла (Pt), к которому подводится электрохимически активный газ. Газ адсорбируется и участвует в электродной реакции.
Например, водородный электрод.
H+ + e 1/2 H2
=
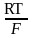 ln
ln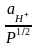
Если PH2 = 1атм, то
= RT/F ln aH+ = 2,3 RT/F lg aH+ = b pH
При определенных условиях потенциал водородного электрода является непосредственным выражением величины рН.
Кислородный электрод.
O2 + 2H2O + 4e = 4 OH- (нейтр. среда.)
= 0
+
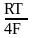 ln
ln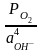
3.модели.
1Модель плоского конденсатора
(Гельмгольц)-дэс можно уподобить плоскому
конденсатору 1 из обкладок конденсатора
проходит ч\з центры тяжести зарядов
ионов и совпадает с плоскостью пов
ме-ла,другая прох ч\з центры тяжести
ионов,нах-ся в р-ре м\ду обкладками действ
силы эл.ст притяжения.толщина дэс=расстоянию
м\ду этими обкладками и=радиусу
иона,объясняет форму экк,но не объясняет
зависимость емкости и
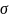 от С,Т.колл-е расчеты емкости дэс отл от
оп-х данных.
от С,Т.колл-е расчеты емкости дэс отл от
оп-х данных.
2(Гуи-Чапмен)вследствии движения мол и ионов дэс со стороны р-ра приоьретает размытое сост-е-диффузная модель.Дей-ют силы теплового движения ч-ц, об-ет зав-ть емкости и от С,Т.
3 Адсорбционная теория строения ДЭС (Штерн)-учит-ся силы специфич адсорбции ионов и мол-л.ионы и мол-лы способны адсорбироваться на пов-ти эл-да за счет сил неэектраст-го х-ра.стр-е дэс указывает на ха-р перехода и скорость.
3. Билет
1. Выход по току дает ту часть количества электричества прошедшего через электролизер, которая приходится на долю данной электродной реакции.
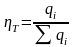

М\но
так же определить выход по току как
отношение количества полученного
продукта к теоретическому количеству,
которое должно получиться согласно
закону Фарадея.
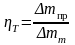
Причины отклонения от законов Фарадея.
1. Совместный разряд нескольких ионов
Ванна для электролитического получения цинка
Zn2+ + 2e = Zn – желаемый процесс.
H+ + e = ½ H – побочный процесс.
2. Наличие в системе ионов разной валентности.
Ванна для рафинирования золота Au/AuCl3, AuCl, HCl/ Cl2
Au3+ + 3e = Au (1)
Au+ + e = Au (2)
3. Перезарядка.
процесс частичного восстановления
Au3+ + 2e = Au+
4. Процесс взаимодействия продуктов электродных реакций между собой (вторичные реакции).
В ванне для получения магния электролизом расплавленных солей
Катодный процесс: Mg2+ + 2e = Mg
Анодный процесс: 2Cl- - 2e = Cl2
Кулонометры- сис-мы,где весь ток расходуется только на одну электрохимическую ре-ю. используются для измерения количества электричества.Выход по току=100%
Известны три основных типа кулонометров: объёмные, титрационные и весовые.
В объёмных кулонометрах расчёт производится на основании измерения объёма получившихся веществ (ртути, газа). В титрационных - количество электричества определяется из данных титрования веществ, появившихся в растворе в результате электродной реакции (Ag анодное растворение). В весовых кулонометрах расчёт производится по привесу катода
2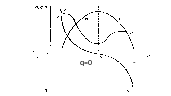 .
Первое уравнение
Липпмана
.
Первое уравнение
Липпмана
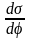 = - q
= - q
Второе
уравнение Липпмана -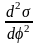 =
=
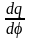 =
Сd
=
Сd
Ход зав-ти С связан с прир ионов со стороны эл-та,образ-
х дэс.А-ны более дефформ,чем К,поэтому дэс обрз анион
ами более тонок.При + заряде дэс из сильно дефрм Ан,е
мкость велика.При умен заряда деформ ионов умен,емкость
уменш.При ф=0 анионный слой исчезает-катионный.
