
- •1 Билет
- •2 Билет
- •Количество электричества равное одному Фарадею всегда изменяет электрохимически 1 г-экв любого вещества независимо от его природы.
- •3. Билет
- •Ванна для электролитического получения цинка
- •4. Процесс взаимодействия продуктов электродных реакций между собой (вторичные реакции).
- •3.Закономерности роста крист фазы.
- •4 Билет
- •1. Удельная электропроводность
- •2.Равновесн электородный потенц.Ур-е Нернста.Стандрт электрод потенц
- •3Поляризациооные кривые в усл-ях электрохим перенапряжения
- •5 Билет
- •6 Билет
- •7 Билет
- •2 Диффузион перенапр в усл-ях молекулярн диффузии
- •8 Билет
- •3.Кинетика электрод-х пр-в в расплавл-х солях
- •9 Билет
- •Билет 10
- •1 Вывд т/д выраж для равновесн эдс
- •2 Влияние адсорбции на форму экк.
- •3Обр-е новой мет фазы на эл-де.
- •11 Билет
- •1. Уравнение Гиббса-Гельмгольца
- •2. Частные случаи электрохим перенапряжения
- •Билет 12
- •1 Знак эдс.
- •3. Концентрационные цепи с расплавленными солями.
- •Билет 13
- •Билет 14
- •15 Билет
- •Билет 16
- •2 Совмесное восст-е ме и водорода
2.Равновесн электородный потенц.Ур-е Нернста.Стандрт электрод потенц
Наступление равновесия между Ме и раствором его соли характеризуется тем, что устанавливается опред. по величине и направлению скачек потенциала или равновесный потенциал. (мера изменения энергии Гиббса)
Равновесие препятствует дальнейшему окислению и восстановлению, поэтому равновесный потенциал может служить мерой максим. работы процесса который стремится соверш. на электроде.
Ме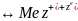 скорости выравниваются
скорости выравниваются
i=i=iº
- ток
обмена 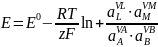
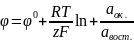
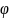 -
не зависит от активности участников
процесса, а опред. лишь природой электрода
и раствора.( a=1).Величины
-
не зависит от активности участников
процесса, а опред. лишь природой электрода
и раствора.( a=1).Величины
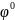 можно
измерить на основе ТД данных,является
константой.если отриц то металл будет
окисл водородом.если положит то не б\т
окисляться
можно
измерить на основе ТД данных,является
константой.если отриц то металл будет
окисл водородом.если положит то не б\т
окисляться
3Поляризациооные кривые в усл-ях электрохим перенапряжения
рассчит-я по ф-летполяризационная кривая симметр относ-но начала координат при отклонении от 0,5 симметричность нарушается.пунктиром показаны поляризационные кривые,отвеч- щие завимисимости частных плотностей токов в прямом и обратном от потенциала.
= a + b lg i- уравнение Тафеля. Величины i0 и можно найти графически (рис), откладывая против lg i в той области перенапряжений, где справедливо уравнение Тафеля. Наклон b прямой - lg i равен
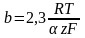
и, следовательно
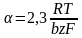
Ток обмена может быть определён по величине перенапряжения при единичной плотности тока, то есть при lg i = 0. Тогда =а
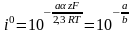
 Рис.
Определение тафелевских констант а
и b
из полулогарифмических зависимостей
перенапряжения от плотности тока
Рис.
Определение тафелевских констант а
и b
из полулогарифмических зависимостей
перенапряжения от плотности тока
5 Билет
1диффузия в р-рах электролитов. Изменение концентрации (а точнее активности) растворённого вещества в одной части раствора по отношению к другой приводит к возникновению потока диффузии.
Количественным выражением процессов диффузии являются законы Фика. Первый закон Фика относится к процессам стационарной диффузии и имеет вид
jd = -Di grad ci jd+ = -D+ dc+/dx
поток диффузии, то есть количество частиц, диффундирующих через единичную площадку в единицу времени. Di –коэффициент диффузии частиц i, имеет размерность м2/с, показывает число частиц, про диффундировавших за 1с через поперечное сечение раствора площадью 1м2 при градиенте концентрации равном единице.
Коэффициенты диффузии ионов связаны с подвижностями ионов следующим образом
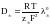
jd = -Dэфф grad c
В общем случае подвижности катионов и анионов неодинаковы
+0 -0
а следовательно не равны и их коэффициенты диффузии D+ D-, поэтому при одном и том же градиенте концентрации скорость диффузии положительных и отрицательных ионов различна.
Предположим, что создана граница между двумя растворами с разной концентрацией. Например, раствор NaCl.
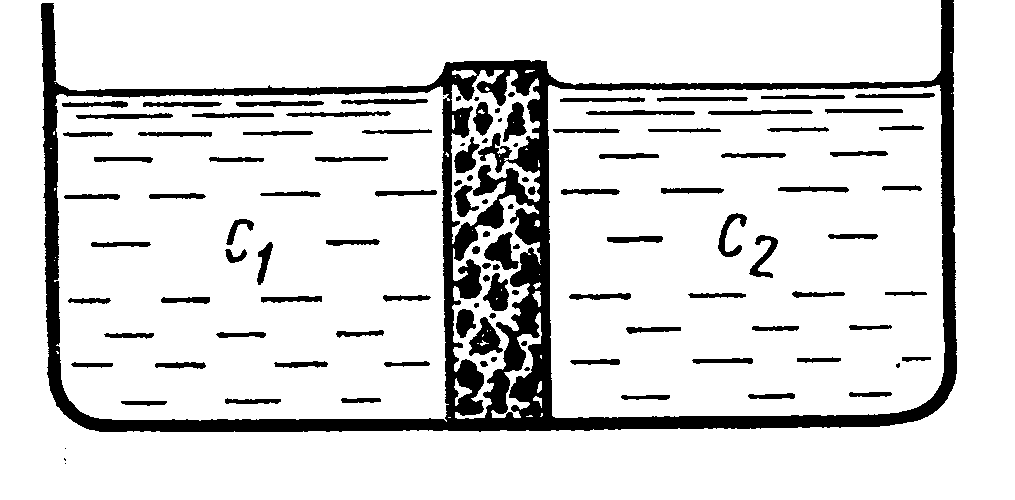
Пусть с1>с2. В водном растворе NaCl D+ < D-. При этом условии анионы в начальный момент времени будут перемещаться слева направо (с1 с2) Быстрее чем катионы. В результате этого произойдёт пространственное разделение зарядов и возникнет электрическое поле, которое будет ускорять движение катионов и замедлять движение анионов. Следовательно, через короткий промежуток времени скорости перемещения катионов и анионов выровняются. В этих условиях можно говорить об общем потоке электролита. Однако этот поток не является обычным потоком диффузии , так как между двумя областями раствора с концентрациями с1 и с2 устанавливается стационарная разность потенциалов, которая называется диффузионным потенциалом d.
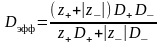
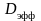 -
эффективный коэффициент диффузии
электролита. Термин эффективный отражает
то, что в действительности перемещение
ионов происходит не только за счёт
диффузии, но и под действием электрического
поля (миграции).
-
эффективный коэффициент диффузии
электролита. Термин эффективный отражает
то, что в действительности перемещение
ионов происходит не только за счёт
диффузии, но и под действием электрического
поля (миграции).
Величина диффузионного потенциала будет определяться соотношением
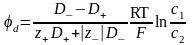
2. Скорость электрохимической реакции Электрохимическую реакцию можно рассматривать как гетерогенную химическую реакцию и скорость её подобно скорости любой химической реакции, определяется как количество вещества, изменившееся за единицу времени, то есть
V = dm/dt
Поскольку между количеством прореагировавшего вещества и количеством электричества существует прямая пропорциональность, согласно закону Фарадея, то можно записать
V = dm/dt = k I dt/dt = k I
Скорость электрохимической реакции пропорциональна силе тока. Характерной особенностью всех электрохимических реакций является то, что они совершаются на границе раздела электрод – электролит и поэтому их скорость зависит от величины поверхности раздела. i = I/S - плотность тока [A/см2].
Если электрохимическая цепь работает как электролизёр, то
U = Er + к + а + Eом ,
а если – как химический источник тока, то
U = Er - к - а - Eом
электродную поляризацию () можно определить, то есть как разность потенциала электрода, через который протекает ток (i) и его равновесным потенциалом (r)
= i - r
Любой электродный процесс всегда имеет ряд последовательных стадий: сначала реагирующее вещество подходит к электроду, затем происходит собственно электрохимическая стадия, связанная с переносом электронов или ионов через границу раздела фаз (стадия разряда-ионизации), и, наконец, образовавшиеся продукты реакции должны отойти от поверхности электрода. Первая и третья стадии имеют одинаковые закономерности и называются стадиями массопереноса. Стадии массопереноса и разряда-ионизации присутствуют во всех без исключения электродных процессах. Помимо этих стадий при протекании электродных реакций встречаются также и другие. Так электродные процессы могут осложняться химическими реакциями в объёме раствора или на поверхности электрода, в которых может участвовать исходное вещество или продукт электрохимической реакции. Скорость процесса, состоящего из ряда последовательных стадий, определяется скоростью самой медленной стадии, которая называется лимитирующей или контролирующей
Если известна природа лимитирующей стадии то поляризацию заменяем перенапряжением.виды:
Диффузионное перенапряжение возникает при лимитирующей стадии массопереноса;
Электрохимическое перенапряжение (разряда-ионизации) возникает при лимитирующей стадии разряда - ионизации;
Фазовое перенапряжение возникает при лимитирующей стадии построения или разрушения кристаллической решётки или зарождения новой фазы (газовой, жидкой, кристаллической);
Перенапряжение химической реакции возникает при замедленной стадии химической реакции.
3 хим цепи с индивид расплавленными солями и смесями солей.В химических цепях токообразующий процесс связан с взаимодействием чистых компонентов и образованием соответствующей соли.
С инд. Расплавленной солью
Это цепь с одной солью в качестве электролита, в которой помещены электроды: металлический и газовый.
Pb|PbCl2|Cl2,C
Е изм будет соответствовать стандартному значению
На границе раздела образуется ДЭС и возникает скачек потенциала. Газовые электроды имеют более + φ чем металлические, следовательно возникает разность φ, а в системе ЭДС
G0 = - zFЕ0
S0
= zF

H0 = G0 + TS0 = - zFЕ0 + zFT .
Химические цепи с расплавленными солевыми смесями
Pb|PbCl2, LiCl|Cl2,C; Ag|AgI, KI|I2,C
Раствор т/ко Pb как более электроположит , LiCl- фоновый,индифирентный электролит.
Токообразующим процессом является процесс образования МеХ2(PbCl2, AgI) из чистых металла и галогена.
