
- •Билет №1
- •Билет №3
- •4. Перегонка при пониженном давлении
- •Азеотропная и экстрактивная перегонка
- •5. Жидкостно-адсорбционная хроматография
- •6. Адсорбенты в газовой хроматографии
- •8. Принцип работы газового хроматографа
- •Простые и комбинированные константы у/в.
- •11.Ультрафиолетовая спектроскопия
- •13.Масс-спектрометрия
- •14.Масс-спектроскопия электронного захвата в исследовании гетероатомных соединений
- •16. Алкакны
- •1.1. Содержание в нефтях
- •17. Твердые алканы
- •18.Биомаркеры
- •19.Значение алканов как компонентов моторных топлив
- •21. Дегидроциклизация алканов. Работы сов. Ученых.
- •22. Изооктан. Методы его синтеза
- •Синтез компонентов моторного топлива на основе ступенчатой полимеризации олефинов
- •4.1.1. Химические свойства алкенов
- •Присоединение серной кислоты
- •Озонирование алкенов
- •П рисоединение ацетата ртути
- •26 Количественное определение, выделение и идентификация олефинов
- •31.Арены нефтей. Состав. Свойства. Анализ
- •32. Что такое формолитовая реакция?
- •34. Типы разрыва связей в молекулах углеводородах. Энергия диссоциации.
- •49. Определение детализированного группового состава бензиновых фракций нефти.
- •50, 51. Определение детализированного группового состава крекинг-бензинов или жидких продуктов пиролиза.
- •52. Определение детализированного группового состава керосино-газойлевых фракций.
- •53. Методы определения структурно0группового состава средних и высших фракций
- •Прямой метод
- •55, 56, 57, 58 Кислородные соединения нефти
- •Метод постепенного расщепления
- •59, 60, 62 Сернистые соединения
- •63. Азотистые соединения
34. Типы разрыва связей в молекулах углеводородах. Энергия диссоциации.
Связи в молекулах углеводородов могут разрываться гомолитически и гетеролитически.
Гомолитический разрыв связей приводит к образованию свободных радикалов. Связь разрывается так, что у каждого осколка молекулы остается по одному электрону:
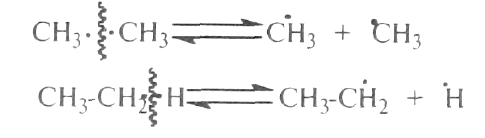
Гомолитический разрыв происходит чаще всего при термических превращениях углеводородов.
Гетеролитический разрыв приводит к образованию ионов. Связь разрывается так, что пара электронов связи целиком переходит к одному из атомов, образующих связы
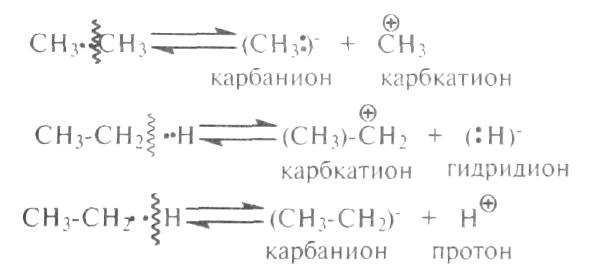
Углеводородные радикалы, ионы (карбкатионы, карбанионы), атом водорода (H"), гидридион (H,:)" и протон (H+) являются промежуточными частицами в процессах термокаталитических превращений углеводородов. Они обладают высокой реакционной способностью. Гетеролитический разрыв связей происходит только при каталитических превращениях углеводородов. Кроме полного разрыва связей может происходить частичный их разрыв (отрыв одного электрона или сильная поляризация связи) под действием активного центра катализатора (акцептора электронов — А):
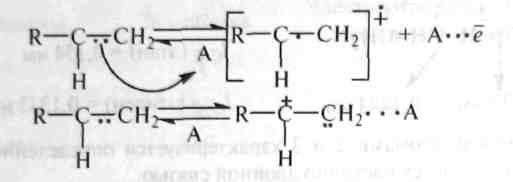
Гемолитический разрыв связи требует меньше энергии, чем гетеро-литический, так как в последнем случае необходимо затратить энергию на преодоление электростатического взаимодействия ионов. Еще меньшая энергия требуется для отрыва одного электрона (одноэлектронный перенос). Впервые концепция одноэлектронного переноса при гетеро-литических реакциях была высказана советским ученым О. Ю. Охло-быстиным1. В настоящее время установлена значительная роль одноэлектронного переноса в каталитических превращениях углеводородов2. Важной характеристикой связи является энергия, необходимая для гемолитического ее разрыва, называемая энергией диссоциации связи.
Следует отличать понятие энергии связи (E) от понятия энергии диссоциации связи (D) для сложных молекул (более чем двухатомных).
Несовпадение энергии разрыва связи C-H и ее средней энергии объясняется тем, что при диссоциации связи C-H молекулы метана происходит изменение геометрической конфигурации системы и валентного состояния атома углерода. Молекула метана — тетраэдр, угол между валентностями составляет 109°28'. Метил — плоская частица. Угол между валентностями равен 120°.
Ч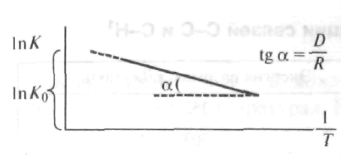 тобы
перейти от тетраэдрической молекулы
CH4
(sp3-гибридизация
атома углерода) к плоской структуре
метила (sp2-гибридизация
атома
углерода), необходимо затратить
энергию, поэтому энергия диссоциации
связи C-H
больше средней энергии этой связи1.
тобы
перейти от тетраэдрической молекулы
CH4
(sp3-гибридизация
атома углерода) к плоской структуре
метила (sp2-гибридизация
атома
углерода), необходимо затратить
энергию, поэтому энергия диссоциации
связи C-H
больше средней энергии этой связи1.
Энергия диссоциации связи равна энергии активации распада молекулы на радикалы, так как обратная реакция соединения радикалов идет с нулевой энергией активации. Поэтому для экспериментального определения энергии диссоциации связи С—С необходимо знать зависимость константы скорости распада молекулы по этой связи от температуры:
![]()
где А — частота колебаний разрываемой связи, 1013C-1. То же уравнение в логарифмической форме имеет вид:
![]()
Построив эту зависимость графически (рис 57), определяют тангенс угла наклона прямой и вычисляют D.
Как и другие характеристики связей (длина, дипольный момент и т. д.), энергия диссоциации связи зависит от ее положения в молекуле углеводорода. В табл. 16 приведены значения энергий диссоциации некоторых связей С—С и C-H.
Из приведенных данных видно, что энергия диссоциации связи С—С изменяется при изменении длины углеводородной цепи и положения связи в молекуле. Энергия диссоциации связи C-H изменяется в зависимости от характера углеродного атома — первичный, вторичный, третичный. При замене атома водорода в этане на фенильный радикал энергия диссоциации связи С—С уменьшается по сравнению с незамещенным этаном. Вообще легкость гемолитического разрыва связи C-C и, следовательно, уменьшение энергии диссоциации соответствующей связи находится в прямой зависимости от устойчивости образующихся при этом свободных радикалов. Так, энергия диссоциации связи Салиф—Cалиф- гексафенилэтана всего -42 кДж/моль.
Энергия гетеролитического разрыва связей значительно выше, чем гомолитического. Значения энергий гетеролитического разрыва связеймогут быть вычислены на основании данных по потенциалам ионизации радикалов:R'— >R+ + e и значений энергий гомолитического разрыва связей. Для простых молекул углеводородов они могут быть найдены экспериментально (метод электронного удара). Гринсфельдером2 вычислены значения гетеролитического разрыва центральной связи C-C в молекуле гексана. Это значение равно 1089 кДж/моль. Для различных связей C-H значение энергии гетеролитического разрыва изменяется в пределах 670-1689 кДж/моль.
