
- •II член
- •Глава 26 рак пищевода
- •Глава 27 нагноительные заболевания лёгких и плевры
- •Глава 28 рак легкого
- •Глава 20 врождённые пороки сердца и крупных сосудов
- •Глава 30 приобретенные пороки сердца
- •Глава 31 перикардиты
- •Глава 33 хрургическое лечение аритмий
- •Глава 34 острая артериальная непроходимость
- •Глава 35 хронические облитерирующие заболевания аорты и её ветвей
- •Глава 36
- •Глава 37 острые венозные тромбозы
- •38 Глава
- •I. Локализация
- •II. Степень нарушения перфузии лёгких
- •III. Характер гемодинамических расстройств
- •IV. Осложнения
- •39 Глава хроническая венозная
- •Эндокринная хирургия
- •Глава 41 опухоли надпочечников
- •Хирургия молочных желёз
- •Глава 42 острый мастит
- •Глава 43 дисгормональные
- •Глава 44 рак молочной железы
- •Рекомендуемая литература
Глава 20 врождённые пороки сердца и крупных сосудов
Врождённые пороки — изменения нормального строения сердца и магистральных сосудов, возникающие вследствие нарушения внутриутробного развития и незавершённости анатомического строения сердца при окончательном формировании постнатального кровообращения. Пороки развития сердца и крупных сосудов выявляют почти у 0,5% детей, родившихся живыми, и у 0,2 % детей, оставшихся в живых после первых 2 лет жизни.
Аномалии развития сердца и крупных сосудов приводят к нарушениям гемодинамики, обусловленным различными причинами, которые определяют клиническую картину порока и методы его коррекции. Основным признаком большинства врождённых пороков сердца бывает отсутствие строгого разделения на системы малого и большого кругов кровообращения, обусловленное наличием дефекта в перегородках или сохраняющимся эмбриональным соустьем. Реже встречают врождённые пороки сердца с необычным отхожде-нием или впадением крупных сосудов, а также сужением аорты или лёгочного ствола. Учитывая основные патологоанатомические признаки и характер нарушения внутрисердечной гемодинамики, условно их можно объединить в три большие группы.
I группа — пороки, имеющие внутрисердечное патологическое сообщение со сбросом венозной крови в артериальное русло (пороки синего типа: тетрада и триада Фалло, комплекс Эйзенменгера, транспозиция сосудов).
II группа — пороки с внутрисердечным сообщением (или в пределах начальной части крупных сосудов) и сбросом артериальной крови в малый круг кровообращения (пороки бледного типа: открытый артериальный проток, дефекты межпредсердной, межжелудочковой и аортолёгочной перегородок).
III группа— пороки без смешивания венозной и артериальной крови, при которых нарушения гемодинамики вызваны сужением магистральных сосудов (сужение лёгочного ствола, стеноз устья аорты, коарктация аорты).
Известно более 100 врождённых пороков сердца и крупных сосудов, а также их сочетаний. Наибольшее клиническое и практическое значение имеют некоторые из них, выявляемые достаточно часто. Зная их симптоматологию, можно распознать или заподозрить другие аномалии развития сердца и крупных сосудов.
Специальные методы исследования сердца и крупных сосудов
Зондирование (катетеризация) сердца — метод исследования при помощи введения в камеры сердца специальных рентгеноконтраст-ных зондов. В зависимости от поставленных задач зондирование проводят через венозные или артериальные сосуды. Метод позволяет измерять давление в полостях сердца, производить его запись в виде кривой для последующего анализа и расчётов, брать пробы крови для изучения газового состава. Возможно также определение патологического сообщения между полостями при прохождении зонда через дефект в перегородке. Путём введения через катетеры контрастных веществ возможно рентгеноконтрастное исследование камер сердца и сосудов (киноангиокардиография). Продвижение контрастного вещества по ходу тока крови даёт возможность получать последовательные изображения всех сосудов и полостей сердца. На основе этих данных составляют представление об анатомической и гемодинами-ческой сущности порока сердца.
Всё большее развитие получают неинвазивные методы исследования (УЗИ, КТ, МРТ, сцинтиграфия). Современную диагностику патологии сердца трудно представить без УЗИ. Под термином «эхо-кардиография» понимают комплексное УЗИ, включающее различные методы: одномерную, двухмерную, допплеровскую эхокардиографию и контрастную эхокардиографию, а также цветное допплеровское картирование. Усовершенствование эхокардиографического исследования привело к появлению чреспищеводнои и внутрисосудистои методик, сделало возможным пространственную реконструкцию ультразвукового изображения.
По совокупности данных, получаемых при обычных врачебных методах исследования больных и при использовании инструментальных методов, можно достичь весьма точной диагностики большинства пороков сердца и принять решение о возможности оперативного лечения.
Открытый артериальный (боталлов) проток
Порок характеризуется сохранением соустья между аортой и лёгочным стволом, существующего во время внутриутробного периода развития плода. Вскоре после рождения проток обычно облитериру-ется и превращается в артериальную связку. Функционирование артериального протока в течение первого года жизни считают врождённым пороком. Эту аномалию развития встречают наиболее часто, она составляет до 25% всех врождённых пороков.
Гемодинамическая сущность порока
Гемодинамическая сущность порока состоит в постоянном сбросе артериальной крови в малый круг кровообращения, вследствие чего происходит перемешивание артериальной и венозной крови в лёгких и развивается гиперволемия малого круга, сопровождающаяся постепенным возникновением необратимых морфологических изменений сосудов лёгких и последующим возникновением лёгочной гипер-тензии. При этом левый желудочек вынужден работать интенсивнее для поддержания устойчивой гемодинамики, что приводит к гипертрофии левых отделов сердца. Прогрессирующее повышение сопротивления сосудов малого круга вызывает перегрузку правого желудочка сердца, обусловливая его гипертрофию и последующую дистрофию миокарда. Степень нарушения кровообращения зависит от диаметра протока и объёма сбрасываемой через него крови.
Клиническая картина и диагностика
Характер клинических проявлений зависит, прежде всего, от диаметра и протяжённости протока, угла его отхождения от аорты и формы, что определяет величину сброса крови в лёгочную артерию. Жалобы обычно появляются с развитием декомпенсации кровообращения и заключаются в быстрой утомляемости и одышке. Для порока характерны частые респираторные заболевания и пневмонии на первом и втором годах жизни ребёнка, отставание его в физическом развитии. При обследовании больного обнаруживают систоло-ди-астолический шум над сердцем с эпицентром над лёгочной артерией. Характер шума часто сравнивают с «шумом волчка», «шумом мельничного колеса», «машинным шумом», «шумом поезда, проезжающего через тоннель». С развитием лёгочной гипертензии в этой же точке появляется акцент II тона. Как правило, шум становится интенсивнее при выдохе или физической нагрузке. Электрокардиографические признаки нехарактерны. При рентгенологическом исследовании определяют признаки переполнения кровью малого круга кровообращения и умеренно выраженную митральную конфигурацию сердца за счёт выбухания дуги лёгочной артерии. Отмечают гипертрофию левого желудочка. В поздние сроки естественного течения порока становятся более выраженными рентгенологические признаки склерозирования сосудов лёгких и обеднение их рисунка. Эхо-кардиография иногда позволяет визуализировать функционирующий открытый артериальный проток (обычно у маленьких детей). У взрослых пациентов этому мешает ограничение «ультразвукового окна» вследствие прилегания левого лёгкого. Катетеризация камер сердца необходима лишь в осложнённых или неясных случаях. При введении контрастного вещества в восходящую аорту оно через проток попадает в лёгочные артерии. В целом диагностика этого порока больших трудностей не представляет.
Частым осложнением открытого артериального протока (особенно малого диаметра) бывает воспаление стенок протока (боталлинит) или, в более старшем возрасте, его обызвествление.
Лечение
Спонтанное закрытие артериального протока наблюдают довольно редко. Как правило, оно происходит вследствие боталли-нита. Поэтому в настоящее время во всех случаях такого порока считают показаным оперативное лечение. Из левосторонней заднебоковой торако- томии перевязывают проток двумя-тремя лигатурами, клипируют (рис. 29-1) или пе ресекают его с последующим прошиванием и перевязкой обеих культей. В пос леднее время развивается транскатетерная эмболизация открытого артериального протока при помощи специальных конструкций — окклюдеров. Суть метода заключается в доставке окклюдера при помощи Ние открытого артериаль-специальных зондов к функционирую- ного протока, щему артериальному протоку и установке конструкции в просвете боталлова протока таким образом, чтобы он перекрывал сообщение между аортой и лёгочной артерией.

Рис. 29-1 Клипирование открытого артериального протока
Прогноз
Наилучших результатов хирургического вмешательства достигают после операций в возрасте до 5 лет. В более старшем возрасте после перевязки открытого артериального протока сохраняется остаточная лёгочная гипертензия в результате необратимых морфологических изменений лёгких. Кроме того, операция у взрослых более опасна из-за возможного кровотечения вследствие прорезывания склерозированной или кальцинированной стенки протока лигатурой.
Дефект межпредсердной перегородки
Дефект межпредсердной перегородки — патологическое соустье между правым и левым предсердиями. Он составляет около 20% всех врождённых пороков сердца. Дефект может располагаться в различных отделах перегородки, иметь разнообразные форму и размеры. Условно различают первичные и вторичные (высокие) дефекты межпредсердной перегородки (рис. 29-2). Первичный дефект возникает вследствие недоразвития в эмбриогенезе первичной перегородки. Его отличительная особенность — локализация на уровне фиброзного кольца атриовентрикулярных клапанов, они становятся нижней стенкой такого дефекта. Порок иногда сочетается с расщеплением мит рального и трикуспидального клапанов, являясь компонентом так называемого открытого атриовентрикулярного канала. Вторичный дефект формируется вследствие нарушений эмбриогенеза вторичной перегородки. Нижний край такого дефекта составляет межпредсерд-ная перегородка.

Гемодинамическая сущность порока
Гемодинамическая сущность порока заключается в сбросе артериальной крови из левого предсердия в правое, что вызывает гипер-волемию малого круга кровообращения, а в дальнейшем — развитие лёгочной гипертензии. Лёгочная гипертензия при дефекте межпредсердной перегородки носит весьма злокачественный характер, так как необратимые изменения в лёгких развиваются быстро, приводя к тяжёлой декомпенсации правых отделов сердца. Частым осложнением такого порока становится септический эндокардит.
Клиническая картина и диагностика
Обычно жалобы больных связаны с декомпенсацией кровообращения. Тяжесть её зависит от выраженности перегрузки правых отделов и развития лёгочной гипертензии. Больных беспокоят быстрая утомляемость и одышка, они подвержены простудным заболеваниям, особенно в раннем детском возрасте. Аускулыпативно дефект межпредсердной перегородки проявляется нежным систолическим шумом с эпицентром над лёгочной артерией. Шум обусловлен относительным стенозом основания лёгочного ствола, через который протекает избыточный объём крови. И тон над лёгочной артерией усилен и часто расщеплён. На ЭКГ заметны признаки перегрузки правых отделов сердца с гипертрофией правого желудочка и предсердия. Весьма часто обнаруживают неполную или полную блокаду правой ножки пучка Хиса.
При рентгенологическом исследовании определяют увеличение размеров сердца за счёт правых предсердия, желудочка и ствола лёгочной артерии. Выявляют также повышенную пульсацию корней лёгких и усиление общего сосудистого рисунка лёгочной ткани.
С помощью эхокардиографического исследования можно визуализировать дефект межпредсердной перегородки (рис. 29-3), уточнить его характер (первичный или вторичный), оценить направление сброса крови через дефект.
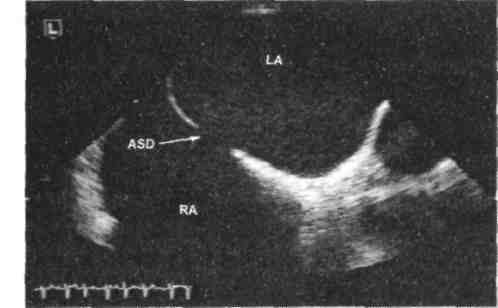
Рис. 29-3. Эхокардиография в В-режиме больного с дефектом межпредсердной перегородки (ASD) (LA — левое предсердие, RA — правое предсердие).
При зондировании сердца обнаруживают повышение давления в правом предсердии, правом желудочке и лёгочном стволе. Зонд может переходить из правого предсердия в левое. Контрастное вещество, введённое в левое предсердие, через дефект межпредсердной перегородки попадает в правое предсердие и далее — в малый круг кровообращения. На основании рентгенологических данных можно рассчитать объём сброса крови, определить локализацию

и размеры дефекта. Продолжительность жизни при дефекте межпредсердной перегородки без операции в среднем составляет около 25 лет.
Лечение
Рис. 29-4. Ушивание дефекта межпредсердной перегородки в условиях искусственного кровообращения. Дефект щелевидной формы ушивают непрерывным обвивным двухрядным швом.

Рис. 29-5. Пластика большого дефекта межпредсердной перегородки синтетической заплатой.
Лечение только оперативное. Преимущественно выполняют операции на открытом сердце в условиях искусственного кровообращения или гипотермии (общей или краниоцеребральной). Вторичные дефекты средней величины можно ушить (рис. 29-4). Большие вторичные и все первичные дефекты, как правило, закрывают с использованием заплаты из ауто- или ксеноперикарда либо синтетических тканей (рис. 29-5). В последнее десятилетие развивается методика транскатетерного закрытия дефекта межпредсердной перегородки при помощи «пуговичных устройств». Суть метода заключается в доставке и установке в область дефекта под рентгеновским контролем специальными инструментами-зондами двух конструкций-дисков, напоминающих пуговицы. Причём одну из конструкций (так называемый контр-окклюдер) устанавливают со стороны правого, а другую (окклюдер) — со стороны левого
предсердия. Конструкции соединяют между собой в области дефекта при помощи специальной нейлоновой петли, вследствие чего они перекрывают сообщение между предсердиями.
Прогноз
Хорошие результаты операции могут быть получены лишь при её выполнении в раннем детском возрасте. Проведение операции в более поздние сроки не позволяет добиться всесторонней реабилитации пациентов вследствие формирования вторичных морфологических изменений в лёгких, миокарде и печени. Более того, развитие тяжёлой лёгочной гипертензии со сбросом справа налево — противопоказание к оперативному лечению.
Дефект межжелудочковой перегородки
Дефекты межжелудочковой перегородки могут располагаться в её мембранозной или мышечной части (рис. 29-6), иногда выявляют полное отсутствие перегородки между желудочками.
Гемодинамическая сущность порока
Гемодинамическая сущность порока состоит в сбросе в фазу систолы артериальной крови из левого желудочка в правый, вследствие чего в систему малого круга попадает избыточный объём крови, что приводит к развитию гиперволемии сосудов лёгких с возникновением в последующем склеротической гипертензии. Прогрессирование гипертензии зависит главным образом от величины дефекта в перегородке, но необратимые изменения в лёгких могут развиться довольно быстро и обусловить функциональную неопе-рабельность больного, несмотря на отсутствие субъективных ощущений.
Клиническая картина
Клиническая картина у больных с дефектом межжелудочковой перегородки разнообразна и определяется главным образом размерами соустья и величиной сброса артериальной крови в систему малого круга. Наиболее частые жалобы — быстрая утомляемость, одышка, боли в области сердца и ощущение перебоев в его работе. В большинстве случаев происходит отставание ребёнка в физическом развитии. С прогрессированием лёгочной гипертензии давление в лёгочной артерии становится выше, чем в аорте, и изменяется направление шунта: венозная кровь смешивается с артериальной уже в левом желудочке, у больных появляется цианоз. Но, как правило, они редко доживают до этой (терминальной) стадии порока, так как развивается декомпенсация правого желудочка или естественное течение порока обрывается присоединяющимся инфекционным эндокардитом. Средняя продолжительность жизни детей с дефектом межжелудочковой перегородки без операции составляет около 15 лет.

Рис29-6. Схема локализации основных типовдефектов межкишечной перегородки (сверху вниз): надгребешковый, подгребешковый, канальный и мышечный типы.
Диагностика
Диагностика порока не представляет трудностей. Дефект межжелудочковой перегородки проявляется довольно интенсивным грубым систолическим шумом с эпицентром, соответствующим проекции отверстия в перегородке на передней грудной стенке. Как правило, это левый край тела грудины. Часто отмечают распространение шума вправо соответственно направлению струи крови, проходящей через дефект межжелудочковой перегородки. При гипертензии малого круга возникает акцент II тона над лёгочной артерией. ЭКГ указывает на комбинированную перегрузку желудочков с преобладанием перегрузки левого желудочка. Рентгенологическое исследование органов грудной клетки выявляет увеличение сердца за счёт правого желудочка, правого предсердия, выбухания лёгочного ствола. Лёгочный сосудистый рисунок обычно значительно усилен, а корни подчёркнуты и могут пульсировать. Вместе с тем, эти рентгенологические признаки нельзя считать патогномоничными. При неопределённости аускультативной картины необходимы катетеризация камер сердца, измерение давления в его полостях и сосудах, а также киноангиокардиография. Дефект межжелудочковой перегородки можно визуализировать с помощью эхокардиографии.
Лечение
Лечение только оперативное, в условиях искусственного кровообращения. Дефект ушивают различными приёмами или закрывают с помощью каких-либо пластических материалов (рис. 29-7). Ушивание небольших дефектов межжелудочковой перегородки можно выполнить и без искусственного кровообращения — в условиях общей или краниоцеребральной гипотермии. При своевременном выполнении оперативного пособия результаты лечения, как правило, хорошие.
Тетрада Фалло
Это наиболее часто встречающийся порок синего типа. Его анатомическая сущность заключается в сочетании сужения выходного отдела правого желудочка, высокого дефекта межжелудочковой перегородки, смещения устья аорты вправо (декстрапозиция) и гипертрофии миокарда правого желудочка (рис. 29-8).
Гемодинамическая сущность порока
Основные нарушения гемодинамики при тетраде Фалло обусловлены тем, что венозная кровь из правого желудочка по время его систолы с трудом и в недостаточном количестве попадает в лёгочный ствол, вследствие чего возникает гиповолемия малого круга кровообращения. Большая часть венозной крови из правого желудочка через дефект межжелудочковой перегородки попадает в левый желудочек и аорту, смешиваясь с артериальной, что обусловливает цианоз кожных покровов.
Клиническая картина и диагностика
Тетрада Фалло сопровождается одышкой даже в состоянии покоя. Обращает на себя внимание цианоз кожных покровов и слизистых оболочек различной интенсивности. Пальцы рук деформированы в виде «барабанных палочек», ногти — в виде «часовых стёкол». Дети


Рис. 29-8. Тетрада Фало (схема): 1 —стеноз устья лёгочного ствола; 2 — дек-страпозиция аорты; 3 — высокий дефект межжелудочковой перегрородки; 4 — гипертрофия миокарда правого желудочка.
обычно значительно отстают в физическом развитии, часто болеют различными респираторными заболеваниями, ангинами и т.п. Грудная клетка, как правило, деформирована. После физической нагрузки возникают одышечно-цианотические приступы. Они бывают следствием хронической субпороговой ишемии мозга, проявляются одышкой, тахикардией, нередко с аритмией и усилением цианоза. Часто больные принимают положение на корточках, что облегчает их состояние, так как в этих условиях, по-видимому, увеличивается сопротивление в большом круге кровообращения, благодаря чему возрастает лёгочный кровоток.
Аускулътативно порок проявляется грубым пансистолическим шумом с максимумом звучания в четвёртом межреберье слева от грудины. II тон над лёгочной артерией ослаблен. На ЭКГ отмечают признаки значительной перегрузки и гипертрофии правого желудочка, а рентгенологически выявляют характерную конфигурацию сердца — западание лёгочной артерии с высоко приподнятой и закруглённой верхушкой сердца (в виде «голландского башмачка»), лёгочный рисунок значительно обеднён. В боковых позициях определяют выраженное увеличение правого желудочка. При зондировании катетер не удаётся провести в лёгочную артерию, и он легко проходит из правого желудочка в аорту. Контрастное вещество, введённое в правый желудочек, попадает и в лёгочную артерию, и в аорту, причём степень контрастирования этих сосудов зависит от величины транспозиции аорты.
Продолжительность жизни больных тетрадой Фалло без хирургического лечения определяется степенью кислородного голодания и в среднем составляет около 10—14 лет.
Лечение
Лечение только оперативное. Во время одышечно-цианотическо-го приступа больному следует придать коленно-локтевое положение, дать кислород, ввести тримеперидин и препараты, снижающие сопротивление малого круга кровообращения. Радикальную коррекцию порока выполняют в условиях искусственного кровообращения. Она заключается в расширении выходного отдела правого желудочка (т.е. в ликвидации препятствия оттока крови в малый круг) и закрытии дефекта межжелудочковой перегородки с перемещением аорты в левый желудочек. Операция сопровождается довольно высокой летальностью в ближайшем послеоперационном периоде. Однако у выживших, как правило, отдалённые результаты вполне оправдывают риск вмешательства. Если тяжесть состояния больных или анатомические особенности порока не позволяют выполнить его радикальную коррекцию, применяют паллиативные операции. Смысл их заключается в обогащении кровью малого круга кровообращения (создают соустье между аортой и лёгочной артерией или между полыми венами и лёгочной артерией). Участи больных, кроме сужения собственно выходного отдела правого желудочка, отмечают тяжёлое сужение лёгочного ствола и его артерий вплоть до гипоплазии. Этим больным можно выполнить только паллиативную операцию.
Коарктация аорты
Порок характеризуется врождённым сужением или полным закрытием просвета аорты на ограниченном участке. Чаще всего (95%) это сужение располагается в области перешейка аорты, под которым понимают отрезок от левой подключичной артерии до первой пары межрёберных артерий (рис. 29-9). Возможны и другие локализации сужений — в восходящей, нисходящей грудной или брюшной аорте. Коарктация аорты составляет до 30% всех врождённых пороков сердца.
Гемодинамическая сущность порока
Нарушения гемодинамики заключаются в затруднении тока крови через суженный участок, в результате чего значительно возрастает АД в аорте и её ветвях выше места сужения (до 200 мм рт.ст. и более). Развивается синдром артериальной гипертензии в сосудах головного мозга и верхней половины тела, что влечёт за собой систолическую

Рис. 29-9. Коарктация аорты (схема): 1 — левая внутренняя грудная артерия; 2 — зона сужения; 3 — расширенные межрёберные артерии.
перегрузку левого желудочка, гипертрофию миокарда с последующей его дистрофией. Последняя усугубляется присоединением со временем коронарной недостаточности. В итоге развивается тяжёлая декомпенсация левого желудочка. Гипер-тензия в системе сосудов мозга приводит к появлению церебральных симптомов. Ниже места сужения АД значительно снижено, и кровоснабжение нижней части тела осуществляется преимущественно за счёт коллатерального кровообращения, которое не всегда бывает достаточным.
Клиническая картина и диагностика
Жалобы, как правило, отсутствуют. Лишь с достижением возраста половой зрелости могут появиться общая слабость, головокружение, головные боли, парестезии и зябкость ног. Диагностика заболевания весьма простая: знание этой патологии и внимательное обследование позволяют точно поставить диагноз в подавляющем большинстве случаев. Отсутствие пульсации на артериях ног при постоянном повышенном давлении в артериях верхних конечностей — патогно-моничный признак коарктации аорты. При неполной окклюзии просвета аорты в области коарктации пульсация на артериях ног может сохраняться, но быть ослабленной, что подтверждается и сниженным АД (у здорового человека АД на нижних конечностях на 20-40 мм рт.ст. выше, чем на верхних). При осмотре, кроме соответствующей формы тела (нередко атлетический тип сложения у мужчин, пикнический — у женщин), можно заметить пульсацию расширенных межрёберных артерий. Границы сердца, как правило, расширены влево за счёт гипертрофии левого желудочка. При аускулыпа-ции слышен систолический шум по всему левому краю грудины, а также со стороны спины над проекцией сужения аорты, а иногда и над расширенными, пульсирующими межрёберными артериями. ЭКГ-данные у детей могут выявить лишь признаки систолической перегрузки левого желудочка, у взрослых — его гипертрофию и коронарную недостаточность, нередко с диффузными изменениями миокарда.
На рентгенограммах определяют преимущественно аортальную конфигурацию сердца за счёт расширения левого желудочка. Характерный признак коарктации аорты — наличие узур нижнего края 3— 4-х пар рёбер. Узурация рёбер развивается вследствие деформации кости в области нижней бороздки резко расширенными и извитыми межрёберными артериями. Как пульсацию межрёберных артерий, так и узурацию рёбер можно выявить при пальпации грудной клетки больного. На томограмме обычно хорошо видно место сужения аорты. Ангиокардиография показана в неясных случаях или при подозрении на сочетание коарктации аорты с другими пороками. Наиболее частые из них — открытый артериальный проток и стеноз устья аорты. В более поздние сроки может развиться недостаточность аортального клапана вследствие дистрофических изменений в основании восходящей аорты.
Средняя продолжительность жизни неоперированных больных 25-30 лет. Наиболее частая причина смерти — внутричерепные кровоизлияния, разрывы аорты, инфаркт миокарда, острая сердечная недостаточность и инфекционный эндокардит.
Дифференциальную диагностику коарктации аорты следует проводить с вегето-сосудистой дистонией, гипертонической болезнью, вазоренальной гипертонией, другими пороками сердца и заболеваниями почек, сопровождающимися артериальной гипертензией. Наибольшее количество ошибок в распознавании этого порока связано с забвением основных клинических проявлений заболевания, недооценкой общих врачебных методов исследования, пренебрежением к пальпации артерий конечностей, а также измерению АД на ногах и сравнительной оценкой полученных данных.
Лечение
Лечение только оперативное. Идеальный вид операции, особенно у растущих детей, — резекция суженного участка аорты с её анастомозом по типу «конец в конец» (рис. 29-10). Однако такая операция нередко невыполнима при выраженной протяжённости сужения и тяжёлых склеротических изменениях стенки сосуда. В подобной ситуации проводят протезирование аорты синтетическим протезом, а также пластику места сужения синтетической заплатой (рис. 20-11) или левой подключичной артерией. Части пациентов можно выполнить баллонную дилатацию коарктации в условиях рентгеноперационной.
Прогноз
Результаты оперативного лечения в значительной степени зависят от возраста больного. Наилучшими они оказываются у детей, оперированных в возрасте до 3 лет, когда нет тяжёлых изменений стенки аорты и межрёберных артерий, а также имеются более благоприятные условия для радикальной коррекции порока, устранение которого обычно приводит к нормализации АД. Операция у взрослых значительно сложнее в техническом отношении и, как правило, даёт значительно менее выраженный гипотензивный эффект, так как в генезе артериальной гипертензии значительную роль играют изменения в центральной регуляции сосудистого тонуса и почечные механизмы формирования гипертензии. Вместе с тем, после устранения коарк-тации артериальная гипертензия становится «более управляемой» медикаментозными средствами, что позволяет предупредить развитие перечисленных выше тяжёлых осложнений. Через 1,5—3 года после коррекции порока артериальная

Рис. 29-10. Наложение анастомоза «конец в конец» после резекции коаркта-ции аорты.
 гипертензия
становится менее выраженной.
Таким образом, оперативное лечение
коарктации аорты у взрослых в комплексе
с антигипертензивной медикаментозной
терапией в послеоперационном периоде
позволяет значительно продлить
жизнь больных и улучшить её качество.
гипертензия
становится менее выраженной.
Таким образом, оперативное лечение
коарктации аорты у взрослых в комплексе
с антигипертензивной медикаментозной
терапией в послеоперационном периоде
позволяет значительно продлить
жизнь больных и улучшить её качество.
Рис29-11. Непрямая истмопластика грудной аорты синтетической заплатой.
