
- •2. Химическое равновесие
- •2.1. Истинное и кажущееся равновесие, смещение равновесия
- •2.2. Количественные характеристики равновесия
- •Задачи и упражнения
- •2.1. Устойчивое и кажущееся равновесие, смещение равновесия
- •2.2. Количественные характеристики равновесия
- •3. Некоторые равновесия в растворах
- •3.1 Образование растворов, растворимость
- •3.2 Равновесие диссоциации электролитов
- •3.3. Шкала термодинамических функций образования ионов в водных растворах
- •3.4 Равновесие растворения и диссоциации малорастворимого
- •3.5 Равновесие диссоциации воды, буферные растворы
- •3.6. Гидролиз солей
- •Задачи и упражнения
- •3.1. Образование растворов, растворимость
- •3.2. Равновесие диссоциации электролитов
- •3.3. Шкала термодинамических функций образования ионов в водных растворах
- •3.4. Равновесие растворения и диссоциации малорастворимого электролита
- •3.5. Равновесие диссоциации воды, буферные растворы
- •3.6. Гидролиз солей
Задачи и упражнения
3.1. Образование растворов, растворимость
Пример 1. Пользуясь справочными данными, определить давление паров над водой при 298,15 К.
Решение. Равновесие испарения воды
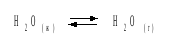
описывается соответствующей константой, численно равной давлению водяных паров (концентрация жидкой воды постоянна и равна 1!):
Kравн = PH2O .
Находим величину G0 указанного процесса:
G0=G0обрH2O(г)–G0обрH2O(ж)= –228,6 – (–237,3) = 8,7 кДж .
Вычисляем давление паров воды:
G0 = – RTlnKравн = –RTlnPH2O;
![]()
Пример 2.Пользуясь справочными данными, определить растворимость йода в воде при 298,15 К.
Решение.Для равновесия
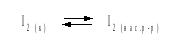
константа равновесия равна:
Kравн=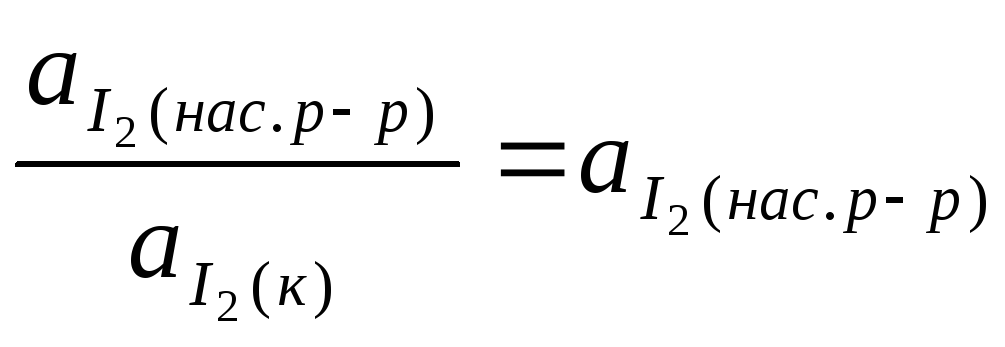 .
.
Определим G0для указанного процесса:
G0=G0обр I2 (р-р, ст.с)–G0 обр I2 (к)=G0 обр I2 (р-р, ст.с)= 16 кДж .
Далее:
G0 = – RTlnKравн = –RTln a I2 (нас.р-р) = G0 обр I2 (р-р, ст.с)
![]()
Как видно, растворимость йода в воде мала, поэтому активность можно уверенно считать равной концентрации (коэффициент активности равен единице). Таким образом, растворимость йода в воде при 298,15 К составляет 1,6·10-3 моль/л или 0,40 г/л.
Пример 3.44,8 л (н.у.) хлороводорода растворили в 300 мл воды. Определить моляльность полученного раствора и массовую долю НСlв нем.
Решение. 44,8 л (н.у.) хлороводорода составляют 2 моль и имеют массу 2·36,5 = 73,0 г. Масса полученного раствора составляет (плотность воды 1,00 г/мл): 300 · 1 + 73,0 = 373,0 г.
Определяем массовую долю хлороводорода в растворе:
![]() .
.
Наконец, находим моляльность полученного раствора:
2 моль НСl – 0,30 кг Н2О
Х – 1,00 кг, откуда Х = mр-ра = 6,67 моль/кг.
Пример 4. Какой объем 3,00 мас.% раствора NaCl (плотность раствора 1,020 г/мл) и 12,00 мас.% раствора NaCl (плотность раствора 1,086 г/мл) необходимо смешать для приготовления 400 мл 7,50 мас.% раствора этого соединения с плотностью 1,053 г/мл?
Решение. Задача сводится к составлению двух материальных балансов – масса приготовляемого раствора равна сумме масс составляющих его растворов и масса растворенного вещества в приготовляемом растворе равна сумме масс этого вещества в двух исходных растворах. Необходимо помнить, что для объемов растворов это правило не выполняется! Пусть необходимый объем 3,00 мас.% раствора составляет Х мл, а объем 12,00 мас.% раствора – Y мл.
Первое уравнение:
1,020X + 1,086Y = 4001,053 = 421,2;
второе уравнение:
0,031,020X + 0,121,086Y = 0,075421,2 = 31,6
Решение этой системы уравнений приводит к результату: Х = 205,4 мл, Y= 194,8мл.
Пример 5. Сколько граммов кристаллогидрата Na2SO410H2O и мл воды необходимо для приготовления 400 мл 15 мас.% раствора Na2SO4 с плотностью 1,142 г/мл. Определить молярность, моляльность, титр приготовленного раствора, а также мольную долю Na2SO4 в растворе.
Решение. Определим содержание Na2SO4 в приготовляемом растворе:
mNa2SO4 = mр-ра 0,15 = 400 1,142 0,15 = 68,5 г .
Молярная масса Na2SO4 составляет 142 г/моль, a Na2SO410H2O – 322 г/моль. Соответственно, 68,5 г Na2SO4 содержатся в 68,5322/142 = 155,3 г кристаллогидрата. Наконец, находим массу (объем) воды, необходимой для приготовления раствора:
mH2O = VH2O = m р-ра – m кр-та = 400 1,142 – 155,3 = 301,5 г или 301,5 мл.
Теперь решаем отдельную задачу о нахождении молярности, моляльности, титра и мольной доли соли в 15 мас.% растворе Na2SO4. Поскольку в определении молярности и титра задействованы литр и миллилитр, целесообразно отталкиваться от объема раствора, равного 1 л. Итак пусть имеется 1 л 15 мас.% раствора Na2SO4 с плотностью 1,142 г/мл. Находим массу растворенной в нем соли и переводим в моли:
mNa2SO4в 1 л р-ра = 1000 1,142 0,15 = 171,3 г
![]()
Тут же легко находится титр: Т = 171,3 / 1000 = 0,1713 .
Теперь определим массу воды в 1 л раствора:
mH2O = 1142 - 171,3 = 970,7 г
и вычисляем моляльность:
![]() .
.
В 1 л раствора находится 1,21 моль соли и 970,7/18 = 53,9 моль воды, отсюда мольная доля соли составляет:
мольная
доля![]() .
.
![]()
Пример 6. Сколько мл 20 мас.% раствора NaOH необходимо прилить к 500 мл 5 мас.% раствора того же соединения для получения 2М раствора NaOH. Плотности растворов равны соответственно 1,219; 1,054 и 1,080 г/мл.
Решение.Решение задачи сводится к нахождению числа молей NaOH в приготовляемом растворе и его объема (в литрах).
Пусть необходимо прилить Х мл 20 мас.% раствора. Определим число молей (количество вещества) NaOH в двух сливаемых растворах:
![]()
![]()
Объем окончательного раствора находим через его массу и плотность:
mр-ра= mр-ра(1)+ mр-ра(2)= 5001,054 + Х1,219 = 527 + 1,219Х
![]()
Согласно условию, число молей NaOH, отнесенное к объему раствора в литрах, равняется двум:
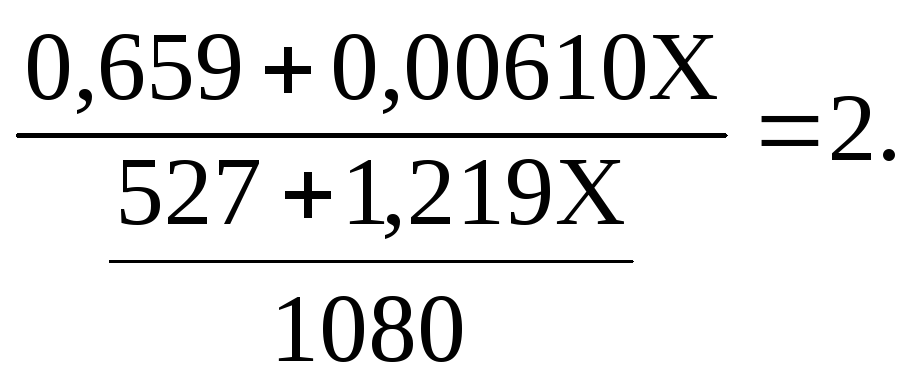
Решение этого уравнения и дает ответ – необходимо прилить 82,5 мл 20 мас.% раствора.
Пример 7. Раствор имеет мольное отношение NaOH : H2O = 1 : 100. Определить концентрацию этого раствора в мас.% и его моляльность.
Решение. Раствор содержит 1 моль NaOH и 100 моль Н2O, что составляет 40 г и 10018 = 1800 г соответственно. Находим моляльность:
1 моль NaOH – 1,8 кг Н2О
Х – 1 кг Н2О, откуда Х = m = 0,556.
Масса раствора составляет 40 + 1800 = 1840 г, а его концентрация
![]() мас.%
.
мас.%
.
