
- •2. Химическое равновесие
- •2.1. Истинное и кажущееся равновесие, смещение равновесия
- •2.2. Количественные характеристики равновесия
- •Задачи и упражнения
- •2.1. Устойчивое и кажущееся равновесие, смещение равновесия
- •2.2. Количественные характеристики равновесия
- •3. Некоторые равновесия в растворах
- •3.1 Образование растворов, растворимость
- •3.2 Равновесие диссоциации электролитов
- •3.3. Шкала термодинамических функций образования ионов в водных растворах
- •3.4 Равновесие растворения и диссоциации малорастворимого
- •3.5 Равновесие диссоциации воды, буферные растворы
- •3.6. Гидролиз солей
- •Задачи и упражнения
- •3.1. Образование растворов, растворимость
- •3.2. Равновесие диссоциации электролитов
- •3.3. Шкала термодинамических функций образования ионов в водных растворах
- •3.4. Равновесие растворения и диссоциации малорастворимого электролита
- •3.5. Равновесие диссоциации воды, буферные растворы
- •3.6. Гидролиз солей
3.5 Равновесие диссоциации воды, буферные растворы
Вода диссоциирует крайне незначительно в соответствии с уравнением:
![]()
Для простоты вместо иона гидроксония будем писать негидратированный ион, так как это не влияет на последующие выводы:
![]()
Пользуясь термодинамическими данными и помня, что концентра-ция индивидуального жидкого вещества равна единице, находим термодинамическую константу обсуждаемого равновесия
G0процесса = G0обрH+(р-р,ст.с) + G0обрOH-(р-р,ст.с) – G0обрH2O(ж) =
= 0 – 157,32 – (–237,25) = 79,93 кДж;
Кравн=
 = [H+][OH–]=
KW
– ионное
произведение воды. (3.17)
= [H+][OH–]=
KW
– ионное
произведение воды. (3.17)
Замена активностей ионов на концентрации оправдана тем, что вода диссоциирует в очень незначительной степени. Действительно, при 298,15К концентрации ионов Н+ и ОН– в воде составляют 110–7 моль/л. В 1 л воды, имеющей массу 1000 г, содержится 1000/18 = 55,5 моль воды. Следовательно, отношение недиссоциированных молекул к диссоциированным составляет 55,5/10–7 = 555000000. Иными словами, из 555 миллионов молекул воды диссоциирует лишь одна! В соответствии с (3.17) ионное произведение воды при 298,15 К равно:
КW
=
![]() =
=
![]() = 1,010–14
;
= 1,010–14
;
[H+][OH–]=1,010-14 . (3.18)
Логарифмируем выражение (3.18) и меняем знаки в обеих частях уравнения:
lg[H+] + lg[OH–] = – 14;
–lg[H+] – lg[OH–] = 14.
В учебной и научной литературе для выражения маленьких величин используют отрицательную десятичную логарифмическую шкалу:
рК = – lg К (читается "пе ка").
В соответствии с этим вводим величины рН и рОН, определяемые как:
pH = –lg[H+]; pOH = –lg[OH–] . (3.19)
Возвращаясь к предыдущим выкладкам, получаем, что для любого водного раствора при 298,15 К:
рН + рОН = 14. (3.20)
В воде в соответствии с уравнением ее диссоциации соответственно рН = рОН =7, это нейтральная среда. В кислых растворах [H+] >10–7 моль/л и рН<7 (рОН>7). В щелочных растворах [H+]<10–7 моль/л и рН>7 (рОН<7).
Получить растворы с большой концентрацией кислоты не представляет труда, например, H2SO4 и HNO3 неограниченно растворимы в воде и можно приготовить их водные растворы практически любой молярной концентрации. Однако с ростом концентрации кислоты уменьшается степень ее диссоциации и реальных системах получить растворы с концентрацией ионов водорода, большей 10 моль/л, практически невозможно. Учитывая это, получаем интервал изменения величин рН:
–1 < рН < 15. (3.21)
Растворы с постоянным значением рН, не зависящим от разбавления и слабо зависящим от небольших добавок сильных кислот и оснований, называются буферными. Буферные растворы на кислую область – смеси растворов слабых кислот и их солей. Буферным раствором на щелочную область является смесь водного раствора аммиака (NH4ОН) и солей аммония.
Продемонстрируем свойства буферного раствора на примере смеси уксусной кислоты и ацетата натрия. Уравнения диссоциации электролитов:
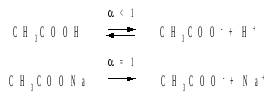
Диссоциация слабого электролита, уксусной кислоты, будет за счет диссоциации ацетата натрия подавлена так, что концентрация ацетат-иона будет практически полностью создаваться за счет диссоциации соли, а концентрация недиссоциированной уксусной кислоты фактически равна общей концентрации кислоты. Выражение для константы равновесия диссоциации уксусной кислоты:
Кдис=
![]()
[H+]
[H+]
![]()
Отсюда концентрация ионов водорода составляет:
[H+]
Кдис![]() (3.22)
(3.22)
Как видно из (3.22), при разбавлении буферного раствора водой концентрации кислоты и соли синхронно уменьшаются в одинаковое число раз, а их отношение, а значит и концентрация ионов водорода, останется неизменным. Добавление в буферную смесь нескольких капель концентрированного раствора НСl приведет к небольшому увеличению концентрации уксусной кислоты и уменьшению концентрации соли, а значение дроби скислоты/ссоли изменится мало. Аналогичная ситуация будет и при добавлении в буферную смесь нескольких капель концентрированного раствора едкого натра – несколько уменьшится концентрация уксусной кислоты и возрастет концентрация соли, а отношение скислоты/ссоли изменится мало.
