
- •2. Химическое равновесие
- •2.1. Истинное и кажущееся равновесие, смещение равновесия
- •2.2. Количественные характеристики равновесия
- •Задачи и упражнения
- •2.1. Устойчивое и кажущееся равновесие, смещение равновесия
- •2.2. Количественные характеристики равновесия
- •3. Некоторые равновесия в растворах
- •3.1 Образование растворов, растворимость
- •3.2 Равновесие диссоциации электролитов
- •3.3. Шкала термодинамических функций образования ионов в водных растворах
- •3.4 Равновесие растворения и диссоциации малорастворимого
- •3.5 Равновесие диссоциации воды, буферные растворы
- •3.6. Гидролиз солей
- •Задачи и упражнения
- •3.1. Образование растворов, растворимость
- •3.2. Равновесие диссоциации электролитов
- •3.3. Шкала термодинамических функций образования ионов в водных растворах
- •3.4. Равновесие растворения и диссоциации малорастворимого электролита
- •3.5. Равновесие диссоциации воды, буферные растворы
- •3.6. Гидролиз солей
3.2 Равновесие диссоциации электролитов
Количественной характеристикой диссоциации является степень диссоциации α, равная отношению числа распавшихся на ионы молекул к общему их числу. Ее обычно выражают либо в долевом исчислении, либо в процентах. Например, если из 100 молекул 27 распалось на ионы, то степень диссоциации электролита составляет 0,27 или 27%.
Современные представления о диссоциации электролитов предполагают помимо процесса диссоциации на ионы разнообразные процессы ионной ассоциации, то есть образование из индивидуальных ионов ионных пар, тройников и т.д. Соответственно различают ионизирующую и диссоциирующую способности растворителей.
Собственно представления об образовании в растворах электролитов ионных пар или более сложных частиц являют собой применение к данным системам широко распространенных в химии представлений о комплексообразовании.
Диссоциирующая сила растворителя определяется главным образом уменьшением электростатического взаимодействия, то есть значением диэлектрической проницаемости данного растворителя. Тогда как ионизирующая способность растворителя определяется не величиной диэлектрической проницаемости, а способностью молекул растворителя к специфической сольватации за счет донорно-акцепторного взаимодействия. Поэтому хорошо диссоциирующий растворитель не всегда является сильно ионизирующим.
Вода обладает как ионизирующей, так и диссоциирующей способностью. В растворителях с диэлектрической проницаемостью меньше 10 практически нет свободных ионов, а при диэлектрической проницаемости свыше 40 для растворов электролитов концентации не ниже 0,01 М степень диссоциации, как правило, превышает 50%. В промежуточной области значений диэлектрической проницаемости в растворе в общем случае есть ионы и ионные пары, соотношение между ними определяется размерами и зарядами ионов и природой растворителя.
Современные представления о растворах электролитов опираются на концепцию ассоциированных (α < 1) и неассоциированных (α = 1) электролитов. В последнем случае следует говорить о полной диссоциации электролита с определенной точностью, так как последовательное применение учения о равновесии запрещает представления о действительно полной диссоциации электролита. Под ассоциированными электролитами понимают недиссоциированные молекулы, разнообразные ионные ассоциаты и комплексы.
Для водных растворов до сих пор широко используются представления о сильных и слабых электролитах, восходящие к создателю теории электролитической диссоциации С. Аррениусу. Сильными электролитами считают те, для которых условно принимают = 1 при любых концентрациях. К таким электролитам относят все средние соли; кислоты: галогеноводородные (кроме HF), азотную, хлорную, серную (только по первой ступени); основания: все гидроксиды щелочных металлов, гидроксиды кальция, стронция и бария. Еще раз подчеркнем, что полная диссоциация этих электролитов и тем более при любых концентрациях является фактически постулатом. Многие из перечисленных электролитов не только не распадаются полностью на ионы при любых концентрациях, но даже в разбавленных растворах имеют значения существенно меньше единицы. Так например, хлорид алюминия при молярности раствора 0,02 имеет степень диссоциации 20%. Иными словами, при указанной концентрации 80% ионов Аl3+ связаны в ионную пару АlСl2+.
К слабым электролитам в водных растворах относят кислоты: угольную, сернистую, сероводородную, серную (по второй ступени), ортофосфорную, фтористоводородную, все карбоновые кислоты; основания: гидроксиды магния, бериллия, алюминия, аммония, все гидроксиды d-элементов.
Константа равновесия диссоциации электролита:
![]() (3.3)
(3.3)
называется константой диссоциации:
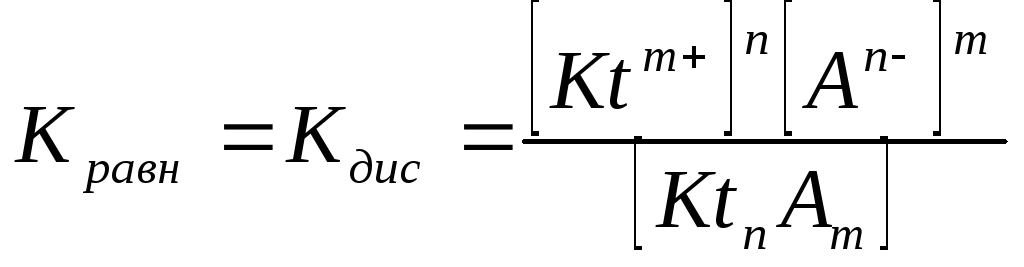 (3.4)
(3.4)
Формально Кдис для неассоциированного (сильного) электролита равна бесконечности. Для слабых электролитов эта величина конечна. Разумеется в выражении термодинамической константы диссоциации должны фигурировать величины активностей, а не концентраций.
Рассмотрим равновесие ступенчатой диссоциации электролитов на примере ортофосфорной кислоты:
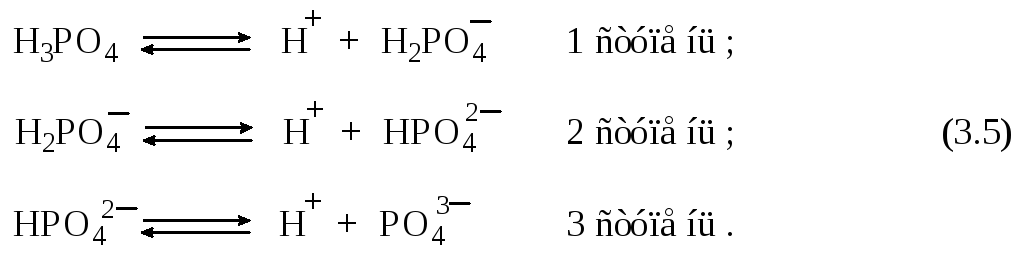
Отрыв протона от анионов H2PO4– и HPO42– происходит несомненно в меньшей степени, чем отрыв протона от нейтральной молекулы H3РО4. Кроме того, ионы водорода, образовавшиеся в первой ступени диссоциации, подавляют вторую ступень диссоциации, ионы водорода, образовавшиеся в первой и второй ступенях, подавляют третью ступень диссоциации. В результате реально диссоциация протекает лишь по первой ступени. Например, для водных растворов неорганических кислот, являющихся слабыми электролитами и диссоциирующими ступенчато, степень диссоциации по последующей ступени меньше степени диссоциации по предыдущей ступени в сотни раз. Это находит свое отражение в величинах констант ступенчатой диссоциации. Так для H3PO4 при 298,15 К они равны:
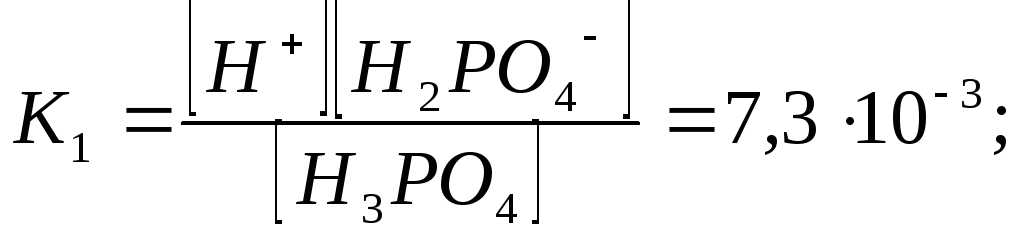
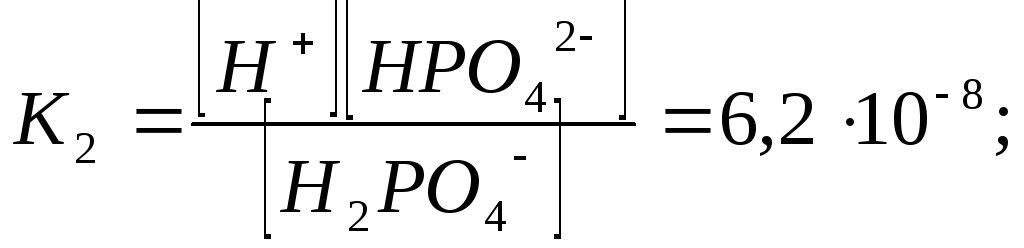 (3.6)
(3.6)
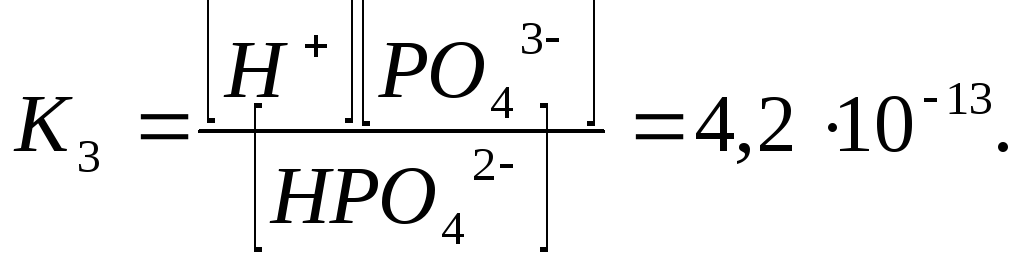
Из изложенного вытекает вывод, что диссоциацию любого слабого электролита, независимо от того, диссоциирует он ступенчато или нет, можно смоделировать равновесием диссоциации симметричного электролита:
![]()
Пусть общая концентрация электролита KtA составляет с моль/л; степень диссоциации при этой концентрации равна . Тогда равновесные концентрации катиона, аниона и недиссоциированного электролита составят:
[Ktn+]=[An-]=c; [KtA]=c–c
Подставляем эти соотношения в выражение для константы диссоциации:
![]() (3.8)
(3.8)
Соотношение (3.8), связывающее константу диссоциации с концентрацией электролита и степенью его диссоциации носит название закона разбавления Оствальда. Зачастую степень диссоциации электролита мала ( << 1), тогда выражение (3.8) упрощается:
Кравн а2с (3.9)
