
- •2. Химическое равновесие
- •2.1. Истинное и кажущееся равновесие, смещение равновесия
- •2.2. Количественные характеристики равновесия
- •Задачи и упражнения
- •2.1. Устойчивое и кажущееся равновесие, смещение равновесия
- •2.2. Количественные характеристики равновесия
- •3. Некоторые равновесия в растворах
- •3.1 Образование растворов, растворимость
- •3.2 Равновесие диссоциации электролитов
- •3.3. Шкала термодинамических функций образования ионов в водных растворах
- •3.4 Равновесие растворения и диссоциации малорастворимого
- •3.5 Равновесие диссоциации воды, буферные растворы
- •3.6. Гидролиз солей
- •Задачи и упражнения
- •3.1. Образование растворов, растворимость
- •3.2. Равновесие диссоциации электролитов
- •3.3. Шкала термодинамических функций образования ионов в водных растворах
- •3.4. Равновесие растворения и диссоциации малорастворимого электролита
- •3.5. Равновесие диссоциации воды, буферные растворы
- •3.6. Гидролиз солей
3.2. Равновесие диссоциации электролитов
Пример 1. Константа диссоциации муравьиной кислоты 1,7010–4. Найти концентрацию ионов водорода и степень диссоциации кислоты в ее 1 М растворе.
Решение.В соответствии с уравнением диссоциации кислоты:
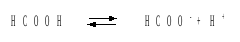
записываем выражение для константы диссоциации:
Кдис
=
![]() .
.
Концентрация ионов водорода существенно меньше единицы и ею можно пренебречь. Находим концентрацию ионов водорода:
![]() .
.
Наконец, определяем степень диссоциации кислоты:
![]() или
1,31 %.
или
1,31 %.
Пример 2.Степень диссоциации слабой одноосновной кислоты в 0,1 М растворе составляет 0,1 %. Найти концентрацию ионов водорода в ее 1 М растворе.
Решение.Для нахождения константы диссоциации кислоты воспользуемся соотношением
Кдис
=
![]() .
.
В соответствии с уравнением диссоциации кислоты
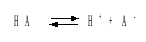
константа диссоциации связана с концентрацией ионов водорода следующим образом:
Кдис
=![]()
Определяем концентрацию ионов водорода в 1 М растворе:
![]() моль/л
.
моль/л
.
Пример 3. В 1 л 0,1 М раствора уксусной кислоты растворили 4,48 л (н.у.) хлороводорода. Как изменилась при этом степень диссоциации уксусной кислоты? Принять объем окончательного раствора равным 1 л, константа диссоциации уксусной кислоты составляет 1,7510–5.
Решение.Определим степень диссоциации уксусной кислоты в исходном растворе:

Кдис
=

![]() .
.
В соответствии с уравнением диссоциации появление в растворе сильной хлороводородной кислоты приведет к резкому смещению равновесия диссоциации уксусной кислоты влево. Пусть концентрация ионов водорода, образующихся за счет собственной диссоциации уксусной кислоты равна Х моль/л, такова же концентрация и ацетат-анионов; общая концентрация ионов водорода в растворе составит (X + 0,2) моль/л (4,48 л хлороводорода составляют 0,2 моль). Подставляем эти величины в выражение для константы диссоциации и находим X:
Кдис
=![]() .
.
Определяем степень диссоциации уксусной кислоты в окончательном растворе:
![]() .
.
Таким образом, введение в раствор 0,2 моль хлороводорода привело к уменьшению степени диссоциации уксусной кислоты в:
![]() раз.
раз.
Пример 4. Константы ступенчатой диссоциации сероводородной кислоты составляют 9,7410–8, 1,3610–13. Найти концентрации ионов Н+, HS– и S2– в 0,01 М растворе этой кислоты.
Решение. В соответствии с уравнением диссоциации H2S по первой ступени
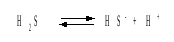
определяем концентрацию ионов Н+и HS– :
Кдис(1) =
![]() ;
;
![]()
Диссоциация по второй ступени

протекает в значительно меньшей степени за счет подавления ее продуктами диссоциации по первой ступени и большей трудности отрыва протона от аниона по сравнению с нейтральной молекулой. Пусть концентрация анионов серы в растворе равна Х моль/л, концентрация ионов водорода составит (X + 3,1210–5) моль/л, а концентрация ионов HS– – (3,1210–5 – X) моль/л. Подставляем эти величины в выражение для второй константы диссоциации:
Кдис(2)
=![]() .
.
Таким образом, концентрация аниона серы практически равна значению второй константы диссоциации кислоты.
3.3. Шкала термодинамических функций образования ионов в водных растворах
Пример 1.На основе справочных данных определить вторую константу диссоциации ортофосфорной кислоты при 298,15 К.
Решение.Второй ступени диссоциации ортофосфорной кислоты соответствует процесс:

Находим стандартную энергию Гиббса этого процесса:
G0=G0обрH+(р-р, ст.с) + G0обрHPO42-(р-р, ст.с, гип.недис) –
– G0обрH2PO4- (р-р, ст.с, гип.недис) = 0 + (–1083,2) – (–1124,3) = 41,1 кДж .
Затем определяем константу диссоциации:
G0 = –RTlnKравн = –RTlnKдис(2)
Кдис(2) =![]() .
.
Пример 2. Стандартная энтальпия образования NaCl (к) равна –411,1 кДж/моль, энтальпия растворения этого соединения в воде с образованием бесконечно разбавленного раствора равна 3,6 кДж/моль, а стандартная энтальпия образования аниона хлора в водном растворе составляет –167,1 кДж/моль. Определить стандартную энтальпию образования иона Na+ .
Решение. Ключом к нахождению искомой величины является положение, что стандартная энтальпия образования NaCl в растворе равна сумме стандартных энтальпий образования ионов Na+ и Сl– в растворе. Первая же величина, в свою очередь, равнасумме стандартных энтальпий образования NaCl (к) и энтальпии его растворения с образованием бесконечно разбавленного раствора. Таким образом:
H0обр NaCl(р-р, ст.с)= H0обр Na+(р-р, ст.с)+ H0обр Cl-(р-р, ст.с)= = H0обр NaCl(к)+ H0раств;
H0обр Na+(р-р, ст.с)= H0обр NaCl (к)+ H0раств– H0обр Cl-(р-р, ст.с)=
= –411,1 + 3,6 – (–167,1) = –240,4 кДж/моль .
Пример 3. По следующим данным:
H0обр NaCl(р-р, ст.с)= –407,5 кДж/моль = H01;
H0обр KCl(р-р, ст.с)= –419,4 кДж/моль = H02;
H0обр NaBr(р-р, ст.с)= –361,8 кДж/моль = H03;
H0обр NaI(р-р, ст.с)= –295,6 кДж/моль = H04 .
определить H0обрKBr(р-р, ст.с);H0обрKI(р-р, ст.с) .
Решение.Поскольку стандартные энтальпии образования электролитов в растворе тождественно равны сумме стандартных энтальпий образования составляющих их ионов, можно записать:
H0обрKCl(р-р, ст.с)– H0обрNaCl(р-р, ст.с)= H0обрK+(р-р, ст.с)+
+ H0обрCl– (р-р, ст.с)– H0обрNa+(р-р, ст.с)– H0обрCl–(р-р, ст.с) =
= H0обрK+(р-р, ст.с)– H0обрNa+(р-р, ст.с)
Складываем эту величину c H0обрNaBr(p-p, ст.с)и получаем:
H0обрK+(р-р, ст.с)– H0обрNa+(р-р, ст.с) + H0обрNaBr(р-р, ст.с)=
= H0обрK+(р-р, ст.с)– H0обрNa+ (р-р, ст.с) + H0обрNa+ (р-р, ст.с) +
+ H0обрBr– (р-р, ст.с)= H0обрKBr(р-р, ст.с)
Находим одну из искомых величин:
H0обрKBr(р-р, ст.с)= H02 – H01 + H03 = –419,4 – (–407,5) + (–361,8) =
= – 373,7 кДж/моль.
Аналогично определяем H0обрKI(р-р, ст.с):
H0обрKCl(р-р, ст.с)– H0обрNaCl(р-р, ст.с)+ H0обрNaI(р-р, ст.с)=
= H0обрK+ (р-р, ст.с)– H0обрNa+ (р-р, ст.с) + H0обрNa+ (р-р, ст.с) +
+ H0обрI–(р-р, ст.с)= H0обрKI(р-р, ст.с)= H02 – H01 + H04 =
= –419,4 – (–407,5) + (–295,6) = – 307,5 кДж/моль.
