
- •2. Химическое равновесие
- •2.1. Истинное и кажущееся равновесие, смещение равновесия
- •2.2. Количественные характеристики равновесия
- •Задачи и упражнения
- •2.1. Устойчивое и кажущееся равновесие, смещение равновесия
- •2.2. Количественные характеристики равновесия
- •3. Некоторые равновесия в растворах
- •3.1 Образование растворов, растворимость
- •3.2 Равновесие диссоциации электролитов
- •3.3. Шкала термодинамических функций образования ионов в водных растворах
- •3.4 Равновесие растворения и диссоциации малорастворимого
- •3.5 Равновесие диссоциации воды, буферные растворы
- •3.6. Гидролиз солей
- •Задачи и упражнения
- •3.1. Образование растворов, растворимость
- •3.2. Равновесие диссоциации электролитов
- •3.3. Шкала термодинамических функций образования ионов в водных растворах
- •3.4. Равновесие растворения и диссоциации малорастворимого электролита
- •3.5. Равновесие диссоциации воды, буферные растворы
- •3.6. Гидролиз солей
3.6. Гидролиз солей
Пример 1. Определить рН 0,3 М раствора NH4Br, если константа диссоциации гидроксида аммония в водном растворе составляет 1,7110–5.
Решение.Бромид аммония гидролизован по катиону в растворе:
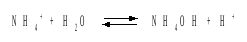
Согласно соотношению (3.23):
![]()
С другой стороны (соотношение 3.24):
![]()
Из этих двух выражений и вычисляем рН 0,3 М раствора NH4Br:
![]()
![]()
pH= –lg1,3210–5= 4,88 .
Пример 2. Определить рН раствора и степень гидролиза соли в 0,1 М растворе Na2S, если константы ступенчатой диссоциации H2S составляют: К1=9,7410–8; К2= 1,3610–13.
Решение.Сульфид натрия – соль, гидролизованная по аниону. Поскольку сероводородная кислота двухосновна, гидролиз идет по двум ступеням. Выше было показано, что для практических расчетов достаточно принимать во внимание лишь первую ступень гидролиза. В нашем случае это следующий процесс:

Определяем константу гидролиза:
![]()
С другой стороны:
![]()
Решая полученное квадратное уравнение, находим рН раствора и степень гидролиза:
[ОН–] = 0,0565 (второй корень уравнения отрицателен!)
рОН = – lg 0,0565 = 1,25; рН = 14 – 1,25 = 12,75;
![]()
Пример 3.рН 0,5 М раствора ацетата калия равен 9,23. Определить константу диссоциации уксусной кислоты.
Решение. Ацетат калия – соль, гидролизованная по аниону:
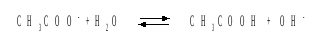
Согласно соотношению (3.27) для этой системы:
![]()
Находим величину константы гидролиза:
pH = 9,23; pOH = 14 – 9,23 = 4,77; [OH–] = 1,7010–5;
![]() .
.
С другой стороны, согласно (3.26) в случае гидролиза по аниону:
![]() .
.
Отсюда определяем константу диссоциации уксусной кислоты:
![]()
Пример 4. По справочным данным определить константу гидролиза НСООК при 298,15 К.
Решение.Формиат калия – соль, подвергающаяся гидролизу по аниону:
![]()
Константа равновесия этого процесса и есть константа гидролиза, она соответственно может быть найдена на основе стандартного значения энергии Гиббса:
G0 = G0обрOH–(р-р, ст.с) + G0обрHCOOH(р-р, ст.с., гип.недис)– G0обрH2O(ж) –
–G0обрHCOO–(р-р, ст.с)= –157,3 + (–373,0) – (–237,3) – (–351,5) = 58,5 кДж.
Далее находим константу гидролиза:
G0 = – RT ln Kгидр;
![]() .
.
Пример 5. На сколько единиц изменится рН раствора соли, гидролизованной по аниону, при его разбавлении в 100 раз?
Решение.В случае гидролиза по аниону согласно (3.27):
![]()
Запишем равенство величин констант гидролиза в растворах соли двух концентраций:

![]() .
.
Логарифмируем полученное соотношение и меняем знаки в уравнении:
2 lg [OH–]1 = 2 + 2 lg [OH–]2
– lg [OH–]1 = –1 – lg [OH–]2
pOH1 = pOH2 – 1
14 – pH1 = 14 – pH2 – 1
pH1 = pH2 + 1.
Таким образом, при разбавлении раствора соли, гидролизованной по аниону, в 100 раз, величина рН уменьшается на единицу.
