
- •2. Химическое равновесие
- •2.1. Истинное и кажущееся равновесие, смещение равновесия
- •2.2. Количественные характеристики равновесия
- •Задачи и упражнения
- •2.1. Устойчивое и кажущееся равновесие, смещение равновесия
- •2.2. Количественные характеристики равновесия
- •3. Некоторые равновесия в растворах
- •3.1 Образование растворов, растворимость
- •3.2 Равновесие диссоциации электролитов
- •3.3. Шкала термодинамических функций образования ионов в водных растворах
- •3.4 Равновесие растворения и диссоциации малорастворимого
- •3.5 Равновесие диссоциации воды, буферные растворы
- •3.6. Гидролиз солей
- •Задачи и упражнения
- •3.1. Образование растворов, растворимость
- •3.2. Равновесие диссоциации электролитов
- •3.3. Шкала термодинамических функций образования ионов в водных растворах
- •3.4. Равновесие растворения и диссоциации малорастворимого электролита
- •3.5. Равновесие диссоциации воды, буферные растворы
- •3.6. Гидролиз солей
3.6. Гидролиз солей
Поляризационное взаимодействие катионов и анионов с сильно полярными молекулами воды ведет к особой химической реакции ионного обмена, называемой гидролизом солей.
Качественную и количественную стороны гидролиза удобно рассматривать с позиции концепции сильных и слабых электролитов (неассоциированных и ассоциированных). Практически все электролиты, относящиеся к категории слабых в водных растворах (см. раздел 3.2), характеризуются тем, что равновесие их диссоциации смещено влево, в сторону недиссоциированных частиц. Иными словами, для них характерна не диссоциация, а наоборот – ассоциация, то есть связывание соответствующими анионами протонов, катионами – ионов ОН– в недиссоциированные частицы. А ионы Н+ и ОН– всегда имеются в воде за счет ее незначительной диссоциации. Рассмотрим более подробно происходящие процессы на примерах двух солей – CuCl2 и Na2CO3.
Хлорид меди (II) является сильным электролитом, поэтому в водном растворе полностью диссоциирует на ионы:
![]()
Гидроксид меди (II) относится к слабым электролитам (см. раздел 3.2), иными словами катион Cu2+ при наличии в растворе ионов ОН– будет активно связывать их в малодиссоциированную частицу СuОН+ , нарушая тем самым равновесие диссоциации воды:
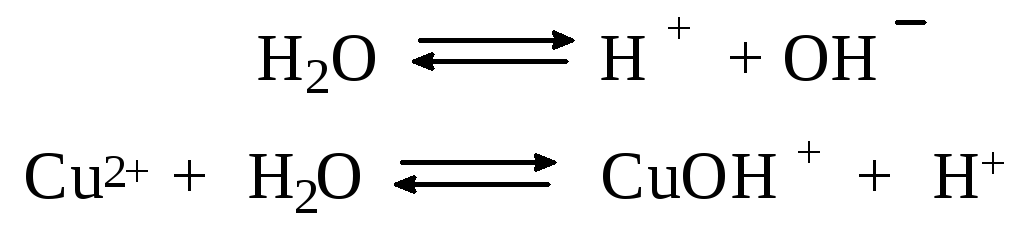
В результате, согласно принципу Ле Шателье, усилится диссоциация воды и в растворе увеличится концентрация ионов водорода по сравнению с той, которая была в воде. Раствор становится кислым, его рН<7, подобная ситуация называется гидролизом по катиону.
Разумеется, гидролиз хлорида меди может идти и дальше, по второй ступени:
![]()
Однако, принимая во внимание то, что продукты гидролиза по первой ступени подавляют вторую ступень и то, что поляризационное взаимодействие иона Cu2+ с молекулами воды несравненно сильнее, чем иона CuOH+, приходим к следующему важному выводу. При наличии возможности протекания ступенчатого гидролиза, этот процесс реально протекает лишь по первой ступени.
Сходная ситуация возникает и в растворе Na2COЗ. В результате полной диссоциации этой соли в растворе образуются ионы CO32–, являющиеся анионами слабой угольной кислоты. Этот ион при наличии в растворе протонов будет активно связывать их в малодиссоциированную частицу HCO3–, нарушая тем самым равновесие диссоциации воды:

В результате усилится диссоциация воды и в растворе увеличится концентрация ионов ОН– по сравнению с той, которая была в воде. Раствор стал щелочным, его рН > 7, в этом случае говорят о гидролизе по аниону.
Справедливости ради следует отметить, что реальный механизм гидролиза несколько иной. Любые ионы в водном растворе гидратированы и поляризационное взаимодействие осуществляется между ионом и молекулами воды, составляющими его гидратную оболочку, например:
![]()
Это уточнение никоим образом не изменяет сделанные выше выводы и не сказывается на дальнейших количественных выкладках.
Таким образом, гидролизу подвергаются либо соли, содержащие катионы слабых оснований (гидролиз по катиону), либо соли, содержащие анионы слабых кислот (гидролиз по аниону). Если же катион и анион в молекуле соли являются ионами соответствующих сильного основания и сильной кислоты, то в растворе такой соли гидролиза нет, его рН 7.
Если же соль содержит в своем составе катион слабого основания и анион слабой кислоты, то гидролиз в этом случае идет по двум направлениям и, как правило, глубоко. Что же касается кислотности такого раствора, то она будет определяться направлением преимущественного гидролиза.
Способы усиления гидролиза солей:
1) разбавление раствора соли;
2) нагрев раствора, поскольку энтальпии гидролиза положительны;
3) добавление щелочи в раствор для усиления гидролиза по катиону, добавление кислоты в раствор для усиления гидролиза по аниону.
Способы подавления гидролиза:
1) охлаждение раствора,
2) добавление кислоты в раствор для подавления гидролиза по катиону, добавление щелочи в раствор для подавления гидролиза по аниону.
Рассмотрим количественные характеристики гидролиза. Таковыми являются, в первую очередь, степень и константа гидролиза. Степенью гидролиза (h) аналогично степени диссоциации называют долю гидролизо-ванных молекул по отношению к общему числу молекул. Константа гидролиза представляет собой константу равновесия процесса гидролиза.
Выше было показано, что гидролиз протекает лишь по первой стадии. Первую стадию гидролиза по катиону можно записать в общем виде:

Константа равновесия этого процесса – константа гидролиза равна:
Кравн
= Кгидр =
![]() .
(3.23)
.
(3.23)
Домножаем числитель и знаменатель этого выражения на концентрацию иона ОН– и получаем:
Кгидр
=
![]() =
=![]() (3.24)
(3.24)
Таким образом, константа гидролиза по катиону равна отношению ионного произведения воды к константе диссоциации того самого слабого основания, чья соль подвергается гидролизу, или к константе диссоциации основания по соответствующей стадии.
Вернемся к соотношению (3.23). Пусть общая концентрация гидролизующейся соли в растворе равна с моль/л, а степень ее гидролиза – h. Тогда, учитывая, что [KtOH(n-1)+] = [H+] и h = [H+]/с, получаем из соотношения (3.23):
Кгидр
=
![]() .
(3.25)
.
(3.25)
Соотношение (3.25) по форме совпадает с выражением закона разбавления Оствальда (3.8), что лишний раз напоминает о генетической связи процессов гидролиза и диссоциации.
Первую стадию гидролиза по аниону можно записать в общем виде
с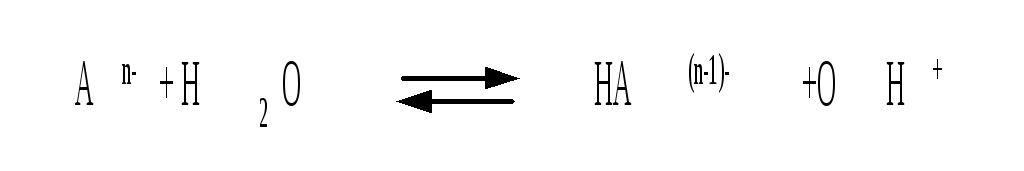 ледующим
образом:
ледующим
образом:
Константа равновесия этого процесса – константа гидролиза равна:
Кравн
= Кгидр =
![]() .
(3.26)
.
(3.26)
Домножаем числитель и знаменатель этого выражения на концентрацию иона Н+ и получаем:
Кгидр
=
![]() =
=![]() . (3.27)
. (3.27)
Таким образом, константа гидролиза по аниону равна отношению ионного произведения воды к константе диссоциации той самой слабой кислоты, чья соль подвергается гидролизу, или к константе диссоциации кислоты по соответствующей стадии. Обратимся снова к выражению (3.26). Преобразуем его, полагая, что общая концентрация соли в растворе равна с моль/л и, учитывая, что [HA(n–1)–] = [OH–]; h = [OH–] / c, получаем:
Кгидр=
![]() .
(3.28)
.
(3.28)
Выражения (3.23), (3.24) и (3.27), (3.28) являются достаточными для нахождения равновесных концентраций ионов, констант и степеней гидролиза в водных растворах гидролизующихся солей.
Нетрудно догадаться, что константа гидролиза соли, подвергающейся гидролизу по катиону и аниону одновременно, равна отношению ионного произведения воды к произведению констант диссоциации слабого основания и кислоты или произведению констант диссоциации соответствующих стадий. Действительно, гидролиз соли по катиону и аниону одновременно можно представить в общем виде следующим образом:
![]()
Константа гидролиза имеет вид:
Кгидр=
![]() . (3.29)
. (3.29)
Домножаем числитель и знаменатель соотношения (3.29) на КW и получаем:
Кгидр=
![]() .
(3.30)
.
(3.30)
Пусть общая концентрация соли, гидролизованной одновременно по катиону и аниону, равна c моль/л, степень гидролиза составляет h. Очевидно, что [KtОН]=[HA]=hc; [Kt+]=[A–]=c–hc. Подставляем эти соотношения в выражение (3.29):
Кгидр=
![]() .
(3.31)
.
(3.31)
Получился любопытный результат – концентрация явным образом не входит в выражение константы гидролиза, иными словами, степень гидролиза соли, подвергающейся гидролизу по катиону и аниону одновременно, будет одной и той же при любых концентрациях соли в растворе.
Найдем выражение для рН рассматриваемого раствора соли. Для этого числитель и знаменатель соотношения (3.29) домножим на концентрацию иона Н+ и преобразуем полученное выражение:
Кгидр=
![]() (3.32)
(3.32)
Наконец, получаем:
[H+]=Kдисс.к-ты![]() . (3.33)
. (3.33)
Остановимся теперь на связи характеристик гидролиза и диссоциации в случае ступенчатого гидролиза. В качестве примера рассмотрим гидролиз уже упоминавшегося карбоната натрия. Равновесие гидролиза Na2CO3 по ступеням и соответствующие константы равновесия приведены ниже:
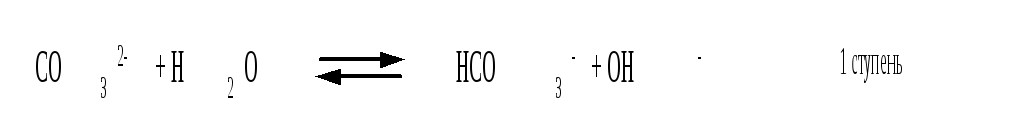
Кгидр(1)
=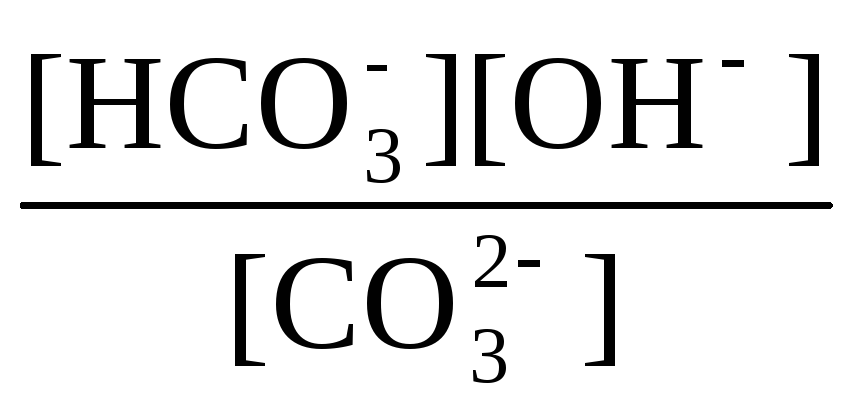 =
=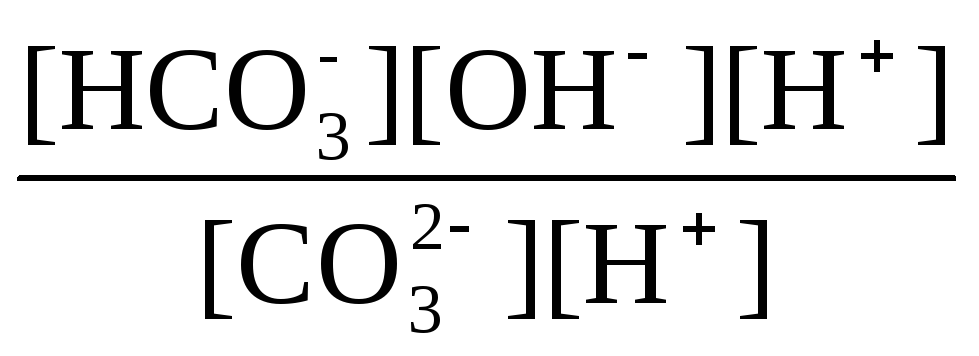 =
=![]() =
=![]() ;
;
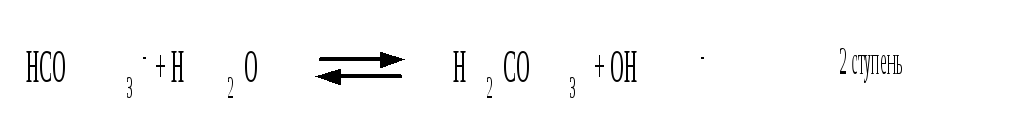
Кгидр(2)
=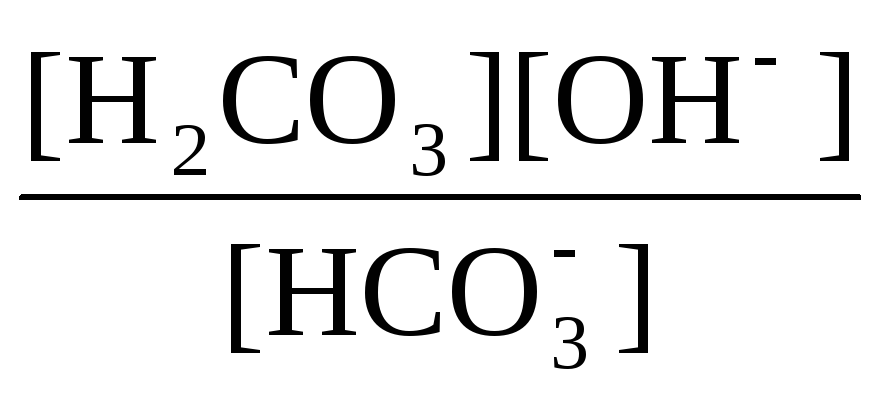 =
=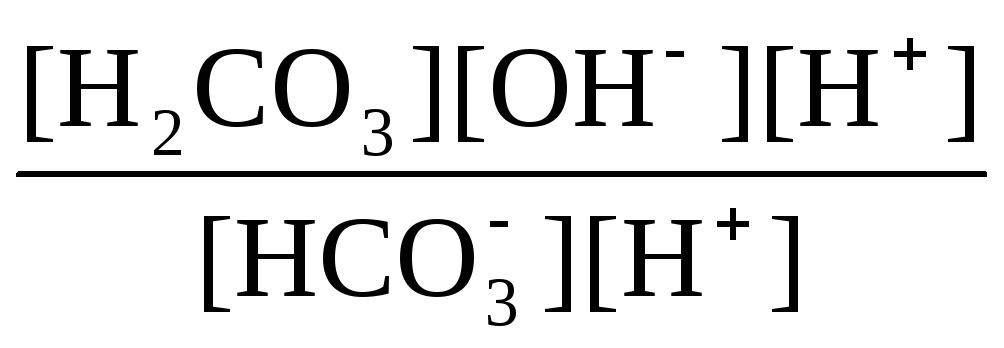 =
=![]() .
.
Таким образом, первой ступени гидролиза соответствует последняя ступень диссоциации соответствующего слабого электролита и наоборот – последней ступени гидролиза соответствует первая ступень диссоциации электролита. При анализе вопроса о гидролизе кислых солей необходимо сопоставлять значения констант гидролиза и констант диссоциации анионов. Если константа гидролиза больше константы диссоциации кислого аниона, то гидролиз по аниону имеет место и раствор характеризуется рН > 7. Если же константа гидролиза меньше константы диссоциации соответствующего кислого аниона, то гидролиз подавлен, реально протекает лишь диссоциация кислого аниона и раствор соли имеет рН < 7.
Выше отмечалось, что простейшим способом усиления гидролиза соли по катиону является введение в такой раствор щелочи. Аналогично для усиления гидролиза соли по аниону необходимо ввести в раствор кислоту. А что произойдет при сливании растворов двух солей, из которых одна гидролизована по катиону, а другая – по аниону, например, растворов Na2CO3 и CuCl2? Равновесия гидролиза в этих растворах:
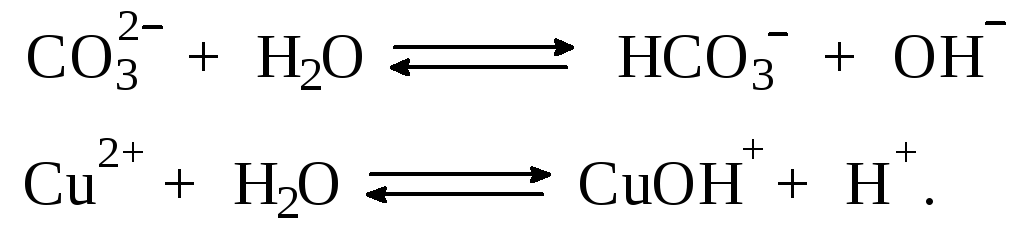
Как видно, гидролиз первой соли будет усиливать гидролиз второй и наоборот. В этом случае говорят о взаимном усилении гидролиза. Ясно, что в подобной ситуации образование продукта обменной реакции невозможно, должны образовываться продукты гидролиза. Состав их зависит от большого числа факторов: концентраций сливаемых растворов, порядка смешения, степени перемешивания и т.д.
В рассматриваемой системе (и подобных ей) образуются основные карбонаты, в некотором приближении их состав можно рассматривать как ЭCO3Э(OH)2=(ЭOH)2CO3 .
Уравнение протекающего процесса:
2CuCl2 + 2 Na2CO3 +H2O = (CuOH)2CO3 + CO2 + 4 NaCl .
Аналогичные малорастворимые соединения будут получаться при взаимодействии растворимых карбонатов с солями любых двухвалентных металлов, гидролизованными по катиону. Если же соли не гидролизованы, то происходит обычный обменный процесс, например:
BaCl2 + Na2CO3 = BaCO3 + 2 NaCl .
В общем случае соли Ме3+ более гидролизованы, чем соли Ме2+, поэтому, если в обсуждаемом процессе CuCl2 заменить на соль Ме3+, то следует ожидать более сильного взаимного усиления гидролиза. И действительно, при сливании растворов солей Fe3+, Al3+, Cr3+ с раствором Na2CO3 наблюдается выделение углекислого газа и выпадение осадка гидроксида металла. Другими словами, в этом случае взаимное усиление гидролиза ведет к полному (необратимому) гидролизу, например:
2FeCl3 + 3Na2CO3 + 3H2O = 2Fe(OH)3 + 6NaCl + 3CO2 .
Сходные процессы будут наблюдаться при смешении растворов солей Ме3+ с растворами других солей, гидролизованных по аниону, например:
2AlCl3 + 3Na2SO4 + 3H2O = 2Al(OH)3 + 3SO2 + 6NaCl
Cr2(SO4)3 + 3Na2S + 6H2O = 2Cr(OH)3 + 3H2S + 3Na2SO4 .
В отличие от солей гидролиз производных кислот – галогенангидридов, тиоангидридов – протекает глубоко и, зачастую, полностью (необратимо), например:
SO2Cl2 + 2H2O = H2SO4 + 2HCl ;
SOCl2 + H2O = SO2 + 2HCl ;
COCl2 + H2O = CO2 + 2HCl ;
BCl3 + 3H2O = H3BO3 + 3HCl ;
PCl3 + 3H2O = H3PO3 + 3HCl ;
CrO2Cl2 + 2H2O = H2CrO4 + 2HCl ;
t
CS2 + 2H2O = CO2 + 2H2S .
Наконец, отметим особый случай гидролиза соединений Вi(III), Sb(III), солей d-элементов – с образованием оксосоединений, например:
SbCl3 + H2O = SbOCl + 2HCl ;
Bi(NO3)3 + H2O = BiONO3 + 2HNO3 ;
Ti(SO4)2 + H2O = TiOSO4 + H2SO4 .
Константа гидролиза как и любая другая константа равновесия может быть вычислена на основе термодинамических данных.
