
- •2. Химическое равновесие
- •2.1. Истинное и кажущееся равновесие, смещение равновесия
- •2.2. Количественные характеристики равновесия
- •Задачи и упражнения
- •2.1. Устойчивое и кажущееся равновесие, смещение равновесия
- •2.2. Количественные характеристики равновесия
- •3. Некоторые равновесия в растворах
- •3.1 Образование растворов, растворимость
- •3.2 Равновесие диссоциации электролитов
- •3.3. Шкала термодинамических функций образования ионов в водных растворах
- •3.4 Равновесие растворения и диссоциации малорастворимого
- •3.5 Равновесие диссоциации воды, буферные растворы
- •3.6. Гидролиз солей
- •Задачи и упражнения
- •3.1. Образование растворов, растворимость
- •3.2. Равновесие диссоциации электролитов
- •3.3. Шкала термодинамических функций образования ионов в водных растворах
- •3.4. Равновесие растворения и диссоциации малорастворимого электролита
- •3.5. Равновесие диссоциации воды, буферные растворы
- •3.6. Гидролиз солей
3.4. Равновесие растворения и диссоциации малорастворимого электролита
Пример 1. Произведение растворимости Ag2S при 298,15 К составляет 6,9010-50. Определить:
а) растворимость Ag2S в воде (моль/л, г/л);
б) растворимость Ag2S в 0,1 М растворе AgNO3;
в) растворимость Ag2S в 0,1 М растворе Na2S;
г) в каком количестве воды растворяется 1 г Ag2S;
д) G0 процесса растворения и диссоциации Ag2S (к).
Решение:
а) Пусть растворимость Ag2S в воде составляет Р моль/л. В соответствии с уравнением растворения и диссоциации
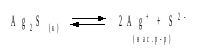
концентрации ионов составляют: [S2–] = Р , [Ag+] = 2P. Подставляем эти величины в выражение для ПР:
ПР = [Ag+]2 [S2–] = (2P)2P = 4P3 = 6,9010–50
и находим величину растворимости: Р = 2,5810–17 моль/л. Для нахождения растворимости в г/л полученное значение следует умножить на молярную массу Ag2S, получим 6,4010–15 г/л.
б) Теперь Ag2S растворяется в растворе, где уже есть ионы серебра с концентрацией 0,1 моль/л. Пусть растворимость Ag2S в этом случае составляет P1 моль/л. Концентрации ионов составят: [S2–] = P1; [Ag+] = 2P1 + 0,1.
Подставляем эти величины в выражение для ПP:
(2P1+0,1)2P1 0,01 P1 = 6,9010-50.
Находим растворимость Ag2S в 0,1 М растворе AgNO3:
P1 = 6,9010–48 моль/л.
в) В этом случае Ag2S растворяется в растворе, где уже есть анионы серы, их концентрация составляет 0,1 моль/л. Пусть растворимость Ag2S в этом растворе составляет Р2 моль/л; концентрации ионов составят: [S2–]=P2 +0,1; [Ag+] = 2P2.
Подставляем эти величины в выражение для ПР:
ПР = (2P2)2 (P2+0,1) 0,4 P22 = 6,9010–50.
Находим растворимость Ag2S в 0,1 М растворе Na2S:
Р2 = 4,1510–25 моль/л.
Как видно, в растворах с общим ионом растворимость Ag2S меньше, чем в воде – наиболее резко упала растворимость в случае раствора AgNO3.
г) В пункте а) была найдена растворимость Ag2S в воде в г/л, она составила 6,4010–15. Эта величина позволяет определить, в каком объеме воды растворяется 1 г Ag2S:
6,4010–15 г – в 1л
1 г – в Х л; откуда Х = 1,561014 л.
д) Поскольку величина ПР представляет собой константу равновесия, то значение G0 процесса растворения и диссоциации Ag2S легко вычисляется по известному соотношению:
G0= –RTlnПР = –8,31298,15ln6,9010–50 = 280,5 кДж.
Пример 2. По справочным данным определить значение растворимости СаF2 при 298,15 К.
Решение. Первоначально находим значение ПР для CaF2 по величине G0 процесса:
G0=G0обрСа2+(р-р, ст.с)+ 2G0обрF– (р-р, ст.с)–G0обрСаF2(к)=
= –552,8 + 2(–277,7) –(–1168,5) = 60,3 кДж.
G0 = – RTlnПР = –8,31298,15 ln ПР
![]()
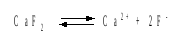
Далее в соответствии с написанным выше уравнением растворения и диссоциации CaF2 растворимость этого соединения численно равна концентрации иона кальция, а концентрация фторидного иона в 2 раза больше растворимости:
[Ca2+] = P; [F–] = 2P; ПР = [Ca2+] [F–] = P(2P)2 = 4P3 = 2,6910–11.
Отсюда растворимость равна:
![]()
Пример 3. 0,1 г BaSO4 промыты 500 мл воды. Определить возможный процент потерь осадка вследствие растворимости, считая, что промывные воды насыщены сульфатом бария. ПР BaSO4 = 1,9510–10.
Решение.Согласно уравнению:
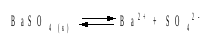
ПР BaSO4 = [Ba2+][SO42–] = PP = P2,
где Р – растворимость BaSO4 в воде.
Находим Р:
![]() моль/л
или
моль/л
или
1,3910–5 моль/л 233,4 г/моль = 3,2610–3 г/л
Соответственно, в 500 мл насыщенного раствора будет находиться 1,6310–3 г BaSO4. Отсюда возможная потеря соли вследствиерастворимости осадка составит
![]() .
.
Пример 4. Смешали 1 л 0,01 М раствора Pb(NO3)2 и З л 0,1 М раствора КI. Выпадет ли осадок РbI2, если ПРPbJ2 = З,5610–9. Считать объем окончательного раствора равным 4 л.
Решение.Для ответа на вопрос задачи следует вычислить произведение концентраций ионов Рb2+иI–в гипотетическом растворе после смешения и сравнить его с величиной ПР. В исходных растворах концентрации ионов составляли соответственно:
[Pb2+] = 0,01; [I–] = 0,1 моль/л.
После смешения они составят:
![]() моль/л;
моль/л;
![]() моль/л.
моль/л.
Произведение концентраций ионов в полученном растворе составит
ПК = [Pb2+][I–]2 = (0,0025)(0,075)2=1,4110–5.
Как видно, ПК >ПР, следовательно осадок выпадет.
Пример 5. Массовая доля растворенного вещества в насыщенном при 298,15 К водном растворе CdS составляет 1,1910–15. Определить ПР этого соединения, полагая, что плотность раствора равна 1 г/мл.
Решение. В 1 кг раствора (1 л раствора) находится 10001,1910–15 = = 1,1910–12 г CdS, что составляет 1,1910–12 : MCdS = 8,2610–15 моль.
Согласно уравнению растворения и диссоциации CdS:

концентрации ионов в насыщенном растворе составят: [Cd2+] = [S2–] = = 8,2610–15 моль/л. Находим значение ПР:
ПР = [Cd2+][S2–] = (8,2610–15)2 = 6,8210–29.
