
- •2. Химическое равновесие
- •2.1. Истинное и кажущееся равновесие, смещение равновесия
- •2.2. Количественные характеристики равновесия
- •Задачи и упражнения
- •2.1. Устойчивое и кажущееся равновесие, смещение равновесия
- •2.2. Количественные характеристики равновесия
- •3. Некоторые равновесия в растворах
- •3.1 Образование растворов, растворимость
- •3.2 Равновесие диссоциации электролитов
- •3.3. Шкала термодинамических функций образования ионов в водных растворах
- •3.4 Равновесие растворения и диссоциации малорастворимого
- •3.5 Равновесие диссоциации воды, буферные растворы
- •3.6. Гидролиз солей
- •Задачи и упражнения
- •3.1. Образование растворов, растворимость
- •3.2. Равновесие диссоциации электролитов
- •3.3. Шкала термодинамических функций образования ионов в водных растворах
- •3.4. Равновесие растворения и диссоциации малорастворимого электролита
- •3.5. Равновесие диссоциации воды, буферные растворы
- •3.6. Гидролиз солей
3.5. Равновесие диссоциации воды, буферные растворы
Пример 1. Определить рН: а) 0,01М раствора HI; б) 0,01М раствора CsOH; в) 0,01М раствора СН3СООН, Кдис = 1,7510–5.
Решение: a) HI в водном растворе является сильным электролитом, поэтому: [HI] = [H+] =0,01 моль/л. Отсюда рН = – lg 0,01 = 2.
6) CsOH – сильный электролит, поэтому: [CsOH] = [OH–] = 0,01 моль/л.
Отсюда рОН = – lg 0,01 = 2, а рН = 14 – 2 = 12.
в) CH3COOH – слабый электролит в водном растворе, уравнение диссоциации:
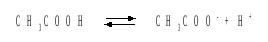
Определим концентрацию ионов водорода:
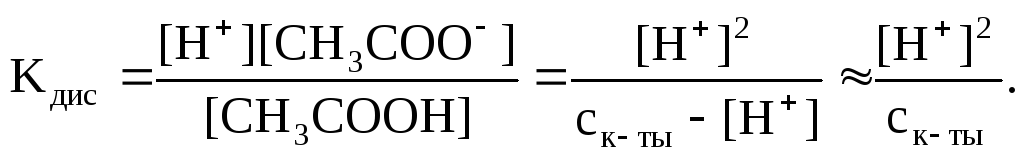
![]()
Затем находим рН раствора:
pH = – lg [H+] = –lg 4,1810-4 = 3,38.
Пример 2.рН 0,1 М раствора слабого однокислотного основания равен 11. Найти константу и степень диссоциации этого основания.
Решение. Диссоциация слабого однокислотного основания описывается схемой:
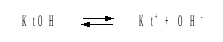
Если рН раствора равен 11, то рОН =14–11=3; отсюда [OH–]=110–3 моль/л. В соответствии с уравнением диссоциации:
![]()
![]()
Пример З. Определить рН буферного раствора, полученного смешением 1 л 0,1 М раствора СН3СООН и 2 л 0,01 М раствора CH3COONa. Считать объем окончательного раствора равным З л. Кдис СН3СООН = 1,7510–5.
Решение. В водных растворах СН3СООН и CH3COONa реализуются следующие равновесия:

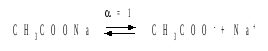
Диссоциация слабой кислоты подавлена диссоциацией соли, имеющей тот же анион, что и кислота. В силу этого:
[CH3COO-] = [CH3COO-]к-ты + [CH3COO-]соли ссоли ;
[CH3COOH] ск-ты .
Учитывая это, запишем для Кдис кислоты и [Н+]:
![]()
С учетом разбавления концентрации соли и кислоты составят:
![]()
![]()
Находим из константы диссоциации концентрацию ионов водорода и рН раствора:
![]()
Пример 4. Какой объем 0,5 М раствора ацетата натрия следует прилить к 1 л 0,1 М раствора СН3СООН, чтобы рН полученного буферного раствора составил 5. Считать, что объем полученного раствора равен сумме объемов сливаемых растворов; Кдис СH3COOH =1,7510–5.
Решение. В соответствии с формулой (3.21) для кислого буферного раствора
![]()
Отсюда:
![]()
Пусть для получения требуемого раствора к 1 л 0,1 М раствора СН3СООН следует прибавить Х л 0,5 М раствора CH3COONa. Соответственно, тогда в буферном растворе:
![]() моль/л;
моль/л;
![]() моль/л.
моль/л.
Подставляем эти величины в написанное выше соотношение:
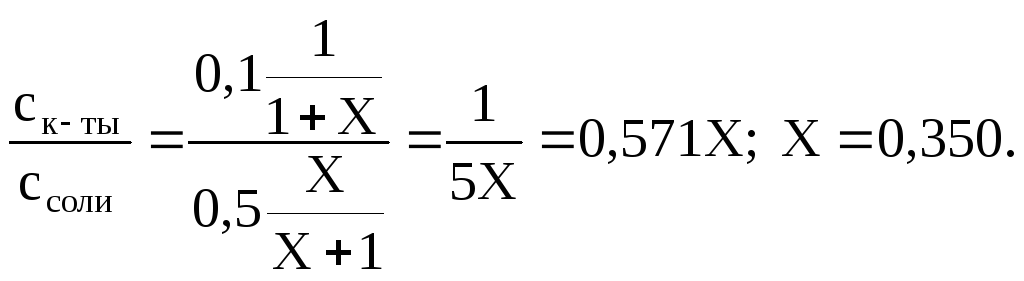
Таким образом, для получения раствора с требуемой величиной рН необходимо к 1 л 0,1 М раствора СН3СООН добавить 350 мл 0,5 М раствора CH3COONa.
Пример 5.На сколько единиц изменится рН раствора слабой одноосновной кислоты при его разбавлении в 10 раз ?
Решение.Константа диссоциации слабой одноосновной кислоты имеет вид (см. пример 1 этого раздела):
![]()
Имея в виду равенство констант диссоциации кислоты в растворах двух концентраций, запишем:
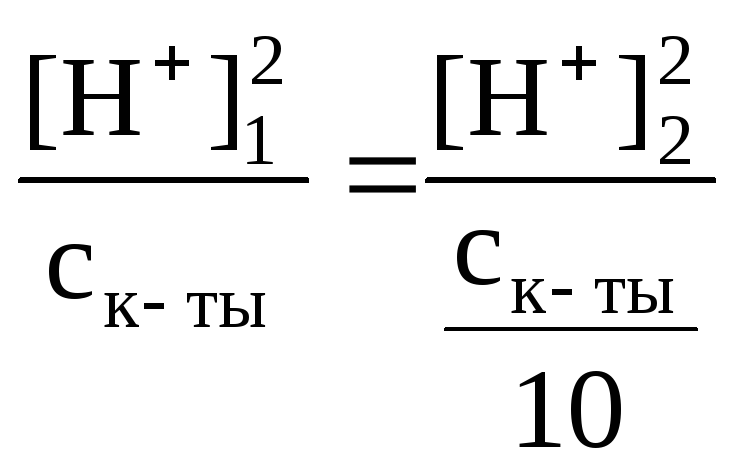 или
или
![]() .
.
Логарифмируем это соотношение:
2 lg [H+]1 = 1 + 2lg [H+]2 .
Делим обе части уравнения на 2 и меняем знаки:
![]()
pH1=pH2– 0,5.
Следовательно, при разбавлении раствора слабой одноосновной кислоты в 10 раз рН раствора возрастает на 0,5.
Пример 6. Вычислить рН насыщенного раствора Mg(OH)2. ПР Mg(OH)2 = = 1,4710–11.
Решение. В насыщенном растворе Mg(OH)2 существует равновесие:
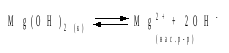
Пусть растворимость гидроксида магния в воде равна Р моль/л, тогда концентрации ионов в насыщенном растворе составят: [Mg2+] = P, [OH–] = 2P.
Подставляем эти величины в выражение для ПР:
ПР = [Mg2+] [OH–]2 = P(2P)2 = 4P3 = 1,4710–11.
Находим рН насыщенного раствора гидроксида магния:
![]() ;
[OH–]
= 2P = 3,0810–4.
;
[OH–]
= 2P = 3,0810–4.
pOH = –lg 3,0810–4 = 3,51; pH = 14 – 3,51 = 10,49.
Пример 7. Определить рН, при котором начинается осаждение Fе(ОН)3 из 0,1 М раствора FeCl3. ПР Fe(OH)3 = 6,4010–40.
Решение. Пусть растворимость Fe(OH)3 в 0,1 М растворе FeCl3 составляет Р моль/л. Тогда в соответствии с уравнением растворения и диссоциации Fе(ОН)3
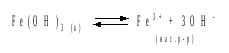
концентрации ионов в насыщенном растворе Fe(ОН)3 составят: [OH–]= 3P; [Fe3+] = 0,1 + P. Подставляем эти величины в выражение для ПР:
ПР Fe(OH)3 = [Fe3+][OH–]3 = (0,1+P)(3P)3 2,7P3 = 6,4010–40;
находим концентрацию ионов ОН– и рН начала выпадения Fе(ОН)3 из 0,1 М раствора FeCl3
![]() ;
[OH–]
= 3P = 1,8610–13;
;
[OH–]
= 3P = 1,8610–13;
pOH = –lg 1,8610–13 = 12,7; pH = 14 – pOH = 1,3.
