
- •Міністерство освіти і науки, молоді та спорту України
- •Математична обробка результатів вимірювань
- •Лабораторна робота 1 Визначення прискорення вільного падіння за допомогою математичного маятника
- •Теоретичні відомості
- •Опис приладу та методу вимірювання
- •Хід роботи
- •Обробка результатів вимірювань
- •Лабораторна робота 2 Вивчення фізичного маятника
- •Теоретичні відомості
- •Визначення моменту інерції фізичного та оберненого маятників
- •Опис приладу
- •Хід роботи
- •Обробка результатів вимірювань
- •Лабораторна робота 3 Визначення моменту інерції тіла динамічним методом
- •Теоретичні відомості
- •Лабораторна робота 4 Вивчення основного закону обертального руху твердого тіла на хрестоподібному маятнику
- •Теоретичні відомості
- •Опис приладу та методу вимірювання
- •Хід роботи
- •Лабораторна робота 5 Вивчення власних коливань зосередженої системи
- •Теоретичні відомості
- •Опис приладу
- •Хід роботи
- •Лабораторна робота 6 Визначення абсолютної та відносної вологості повітря
- •Теоретичні відомості
- •Опис приладу та методу вимірювання
- •Хід роботи
- •Лабораторна робота 7 Визначення коефіцієнта внутрішнього тертя рідини методом Стокса
- •Теоретичні відомості
- •Опис приладу та методу вимірювання
- •Хід роботи
- •Обробка результатів вимірювань
- •Лабораторна робота 8 Визначення відношення питомих теплоємностей газу методом адіабатичного розширення
- •Теоретичні відомості
- •Опис приладу та методу вимірювання
- •Хід роботи
- •Лабораторна робота 9 Визначення питомої теплоємності металів методом охолодження
- •Опис приладу
- •Хід роботи
- •Лабораторна робота 10 Визначення універсальної газової сталої
- •Теоретичні відомості
- •Опис приладу та методу вимірювання
- •Хід роботи
- •Лабораторна робота 11 Визначення коефіцієнта внутрішнього тертя, середньої довжини вільного пробігу та ефективного діаметра молекул повітря
- •Теоретичні відомості
- •Опис приладу
- •Хід роботи
- •Обробка результатів досліду
- •Густина сухого повітря за різних температур
- •Тиск і густина насиченої водяної пари за різних температур
- •Психрометрична таблиця відносної вологості повітря, %
Опис приладу та методу вимірювання
П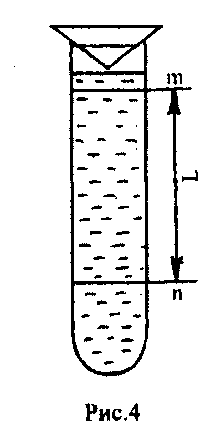 рилад
для визначення коефіцієнта в'язкості
рідини являє собою високий скляний
циліндр ( рис.7.4 ), наповнений досліджуваною
рідиною. На зовнішній поверхні циліндра
є дві рискиm
і
n
(у вигляді кілець із дроту), розташовані
на відстані L.
рилад
для визначення коефіцієнта в'язкості
рідини являє собою високий скляний
циліндр ( рис.7.4 ), наповнений досліджуваною
рідиною. На зовнішній поверхні циліндра
є дві рискиm
і
n
(у вигляді кілець із дроту), розташовані
на відстані L.
Кинута в рідину кулька спочатку рухається прискорено, а далі – рівномірно. Риску m ставлять на тому місці циліндра, де рух кульки вже напевно рівномірний (приблизно на глибині 5–8 см). У нижній частині циліндра довільно нанесена друга горизонтальна риска n.
З
Рис.
7.4
Хід роботи
1. Мікрометром виміряти діаметр кульки три рази за різними напрямками. Дані занести в табл. 7.1.
2. Виміряти штангенциркулем внутрішній радіус циліндра ( R).
3. Виміряти масштабною лінійкою відстань між рисками m і n (L).
4. Взяти пінцетом кульку й опустити її через лійку в рідину. Визначити за допомогою секундоміра час руху кульки від риски m до риски n. Результати занести до табл. 7.1.
5. Дослід провести для трьох кульок.
Обробка результатів вимірювань
1. За формулою (7.5) обчислити значення коефіцієнта в'язкості (з точністю до третього знака після коми) для кожної кульки.
2. Визначити відносну та абсолютну похибку вимірів η.
![]() .
.
3.
Результати вимірів подати у вигляді
виразу![]() .
.
Таблиця 7.1
|
№ п/п
|
Діаметр кульки |
L |
τ |
η |
| |||
|
d1 |
d2 |
d3 |
dср | |||||
|
|
|
|
|
|
|
|
| |
|
1 |
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
Лабораторна робота 8 Визначення відношення питомих теплоємностей газу методом адіабатичного розширення
Прилади та матеріали: сферичний балон із рідинним манометром і ручним насосом.
Теоретичні відомості
Під теплоємністю газу розуміють фізичну величину, чисельно рівну кількості теплоти, яку треба затратити, щоб нагріти газ на 1° С. Якщо передана кількість тепла dQ підвищує його температуру на dТ, то теплоємність дорівнює
![]() .
(8.1)
.
(8.1)
Питомою теплоємністю називають величину, яка чисельно дорівнює кількості теплоти, необхідної для нагрівання одиниці маси газу на 1° С. Якщо розглядають нагрівання одного моля газу, то теплоємність називають молярною.
Величину питомої теплоємності газу визначають не лише за його фізичною природою, а й за умовами нагрівання. Під час нагрівання газу можна залишати постійним внутрішній тиск, тоді його об'єм буде збільшуватися. Можна також підтримувати постійний об'єм газу, тоді зростатиме його тиск. У першому випадку (ізобарний процес) теплота витрачається на збільшення енергії руху молекул газу і на роботу розширення. У другому – тільки на збільшення кінетичної енергії, тобто на підвищення температури газу.
Таким чином, для нагрівання однакової маси газу на однакову кількість градусів у ході ізобарного процесу треба затратити теплоти більше, ніж під час ізохорного. Зрозуміло, що питома теплоємність газу за постійного тиску Ср більша, ніж питома теплоємність за постійного об'єму Сv.
Безпосереднє визначення величин Ср і особливо Сv пов'язане із серйозними труднощами. Тому на практиці експериментально знаходять величину γ = Cp/Сv та Сp, а потім обчислюють Сv.
Залежність характеру фізичних явищ у газах від величини γ найбільш чітко проявляється тоді, коли ці явища пов'язані з так званими адіабатичними процесами або процесами, близькими до них.
Для вивчення процесів, які відбуваються в газі під час нагрівання його за сталих об'єму й тиску, а також для знаходження величини γ=Ср/Су застосуємо рівняння Клапейрона
![]() (8.2)
(8.2)
і перший закон термодинаміки
![]() .
(8.3)
.
(8.3)
Кількість тепла dQ, переданого системі, витрачається на збільшення її внут-рішньої енергії dU і на роботу dА, яку здійснює система проти зовнішніх сил. Елементарна робота dА = РdV.
Диференціюючи рівняння (8.3) і враховуючи формулу (8.1), одержимо
![]() .
(8.4)
.
(8.4)
Із рівняння (8.4) видно, що теплоємність може мати різні значення залежно від способу нагрівання газу, оскільки одному й тому ж значенню dТ можуть відповідати різні dU і dA.
Розглянемо основні процеси, які відбуваються в ідеальному газі кількістю 1 моль.
Під час ізохорного процесу (V=const) газ не здійснює роботу (dА = 0) над зовнішніми тілами і, як видно з виразу (8.3), усе тепло йде на збільшення внутрішньої енергії газу:
![]() ,
(8.5)
,
(8.5)
де dQ – кількість тепла, переданого газу за умов постійного об'єму; dU – зміна внутрішньої енергії газу.
Із рівнянь (8.1) і (8.5) випливає, що теплоємність газу за сталого об'єму, дорівнює
![]() .(8.6)
.(8.6)
Внутрішня енергія 1 моля ідеального газу є
![]() ,
,
де і – число ступенів свободи молекул газу (і=3 – для одноатомного газу; і=5– для двохатомного газу; і=6 – для трьох- і багатоатомних газів).
Таким чином, теплоємність 1 моля газу за сталого об'єму
![]() .
(8.7)
.
(8.7)
Як видно з виразу (8.7), для ідеального газу молярна теплоємність Сv за сталого об'єму не залежить від температури.
Під час ізобарного процесу (Р=const) газ, нагріваючись, буде розширюватися і здійснювати над зовнішніми тілами позитивну роботу. Кількість тепла, переданого газу, можна описати рівнянням (8.3). Поділивши обидві частини цього рівняння на dТ і враховуючи вирази(8.1) і (8.6), одержимо (на 1 моль газу)
![]() ,
(8.8)
,
(8.8)
де
![]() ,
,
![]() .
.
Із рівняння Клапейрона (РV=RТ) (для 1 моля газу)
![]() .
(8.9)
.
(8.9)
Підставивши останній вираз (8.9) у рівняння (8.8), одержимо
![]() .
(8.10)
.
(8.10)
Позначимо співвідношення Ср / Сv як γ.
Під час ізотермічного процесу (Т=const) усе тепло витрачається на роботу, внутрішня енергія залишається постійною (dU=0), dQ=dА.
Адіабатичним називають такий процес, під час якого система не одержує і не віддає енергію тілам, що не належать до неї, тобто процес проходить без теплообміну із зовнішнім середовищем:
![]() .
.
Перший закон термодинаміки для адіабатичного процесу буде мати вигляд
![]() .
(8.11)
.
(8.11)
Це означає, що під час розширення або стискання газу робота відбувається за рахунок зміни його внутрішньої енергії.
Виведемо рівняння адіабатичного процесу. Здійснимо такі зміни в рівнянні (8.11):
![]() ,
,
![]() ,
,
тоді
![]() .
(8.12)
.
(8.12)
Диференціюючи рівняння (8.2) (для 1 моля), одержимо
![]() .
(8.13)
.
(8.13)
Поділивши рівняння (8.13) на (8.12) і враховуючи рівняння (8.10), матимемо
![]()
aбо
![]() ,
(8.14)
,
(8.14)
де γ=Cp/Cv.
Інтегруючи і потенціюючи вираз (8.14), одержимо рівняння Пуассона (рівняння адіабати):
![]() .
(8.15)
.
(8.15)
Рис.8.1
