
- •Лабораторная работа № 4. Приготовление растворов заданного количественного состава. Определение концентрации растворов титрованием.
- •1. Разделы теоретического курса для повторения.
- •2. Теоретическая часть.
- •7. Моляльность. Моляльность раствора характеризуется количеством растворенного вещества в молях, приходящихся на 1 кг растворителя в данном растворе.
- •В своей рабочей тетради запишите ответы на вопросы и упражнения из раздела 3.
- •3. Вопросы и упражнения.
- •В рабочем журнале оформите раздел 4 и распечатайте его для выполнения в лаборатории(2 стр. На листе).
- •Зависимость плотности раствора от массовой доли растворенного вещества 20◦ , (г/см3)
- •Данные для приготовления раствора заданного количественного состава
- •Результаты эксперимента по приготовлению раствора заданного количественного состава.
- •Количественный состав раствора с заданной массовой долей, выраженный иными способами.
- •Часть 2. Определение концентрации растворов кислот и щелочей титрованием.
- •Результаты титрования раствора щелочи раствором кислоты.
- •Лабораторная работа № 5 Химическая кинетика и химическое равновесие.
- •1. Разделы курса, необходимые для подготовки к лабораторной работе.
- •2. Теоретическая часть. Химическая кинетика.
- •Реагенты→ переходное состояние→ продукты реакции.
- •Химическое равновесие.
- •Смещение химического равновесия.
- •Влияние изменения концентрации на смещение химического равновесия.
- •Влияние изменения давления на смещение химического равновесия.
- •Влияние изменения температуры на смещение химического равновесия.
- •Влияние катализатора на состояние химического равновесия.
- •В своей рабочей тетради запишите ответы на вопросы и упражнения из раздела 3.
- •3. Вопросы и упражнения.
- •В рабочем журнале оформите раздел 4 и распечатайте его для выполнения в лаборатории(2 стр. На листе).
- •Опыт 1. Зависимость скорости реакции от концентрации реагирующих веществ.
- •Зависимость скорости реакции от условной концентрации раствора
- •Опыт 2. Зависимость скорости реакции от температуры.
- •Зависимость скорости реакции от температуры.
- •Опыт 3. Влияние площади поверхности на скорость реакции в гетерогенной системе.
- •Часть 2. Химическое равновесие.
- •Влияние изменения концентрации реагентов и продуктов реакции на смещение химического равновесия.
- •Лабораторная работа № 6. Электролитическая диссоциация.
- •2. Теоретическая часть.
- •Зависимость силы электролита от значения константы его диссоцации.
- •Реакции в растворах электролитов.
- •В своей рабочей тетради запишите ответы на вопросы и упражнения из раздела 3.
- •3. Вопросы и упражнения.
- •4.Экспериментальная часть.
- •Сравнение химической активности электролитов.
- •2. Влияние сильного электролита, содержащего одноименный ион, на диссоциацию слабого электролита.
- •3. Реакции обмена в растворах электролитов.
- •Лабораторная работа № 7 Водородный показатель. Гидролиз солей.
- •1. Разделы теоретического курса для повторения.
- •2. Теоретическая часть.
- •Определение рН среды колориметрическим методом.
- •Изменение окраски индикаторов в зависимости от реакции среды.
- •Определение рН среды потенциометрическим методом.
- •Гидролиз
- •Гидролиз солей.
- •В своей рабочей тетради запишите ответы на вопросы и упражнения из раздела 3.
- •3. Вопросы и упражнения.
- •4. Экспериментальная часть.
- •1. Определение реакции среды колориметрическим методом.
- •Определение реакции среды и величины водородного показателя среды некоторых растворов колориметрическим методом.
- •Б) Определение реакции среды с помощью универсальной индикаторной бумаги.
- •2. Определение рН среды потенциометрическим методом.
- •Результаты определения величины рн среды потенциометрическим методом.
- •Порядок измерения величины рН растворов.
- •3. Влияние разбавления на глубину протекания процесса гидролиза.
- •4. Влияние нагревания на процесс гидролиза.
- •5. Взаимное усиление гидролиза.
- •6. Растворение активного металла в продуктах гидролиза.
- •7. Связь между константой гидролиза Кгидр. И константой диссоциации слабого электролита, образующего гидролизующуюся соль.
Лабораторная работа № 6. Электролитическая диссоциация.
Разделы теоретического курса для повторения.
Электролиты и неэлектролиты. Общие свойства растворов неэлектролитов. Осмос. Осмотическое давление. Закон Вант-Гоффа. Законы Рауля. Повышение температуры кипения и понижение температуры замерзания раствора по сравнению с чистым растворителем. Криоскопическая и эбулиоскопическая константы. Отличие свойств растворов солей кислот и оснований от свойств растворов неэлектролитов. Изотонический коэффициент. Основные положения теории электролитической диссоциации. Свойства кислот, оснований и солей с точки зрения теории электролитической диссоциации. Амфотерные электролиты. Ступенчатая диссоциация. Факторы, влияющие на процесс электролитической диссоциации. Количественные характеристики процесса диссоциации: степень и константа диссоциации. Закон разбавления Оствальда. Сильные и слабые электролиты. Ионные равновесия в растворах слабых электролитов. Уравнения реакций в растворах электролитов в полной и сокращенной ионно-молекулярных формах. Условия практической необратимости реакций ионного обмена. Влияние внешних факторов на процесс диссоциации. Диссоциация комплексных соединений. Произведение растворимости. Условия образования и растворения осадков.
При изучении теории по этому разделу и для подготовки к лабораторной работе рекомендуется воспользоваться материалом, изложенным в гл. 8 учебного пособия Рыбальченко В.С. « Основы общей химии» и изучить материал, предлагаемый в следующем разделе.
2. Теоретическая часть.
Все вещества по способности проводить электрический ток можно подразделить на две группы: проводники и диэлектрики. Среди проводников есть вещества, которые проводят электрический ток за счет направленного движения электронов проводники I рода. К таким веществам относятся металлы, характеризующиеся электронной проводимостью. Существуют вещества способные проводить электрический ток в растворенном или расплавленном состояниях. Эту способность обуславливают ионы, образующиеся при диссоциации данных веществ, при растворении в полярных растворителях или при плавлении при повышенных температурах. Такие вещества, растворы или расплавы которых содержат подвижные ионы, называют электролитами. В отличие от металлов электролиты относятся к проводникам II рода и характеризуются ионной проводимостью. К электролитам относятся кислоты, основания и соли. Это вещества с ионным или ковалентным полярным типом связи.
Неэлектролитами называются вещества, растворы или расплавы которых не содержат ионов, а, следовательно, не могут проводить электрический ток. Это вещества с ковалентными неполярными или малополярными химическими связями.
Например:
некоторые газы (азот, кислород)
некоторые твердые вещества (сера, кремний, медь)
некоторые органические соединения (сахароза, бензин, спирт).
Сухая кристаллическая соль хлорид натрия электрический ток не проводит. Имеющиеся в кристаллической решетке хлорида натрия ионы натрия (Nа+) и (Сl-) сильно притягиваются друг к другу и не могут свободно перемещаться. При растворении соли в воде ионы, образующие данный электролит, под действием полярных молекул воды отрываются друг от друга и распределяются между молекулами растворителя. Происходит процесс электролитической диссоциации.
Электролитическая диссоциация – процесс распада электролита в растворе с образованием положительно заряженных ионов (катионов) и отрицательно заряженных ионов (анионов).
При растворении в воде или при плавлении неэлектролитов, например, сахара происходит распад его кристаллов только на отдельные электронейтральные молекулы. При этом ионов не образуется и растворы или расплавы неэлектролитов электрический ток не проводят.
Для объяснения особенностей поведения электролитов шведским ученым С. Аррениусом в 1887 году была предложена теория, получившая название теории электролитической диссоциации. Сущность данной теории состоит в следующем:
1. Электролиты при растворении или в расплаве распадаются, диссоциируют на ионы – заряженные положительно (катионы) и заряженные отрицательно (анионы). Свойства ионов совершенно иные, чем у образовавших их атомов.
2. Под действием разности потенциалов, между электродами, погруженными в раствор электролита, ионы приобретают направленное движение, положительно заряженные ионы (катионы) движутся к отрицательно заряженному электроду (катоду), отрицательно заряженные (анионы) - к положительно заряженному электроду (аноду). Раствор электролита проводит электрический ток.
3. Диссоциация в общем случае является процессом обратимым. Это означает, что параллельно с распадом молекул на ионы (диссоциация), идет обратный процесс соединения ионов в молекулы (ассоциация).
Чтобы отметить эту особенность процессов электролитической диссоциации в уравнениях знак равенства заменяют знаком обратимости (). Например, уравнение диссоциации молекул некоторого электролита (КtАn) на катион Кt+ и анион Аn- записывается в виде:
КtАn Кt+ + Аn-
Если электролит является сильным (см. далее), то преимущественно протекает процесс распада на ионы, а обратный процесс ассоциации выражен незначительно. Изображая диссоциацию таких электролитов, вместо знака обратимости ставят одну стрелку, указывающую на направление преимущественного протекание процесса.
С точки зрения теории электролитической диссоциации кислоты (по Аррениусу) – сложные вещества, диссоциирующие на катионы водорода и анионы кислотного остатка:
HCl H+ + Cl-
Кислотные остатки (С1-, NO3- и др.) для различных кислот различны, но общим для всех кислот является образование в растворах иона водорода (H+). Наличие в растворах кислот иона водорода, точнее, гидратированного иона водорода - гидроксония (H+∙H2O или Н3O+), обусловливает общие свойства кислот: кислый вкус, действие на индикаторы, взаимодействие с металлами с выделением водорода и др.
Основания (по Аррениусу)– сложные вещества, диссоциирующие анионы гидроксила и катионы металла (или заменяющих его групп).
Например:
NаOH Na+ + OH-
Общие свойства оснований (мыльность на ощупь, соответствующее действие на индикатор, взаимодействие с кислотами и др.) определяются наличием в растворах оснований ионов гидроксила (ОН-).
Солями называются сложные вещества, диссоциирующие на катионы металла и анионы кислотного остатка.
Например:
Al2(SO4)3 2Al3+ + 3SO4 2-
Для количественной оценки процесса электролитической диссоциации используется понятие степени электролитической диссоциации.
Степень электролитической диссоциации - это отношение числа молекул, распавшихся на ионы (n), к общему числу молекул растворенного вещества (No) в растворе:

Степень диссоциации выражается в долях единицы или в процентах.
Например, если = 30%, то это означает, что из каждых 100 молекул электролита на ионы распадается 30 молекул ( = 0, 3).
Степень электролитической диссоциации зависит от:
природы растворяемого вещества,
природы растворителя,
температуры,
концентрации раствора.
Зависимость диссоциации от природы электролита определяется полярностью связей между атомами в частице электролита. Вещества с ковалентными неполярными или малополярными связями либо не диссоциируют, либо диссоциируют незначительно. Хорошо распадаются на ионы вещества с ковалентными сильно полярными или ионными связями. Следовательно, в растворах хлорида натрия (ионная связь), хлороводорода (ковалентная полярная связь) и хлора (ковалентная неполярная связь) распадаться на ионы будут NаС1 и НС1, а Сl2 будет находиться в растворе в виде молекул.
Если же в растворе оказываются молекулы сложных веществ с различным видом связи, то распад молекулы на ионы произойдет в том месте молекулы, где атомы связаны ионной или ковалентной сильно полярной связью.
Например, молекула гидрокарбоната калия КНСО3 характеризуется наличием ионных (К–О) и ковалентных полярных (Н–О и С–О) связей.

 К
– О ОЭО (К) = 0,91
К
– О ОЭО (К) = 0,91
0,91 3,5 С = О ОЭО (Н) = 2,1

 Н
– О 2,5
ОЭО
(С) = 2,5
Н
– О 2,5
ОЭО
(С) = 2,5
2,1 3,5 ОЭО (О) = 3,5
ΔОЭО (К–О) = 3,5–0,91=2,59 связь ионная;
ΔОЭО (Н–О) = 3,5–2,1=1,4 связь ковалентная сильнополярная;
ΔОЭО (С–О) = 3,5–2,5=1,0 связь ковалентная слабополярная.
Наибольшую величину разности относительных электроотрицательностей (ΔО.Э.О.) имеет связь К-О и, поэтому, диссоциация обусловлена разрывом этой, наиболее полярной (фактически ионной) связи:
I ступень: КНСО3 К+ + НСО3-
Диссоциация этого вещества возможна и по второй ступени. Она связана с разрывом достаточно сильно полярной связи Н – О и протекает незначительно:
II cтупень: НСО3- Н+ + СО32-
Разрыв малополярной связи С - О не происходит.
Важную роль в процессе диссоциации играет растворитель. Чем большей полярностью обладают молекулы растворителя, тем лучше диссоциирует в нем данный электролит, и тем больше степень диссоциации последнего. Если представить диссоциирующее вещество как систему из двух точечных зарядов, то сила взаимодействия ионов (F), на которые диссоциирует данное вещество, определяется в соответствии с законом Кулона:
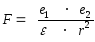
Эта сила зависит не только от величины зарядов частиц (е1 и е2) и расстояния между ними ( r ), но и от природы среды, в которой взаимодействуют частицы. Природа среды характеризуется значением диэлектрической проницаемости ( ), которая показывает, во сколько раз сила взаимодействия между зарядами в данной среде меньше, чем в вакууме.
Ниже приведены значения величин диэлектрической проницаемости некоторых растворителей при 25°С.
Вода = 80
Аммиак жидкий = 25,4
Этиловый спирт = 25,2
Бензол = 2,3
Раствор хлороводорода в бензоле ( = 2,3) практически не диссоциирует и не проводит электрический ток, в то время как в воде ( = 80) хлороводород диссоциирует хорошо и раствор проводит электрический ток.
Повышение температуры, как правило, увеличивает диссоциацию и при нагревании степень диссоциации возрастает.
При уменьшении концентрации электролита, т.е. при разбавлении раствора, степень диссоциации увеличивается. Поэтому, говоря о степени диссоциации, следует указывать концентрацию раствора.
В зависимости от величины степени электролитической диссоциации различают сильные и слабые электролиты.
По величине степени диссоциации в 0,1 н. растворах все электролиты можно подразделить:
= 0 неэлектролиты,
0<<3% электролиты слабые,
3%<<30% электролиты средней силы,
>30% электролиты сильные.
К сильным электролитам относятся:
почти все растворимые соли (СuSО4, BaС12, KВr),
такие неорганические кислоты, как: HCl, HBr, HI, HClO4, H2SO4, HNO3, HMnO4, HCrO4 и некоторые другие;
растворимые в воде основания: LiOH, NaOH, KOH, RbOH, CsOH, Ba(OH)2, Sr(OH)2 (кроме гидроксида аммония NH4OH, который является слабым электролитом!)
К слабым электролитам относятся:
почти все органические кислоты, например, стеариновая С17Н35ООН, уксусная СН3СООН;
некоторые минеральные кислоты, например, Н2СО3, Н2S, Н2SiO3;
нерастворимые в воде соли и гидроксиды металлов, например, BaSO4, Ca3(PO4)2, Al(ОН)3, Сu(ОН)2, Fе(ОН)3.
комплексные катионы или анионы, которые представляют из себя сложные ионы образующиеся при диссоциации в растворе, так называемых, комплексных соединений (солей, кислот и оснований), например: [Al(OH)4]-, [Cu(NH3)4]2- и др.
К слабым электролитам относится также вода.
Второй количественной характеристикой процесса диссоциации является константа диссоциации (Кд).
Константа диссоциации представляет собой константу равновесия процесса диссоциации слабого электролита и, в отличии от степени диссоциации, не зависит от концентрации растворенного вещества в растворе.
Значения величин констант диссоциации для ряда электролитов приведены в приложении (таблица 8).
Например, циановодородная (синильная) кислота, является слабым электролитом. Как любая кислота она диссоциирует с образованием катионов водорода и анионов кислотного остатка:
HCN H+ + CN-
Равновесие этого процесса характеризуется соответствующей константой диссоциации.
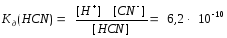
Малая величина константы диссоциации позволяет судить о незначительном распаде кислоты на ионы и смещении равновесия процесса диссоциации влево.
Равновесие процесса диссоциации в водном растворе такого вещества, как гидроксид аммония, можно представить следующим образом:
NH4OH NH4+ + OH-
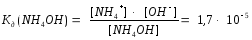
Чем меньше величина константы диссоциации электролита, тем он слабее.
Величины констант диссоциации для ряда слабых электролитов приведены в табл.8 приложения.
Ориентируясь на значение величины константы диссоциации можно делать заключение о силе электролита.
